Sarilumab
Sarilumab ist ein humaner monoklonaler Antikörper, der die IL-6-vermittelte Signalweiterleitung hemmt und so gegen Entzündungen wirkt. Das Medikament ist zur Behandlung der mittelschweren bis schweren aktiven rheumatoiden Arthritis unter dem Namen Kevzara zugelassen.
Sarilumab: Übersicht
Anwendung
Der monoklonale Antikörper Sarilumab (Kevzara) wird in Kombination mit Methotrexat (MTX) angewendet zur Behandlung der mittelschweren bis schweren aktiven rheumatoiden Arthritis (RA) bei erwachsenen Patienten, die auf ein oder mehrere krankheitsmodifizierende antirheumatische Arzneimittel (DMARDs) unzureichend angesprochen oder diese nicht vertragen haben.
Sarilumab kann auch als Monotherapie eingesetzt werden, wenn MTX nicht vertragen wird oder wenn eine Behandlung mit MTX ungeeignet ist.
Anwendungsart
Sarilumab wird subkutan angewendet. Die Injektionsstellen sollten bei jeder Injektion abgewechselt werden. Sarilumab darf weder in empfindliche, verletzte oder vernarbte Hautstellen noch in Hautstellen mit Blutergüssen verabreicht werden. Patienten können Sarilumab auch selbst anwenden, wenn der behandelnde Arzt dies für angemessen erachtet.
Wirkmechanismus
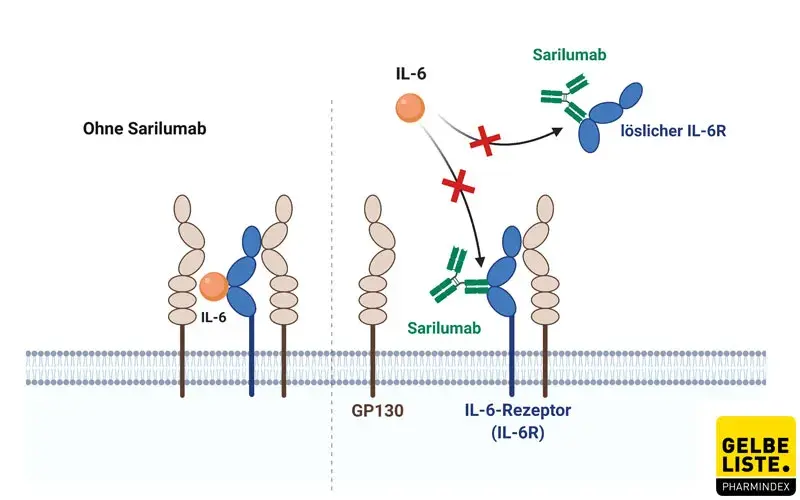
Sarilumab ist ein monoklonaler, gegen den Interleukin-6-Rezeptor gerichteter Antikörper, der sowohl an lösliche als auch an membrangebundene Interleukin-6-Rezeptoren (IL-6Rα) spezifisch bindet. Er hemmt die IL-6-vermittelte Signalweiterleitung. IL-6 ist an Entzündungsprozessen beteiligt und in den Gelenken von Patienten mit rheumatoider Arthritis in hohen Konzentrationen vorhanden. Indem Sarilumab verhindert, dass IL-6 an seine Rezeptoren bindet, reduziert Sarilumab Entzündungen und andere mit rheumatoider Arthritis assoziierte Symptome.
IL-6 spielt möglicherweise auch eine Rolle bei der durch SARS-CoV-2 ausgelösten überschießenden Entzündungsreaktion des Körpers, die u.a. die Lunge von infizierten Patienten betrifft, weshalb Sarilumab auch zur Behandlung von COVID-19 in klinischen Studien untersucht wird.
Pharmakokinetik
Resorption
- Die absolute Bioverfügbarkeit für Sarilumab nach subkutaner Injektion wird auf 80% geschätzt.
- Die beobachtete mediane Zeit bis zur maximalen Arzneimittelkonzentration (tmax) nach einmaliger subkutaner Gabe betrug 2 bis 4 Tage.
- Nach Mehrfachdosierung von 150 mg oder 200 mg alle zwei Wochen wurde der Steady State nach 12 bis 16 Wochen erreicht, wobei im Vergleich zu einer Einzeldosis eine 2- bis 3-fach erhöhte Konzentration festgestellt wurde.
- Beim Dosierungsschema mit 150 mg Sarilumab alle zwei Wochen lagen die geschätzten Mittelwerte (± Standardabweichung [SD]) für die Steady-State-Area under the Curve (AUC) bei 210 ± 115 mg*Tag/l, für die Minimalkonzentration (cmin) bei 6,95 ± 7,60 mg/l bzw. die Maximalkonzentration (cmax) bei 20,4 ± 8,27 mg/l.
- Beim Dosierungsschema mit 200 mg Sar-lumab alle zwei Wochen lagen die geschätzten Mittelwerte (± SD) für die Steady-State-AUC bei 396 ± 194 mg*Tag/l, für die cmin bei 16,7 ± 13,5 mg/l bzw. für die cmax bei 35,4 ± 13,9 mg/l.
Verteilung
- Bei Patienten mit RA betrug das scheinbare Verteilungsvolumen im Steady State 8,3 l.
Biotransformation
- Der Stoffwechselweg von Sarilumab wurde nicht näher charakterisiert.
- Als monoklonaler Antikörper wird Sarilumab katabolisch in kleine Peptide und Aminosäuren aufgespalten wie endogenes IgG.
Elimination
- Sarilumab wird sowohl linear als auch nichtlinear eliminiert.
- Bei höheren Konzentrationen erfolgt die Elimination vorwiegend über eine lineare, nicht sättigbare Proteolyse, während bei geringeren Konzentrationen die nichtlineare sättigbare zielvermittelte Elimination überwiegt.
- Diese parallelen Eliminationswege resultieren in einer initialen Halbwertszeit von 8 bis 10 Tagen und einer geschätzten effektiven Halbwertszeit im Steady State von 21 Tagen.
Linearität/Nicht-Linearität
- Bei Patienten mit RA wurde eine im Vergleich zur Dosis überproportional erhöhte pharmakokinetische Exposition beobachtet.
- Im Steady State erhöhte sich die Exposition im Verlauf des Dosierungsintervalls, gemessen als AUC, um etwa das Doppelte bei einer 1,33-fachen Erhöhung der Dosis von 150 mg alle zwei Wochen auf 200 mg alle zwei Wochen.
Besondere Patientengruppen
- Alter, Geschlecht und ethnische Herkunft haben keine signifikanten Auswirkungen auf die Pharmakokinetik von Sarilumab.
- Das Körpergewicht beeinflusste die Pharmakokinetik von Sarilumab. Bei Patienten mit erhöhtem Köpergewicht (>100 kg) waren die 150-mg- als auch 200-mg-Dosis nachweislich wirksam. Allerdings hatten Patienten mit einem Körpergewicht von >100 kg einen stärkeren therapeutischen Nutzen von der 200-mg-Dosis.
- Eine leichte bis mittelschwere Nierenfunktionsstörung hatte keinerlei Auswirkung auf die Pharmakokinetik von Sarilumab. Patienten mit einer schweren Nierenfunktionsstörung wurden nicht untersucht.
- Zu den Auswirkungen einer Leberfuntionsstörung auf die Pharmakokinetik von Sarilumab wurde keine formelle Studie durchgeführt.
Dosierung
Die empfohlene Dosis Sarilumab beträgt 200 mg einmal alle zwei Wochen als subkutane Injektion.
Nebenwirkungen
Die am häufigsten in klinischen Studien mit Sarilumab beobachteten Nebenwirkungen waren:
- Neutropenie
- erhöhte Alanin-Amino-tranferase-(ALT-)Werte
- Erythem an der Injektionsstelle
- Infektionen der oberen Atemwege
- Harnwegsinfektionen
Die häufigsten schwerwiegenden Nebenwirkungen waren Infektionen.
Wechselwirkungen
- Die begleitende Gabe von MTX hat keinen Einfluss auf die Exposition von Sarilumab. Es wird davon ausgegangen, dass auch die MTX-Exposition nicht beeinflusst wird. Dazu wurden jedoch keine klinischen Daten erhoben.
- Sarilumab wurde nicht in Kombination mit Januskinase-(JAK-)Inhibitoren oder biologischen DMARDs wie beispielsweise Tumornekrosefaktor-(TNF-)Antagonisten untersucht.
- Verschiedene In-vitro- und einige In-vivo-Studien beim Menschen haben gezeigt, dass Zytokine und Zytokinmodulatoren die Expression und Aktivität spezifischer Cytochrom- P450-(CYP-)Enzyme (CYP1A2, CYP2C9, CYP2C19 und CYP3A4) beeinflussen können und somit potenziell die Pharmakokinetik begleitend verabreichter Substrate dieser Enzyme verändern können.
- Erhöhte IL-6-Werte können ein Herunterregeln der CYP-Aktivität bewirken, wie beispielsweise bei RA-Patienten, und auf diese Weise Wirkstoffspiegel im Vergleich zu Patienten ohne RA ansteigen lassen.
- Die Blockade des IL-6-Signalwegs durch IL-6Rα-Antagonisten wie beispielsweise Sarilumab könnte die hemmende Wirkung von IL-6 aufheben sowie die CYP-Aktivität wiederherstellen und dadurch zu veränderten Arzneimittelspiegeln führen.
- Bei CYP-Substraten mit geringer therapeutischer Breite und individueller Dosisanpassung kann die durch Sarilumab hervorgerufene Modulation der Wirkung von IL-6 auf die CYP-Enzyme klinisch relevant sein (z. B. bei Warfarin oder Theophyllin). Hier ist die Wirkung oder die Wirkstoffkonzentration therapeutisch zu überwachen und die individuelle Arzneimitteldosierung nach Bedarf anzupassen.
- Bei Patienten, die die Sarilumab-Therapie während einer laufenden Behandlung mit CYP3A4-Substraten (z. B. orale Kontrazeptiva oder Statine) beginnen, ist Vorsicht geboten, da Sarilumab den inhibitorischen Effekt von IL-6 aufheben sowie die CYP3A4-Aktivität wiederherstellen kann und dadurch zu einer Abnahme der Exposition und Aktivität von CYP3A4-Substraten führt.
- Wechselwirkungen zwischen Sarilumab und Substraten anderer CYP-Enzyme (CYP2C9, CYP2C19, CYP2D6) wurden nicht untersucht.
Kontraindikationen
Sarilumab darf nicht angewendet werden bei Überempfindlichkeit gegen den Wirkstoff oder einen der sonstigen Bestandteile des Arzneimittels sowie aktiven schweren Infektionen.
Schwangerschaft
Bisher liegen keine oder nur sehr begrenzte Erfahrungen mit der Anwendung von Sarilumab bei Schwangeren vor, weshalb das Medikament während der Schwangerschaft nicht angewendet werden darf, es sei denn, ßeine Behandlung mit Sarilumab ist aufgrund des klinischen Zustandes der Frau erforderlich.
Stillzeit
Es ist nicht bekannt, ob Sarilumab in die Muttermilch übergeht oder nach Einnahme systemisch resorbiert wird. Da IgG1 beim Menschen in die Muttermilch übergeht, muss eine Entscheidung darüber getroffen werden, ob das Stillen zu unterbrechen ist oder ob die Behandlung mit Sarilumab zu unterbrechen ist. Dabei sind sowohl der Nutzen des Stillens für das Kind als auch der Nutzen der Therapie für die Frau zu berücksichtigen.
Verkehrstüchtigkeit
Sarilumab hat keinen oder einen zu vernachlässigenden Einfluss auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen.
Alternativen
Sarilumab wirkt prinzipiell über den gleichen Wirkmechanismus wie der IL-6-Rezeptor-Antagonist Tocilizumab. Strukturell und pharmakokinetisch bestehen jedoch Unterschiede. Bei Sarilumab handelt es sich um den ersten vollständig humanen anti-IL-6R-Antikörper. In pharmakokinetischen Studien wurde gezeigt, dass Sarilumab eine höhere Bindungsaffinität für den IL-6R und dementsprechend eine geringere Dissoziationskonstante als Tocilizumab aufweist.
-
Kevzara 150 mg Abacus Injektionslösung im Fertigpen
Abacus Medicine A/S
-
Kevzara 150 mg Abacus Injektionslösung in einer Fertigspritze
Abacus Medicine A/S
-
Kevzara 150 mg Eurim Injektionslösung im Fertigpen
Eurim-Pharm Arzneimittel GmbH
-
Kevzara 150 mg Injektionslösung im Fertigpen
Sanofi-Aventis Deutschland GmbH
-
Kevzara 150 mg Injektionslösung in einer Fertigspritze
Sanofi-Aventis Deutschland GmbH
-
Kevzara 150 mg kohlpharma Injektionslösung im Fertigpen
kohlpharma GmbH
-
Kevzara 150 mg kohlpharma Injektionslösung in einer Fertigspritze
kohlpharma GmbH
-
Kevzara 150 mg Orifarm Injektionslösung im Fertigpen
Orifarm GmbH
-
Kevzara 150 mg Paranova Injektionslösung im Fertigpen
Paranova Pack A/S
-
Kevzara 200 mg Abacus Injektionslösung in einem Fertigpen
Abacus Medicine A/S
-
Kevzara 200 mg Abacus Injektionslösung in einer Fertigspritze
Abacus Medicine A/S
-
Kevzara 200 mg axicorp Injektionslösung im Fertigpen
axicorp Pharma GmbH
-
Kevzara 200 mg axicorp Injektionslösung in einer Fertigspritze
axicorp Pharma GmbH
-
Kevzara 200 mg CC Pharma Injektionslösung im Fertigpen
CC Pharma GmbH
-
Kevzara 200 mg CC Pharma Injektionslösung in einer Fertigspritze
CC Pharma GmbH
-
Kevzara 200 mg Eurim Injektionslösung im Fertigpen
Eurim-Pharm Arzneimittel GmbH
-
Kevzara 200 mg Eurim Injektionslösung in einer Fertigspritze
Eurim-Pharm Arzneimittel GmbH
-
Kevzara 200 mg Haemato-Pharm Injektionslösung im Fertigpen
HAEMATO PHARM GmbH
-
Kevzara 200 mg Injektionslösung im Fertigpen
Sanofi-Aventis Deutschland GmbH
-
Kevzara 200 mg Injektionslösung in einer Fertigspritze
Sanofi-Aventis Deutschland GmbH
-
Kevzara 200 mg kohlpharma Injektionslösung im Fertigpen
kohlpharma GmbH
-
Kevzara 200 mg kohlpharma Injektionslösung in einer Fertigspritze
kohlpharma GmbH
-
Kevzara 200 mg NMG Pharma Injektionslösung im Fertigpen
NMG Pharma GmbH
-
Kevzara 200 mg Orifarm Injektionslösung im Fertigpen
Orifarm GmbH
-
Kevzara 200 mg Orifarm Injektionslösung in einer Fertigspritze
Orifarm GmbH
-
Kevzara 200 mg Paranova Injektionslösung im Fertigpen
Paranova Pack A/S














