Satralizumab
Satralizumab ist ein humanisierter monoklonaler Antikörper, der sich gegen den Interleukin-6-Rezeptor (IL-6R) richtet und zur Behandlung von Neuromyelitis-optica-Spektrum-Erkrankungen (NMOSD) zugelassen ist. IL-6 spielt in der Pathogenese dieser Erkrankungen eine inflammatorische Schlüsselrolle.
Satralizumab: Übersicht

Anwendung
Der humanisierte monoklonale Antikörper Satralizumab ist indiziert als Monotherapie oder in Kombination mit einer immunsuppressiven Therapie (IST) zur Behandlung von Neuromyelitis-optica-Spektrum-Erkrankungen (NMOSD) bei Erwachsenen und Jugendlichen ab 12 Jahren, die anti-Aquaporin-4-IgG-(AQP4-IgG-)seropositiv sind.
Über NMOSD
NMOSD sind eine Gruppe seltener, chronisch entzündlicher Autoimmunerkrankungen des zentralen Nervensystems, die zu schweren Schäden vorwiegend am Sehnerv und am Rückenmark und zu irreversiblen kumulativen Behinderungen wie Blindheit und Gehunfähigkeit führen können. NMOSD werden häufig mit pathogenen Antikörpern (AQP4-IgG) assoziiert, die gegen einen spezifischen Zelltyp, die sogenannten Astrozyten, gerichtet sind und diesen schädigen. Die Folge sind entzündliche Läsionen der Sehnerven, des Rückenmarks und des Gehirns. AQP4-IgG-Antikörper sind im Blutserum von rund drei Viertel der NMOSD-Patienten nachweisbar.
Obwohl die meisten NMOSD-Fälle mittels eines Diagnosetests bestätigt werden können, erhalten Menschen, die mit der Erkrankung leben, immer noch häufig die Fehldiagnose Multiple Sklerose. Dies kann zu Verzögerungen bei der korrekten Diagnose führen und eine Behandlung mit Medikamenten zur Folge haben, die den Krankheitsverlauf verschlechtern. Ursachen für die Fehldiagnose sind die sich überschneidenden Merkmale dieser Erkrankungen, darunter die höhere Prävalenz bei Frauen, die ähnlichen Symptome und die Tatsache, dass diese Krankheiten durch einen schubförmigen Verlauf gekennzeichnet sind.
Wirkmechanismus
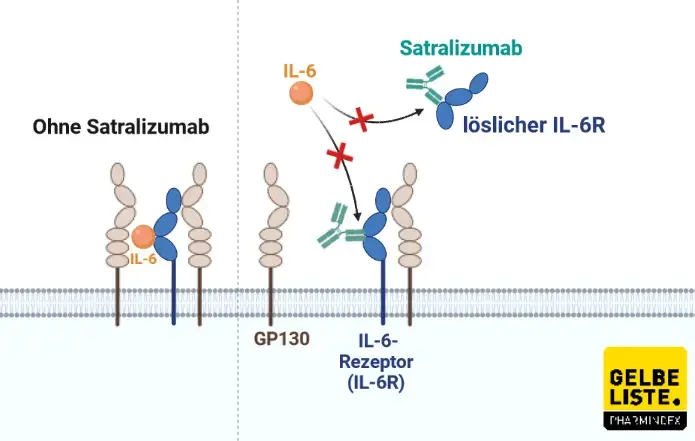
Satralizumab ist ein humanisierter monoklonaler IgG2-Antikörper, was durch die Endung „zumab“ gekennzeichnet wird. Der Antikörper bindet spezifisch an die lösliche und membrangebundene Form des humanen Interleukin-6-Rezeptors (IL-6R). Infolgedessen wird die Interaktion zwischen IL-6 und IL-6R unterbunden, wodurch die nachgeschaltete Signalkaskade inhibiert wird.
Bei Patienten mit NMO und NMOSD ist in den Phasen der Krankheitsaktivität die IL-6-Konzentration in der Zerebrospinalflüssigkeit und im Serum erhöht.
Das pro-inflammatorische Zytokin Interleukin-6 ist maßgeblich an der Pathogenese von NMO und NMOSD beteiligt, unter anderem an:
- B-Zell-Aktivierung
- Differenzierung von B-Lymphozyten zu Plasmablasten
- Produktion von pathologischen Autoantikörpern (z.B. gegen AQP4, einem Wasserkanalprotein, das hauptsächlich durch Astrozyten im zentralen Nervensystem exprimiert wird)
- Th17-Zell-Aktivierung und -Differenzierung
- Inhibierung von regulatorischen T-Zellen (Tregs)
- Veränderungen der Permeabilität der Blut -Hirn-Schranke
Dosierung
Initialdosis
Die empfohlene Initialdosis für die ersten drei Anwendungen beträgt 120 mg als subkutane (s.c.) Injektion alle zwei Wochen (erste Dosis in Woche 0, zweite Dosis in Woche 2 und dritte Dosis in Woche 4).
Erhaltungsdosis
Die empfohlene Erhaltungsdosis beträgt 120 mg als s.c. Injektion alle vier Wochen.
Nebenwirkungen
Die häufigsten Nebenwirkungen unter der Anwendung von Enspryng gemeldeten Nebenwirkungen waren:
- Kopfschmerzen (19,2%)
- Arthralgie (13,5%)
- verringerte Leukozytenzahl (13,5%)
- Hyperlipidämie (13,5%)
- injektionsbedingte Reaktionen (12,5%)
Wechselwirkungen
Es wurden keine Studien zur Erfassung von Wechselwirkungen durchgeführt. Doch wurde in pharmakokinetischen Populationsanalysen kein Effekt von Azathioprin, oralen Glukokortikoiden oder Mycophenolatmofetil auf die Satralizumab-Clearance festgestellt.
CYP-Interaktionen
Sowohl In-vitro- als auch In-vivo-Studien haben gezeigt, dass die Expression spezifischer hepatischer CYP450-Enzyme (CYP1A2, CYP2C9, CYP2C19 und CYP3A4) durch Zytokine wie IL-6 supprimiert wird.
Deshalb ist bei Beginn oder Absetzen der Behandlung mit Satralizumab Vorsicht bei Patienten geboten, die bereits CYP450 3A4-, -1A2-, -2C9- oder -2C19-Substrate erhalten, insbesondere Substrate mit engem therapeutischem Fenster (wie Warfarin, Carbamazepin, Phenytoin und Theophyllin).
Dosisanpassungen sind bei Bedarf vorzunehmen.
CAVE: Lange Halbwertszeit
Aufgrund der verlängerten terminalen Halbwertszeit von Satralizumab kann die Wirkung von Satralizumab mehrere Wochen nach Behandlungsende anhalten.
Kontraindikationen
Satralizumab darf nicht angewendet werden bei Überempfindlichkeit gegen den Wirkstoff oder einen der sonstigen Bestandteile des Arzneimittels.
Schwangerschaft
Bisher liegen keine Erfahrungen mit der Anwendung von Satralizumab bei Schwangeren vor. Aus Studien an Affen ergaben sich keine Hinweise auf eine Reproduktionstoxizität. Als Vorsichtsmaßnahme wird jedoch empfohlen, Satralizumab während der Schwangerschaft nicht anzuwenden.
Stillzeit
Es ist nicht bekannt, ob Satralizumab in die Muttermilch übergeht. Humanes Immunglobulin G (IgG) geht bekanntermaßen während der ersten Tage nach der Geburt in die Muttermilch über und sinkt kurz danach auf geringe Konzentrationen ab. Daher kann ein Risiko für gestillte Säuglinge während dieser kurzen Zeitspanne nicht ausgeschlossen werden. Nach dieser Zeitspanne sollte die Anwendung von Satralizumab während der Stillzeit nur bei klinischer Notwendigkeit erfolgen.
Verkehrstüchtigkeit
Satralizumab hat keinen oder einen zu vernachlässigenden Einfluss auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen.
Alternativen
Zur medikamentösen Therapie der NMOSD stehen in Abhängigkeit patientenindividueller Faktoren (Alter, Erkrankungsstadium, Komorbiditäten) diese alternativen Immunsuppressiva zur Verfügung:
- Methotrexat (MTX)
- Azathioprin (AZA)
- Mycophenolat-Mofetil (MMF)
- Rituximab (Anti-CD20-Antikörper)
- Eculizumab (Anti-C5-Antikörper)
- Tocilizumab (Anti-IL-6R-Antikörper)
Seit August 2022 ist auch der gegen CD19 gerichtete Antikörper Inebilizumab (Uplizna) als Monotherapie bei erwachsenen Patienten mit NMOSD indiziert, die Anti-Aquaporin-4-Immunglobulin-G(AQP4-IgG)-seropositiv sind.
- EMA: Fachinformation Satralizumab
- Freissmuth et al., Pharmakologie und Toxikologie, 2020, Springer
- Mutschler et al., Mutschler Arzneimittelwirkungen, 2019, Wissenschaftliche Verlagsgesellschaft Stuttgart
- DGN: S2k-Leitlinie Diagnose und Therapie der Multiplen Sklerose, Neuromyelitis-optica-Spektrum-Erkrankungen und MOG-IgG-assoziierten Erkrankungen (2021)
Abbildung
Created with Biorender











