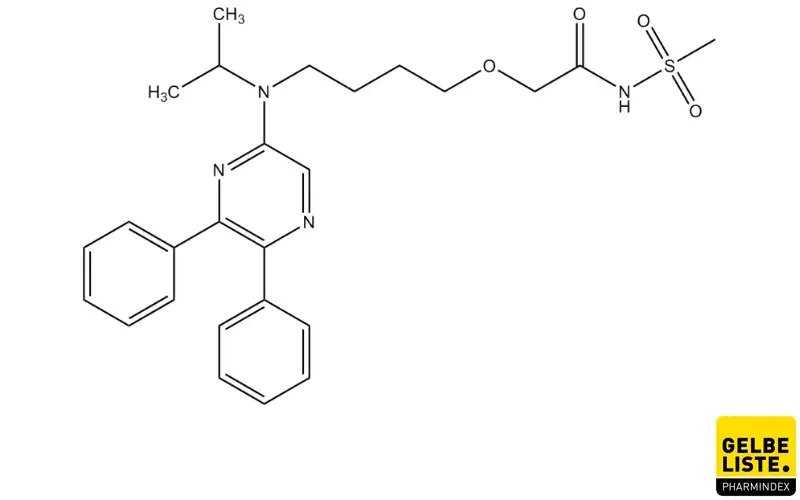
Selexipag
Selexipag ist der erste selektive, oral applizierbare Prostazyklin-Rezeptoragonist. Der Wirkstoff wirkt auf ähnliche Weise wie das natürliche Prostaglandin Prostazyklin. Die selektive Bindung des IP-Rezeptors auf der glatten Gefäßmuskulatur führt zur Vasodilatation der Pulmonalarterien. In Folge sinkt der pulmonale arterielle Druck und die Symptome werden gelindert. In vitro wirkt Selexipag zudem thrombozytenaggregationshemmend, antiinflammatorisch und antiproliferativ.
Wirkstoff Selexipag: Übersicht
Anwendung
- Langzeitbehandlung der pulmonal arteriellen Hypertonie (PAH)
- Die Wirksamkeit wurde bei PAH, einschließlich idiopathischer und erblicher PAH, PAH in Assoziation mit Bindegewebserkrankungen und PAH in Assoziation mit korrigierten einfachen angeborenen Herzfehlern nachgewiesen
Anwendungsform
- Selexipag ist in Form von Filmtabletten auf dem deutschen Markt verfügbar.
- Die Filmtabletten werden oral morgens und abends eingenommen. Um die Verträglichkeit zu verbessern, wird empfohlen, Selexipag zu den Mahlzeiten einzunehmen.
- Zudem sollte zu Beginn einer jeden Dosissteigerung während der Titrationsphase die erste gesteigerte Dosis abends eingenommen werden
Wirkmechanismus
- Selexipag ist ein selektiver Prostacyclin-Rezeptor (IP-Rezeptor)-Agonist, der sich von Prostacyclin und seinen Analoga unterscheidet. Selexipag wird durch die Carboxylesterase 1 (CES1) zum aktiven Metaboliten hydrolysiert, der etwa 37-fach wirksamer ist.
- Die Stimulation des IP-Rezeptors führt zur Vasodilatation sowie zur Hemmung der Zellproliferation und Fibrose.
- Selexipag verhindert im Rattenmodell der PAH ein kardiales und pulmonales Remodelling und führt zu einer proportionalen Abnahme des pulmonalen und peripheren Drucks. Dies spricht dafür, dass die periphere Vasodilatation die pulmonale pharmakodynamische Wirksamkeit widerspiegelt.
Pharmakokinetik
- Selexipag wird schnell resorbiert und durch CES1 in der Leber zu seinem aktiven Metaboliten hydrolysiert.
- Die maximalen Plasmakonzentrationen von Selexipag und seinem aktiven Metaboliten werden innerhalb von 1 bis 3 Stunden bzw. 3 bis 4 Stunden nach oraler Einnahme erreicht.
- Die absolute Bioverfügbarkeit von Selexipag bei Menschen liegt bei etwa 49 Prozent.
- Selexipag und sein aktiver Metabolit werden stark an Plasmaproteine gebunden (ca. 99 Prozent).
- Durch die enzymatische Hydrolysierung des Acyl-Sulfonamids durch CES1 wird der aktive Metabolit gebildet. Die oxidative Metabolisierung wird durch CYP3A4 und CYP2C8 katalysiert und resultiert in der Bildung von hydroxylierten und dealkylierten Substanzen.
- UGT1A3 und UGT2B7 sind bei der Glukuronisierung des aktiven Metaboliten involviert.
- Die mittlere terminale Halbwertszeit beträgt für Selexipag 0,8 bis 2,5 Stunden und für den aktiven Metaboliten 6,2 bis 13,5 Stunden.
- Bei gesunden Probanden war 5 Tage nach Einnahme die Elimination vollständig beendet und erfolgte primär über die Faeces.
Nebenwirkungen
Die am häufigsten berichteten unerwünschten Arzneimittelwirkungen waren:
- Kopfschmerzen
- Diarrhoe
- Übelkeit und Erbrechen
- Kieferschmerzen
- Myalgie
- Extremitätenschmerz
- Arthralgie
- Flush
Diese Nebenwirkungen traten häufiger während der Hochtitrierungsphase auf. Die Mehrheit dieser Nebenwirkungen war leichten bis mittleren Schweregrades.
Wechselwirkungen
- Inhibitoren oder Induktoren von CYP2C8, UGT1A3 und UGT2B7
- Inhibitoren von CYP2C8 (Gemfibrozil)
- Inhibitoren von UGT1A3 und UGT2B7 (Valproinsäure, Probenecid und Fluconazol)
- Induktoren von CYP2C8 (Rifampicin, Rifapentin)
- Induktoren von UGT1A3 und UGT2B7 (Rifampicin)
Potenzielle pharmakokinetische Interaktionen mit starken Inhibitoren oder Induktoren dieser Enzyme können nicht ausgeschlossen werden.
- Endothelin-Rezeptor-Antagonisten (ERA) und PDE-5-lnhibitoren ► Reduktion der Exposition des aktiven Metaboliten in einer Studie
Lopinavir, Ritonavir OATP- (OATP1B1 und OATP1B3) und P-gp-lnhibitoren ► Erhöhung der Selexipag-Exposition (da der pharmakologische Effekt von Selexipag jedoch hauptsächlich auf dessen aktiven Metaboliten beruht, wird dies als klinisch nicht relevant angesehen.
Kontraindikationen
- Überempfindlichkeit gegen den Wirkstoff
- Schwere koronare Herzerkrankung oder instabile Angina pectoris
- Myokardinfarkt innerhalb der letzten 6 Monate
- Dekompensierte Herzinsuffizienz, sofern nicht engmaschig überwacht
- Schwere Arrhythmien
- Zerebrovaskuläre Ereignisse (z.B. transiente ischämische Attacke, Schlaganfall) innerhalb der letzten 3 Monate
Angeborene oder erworbene Klappendefekte mit klinisch relevanten myokardialen Funktionsstörungen, die nicht mit einer pulmonalen Hypertonie in Verbindung stehen
Schwangerschaft/Stillzeit
- Es liegen keine Daten zum Einsatz von Selexipag bei Schwangeren vor. Es wird nicht empfohlen den Wirkstoff während der Schwangerschaft und bei Frauen im gebärfähigen Alter empfohlen, die keine Kontrazeption anwenden.
Stillzeit
- Es ist nicht bekannt, ob Selexipag oder seine Metaboliten in die Muttermilch übergehen. Ein Risiko für den gestillten Säugling kann nicht ausgeschlossen werden.
- Der Arzneistoff sollte während der Stillzeit nicht angewendet werden.
Anwendungshinweise
Arterielle Hypotonie
- Selexipag hat vasodilatierende Eigenschaften, die zu einer Blutdrucksenkung führen können.
Hyperthyreose
- Unter Selexipag wurde eine Hyperthyreose beobachtet. Schilddrüsenfunktionstests werden je nach klinischer Indikation empfohlen.
Pulmonale venookklusive Krankheit
- Bei Patienten mit venookklusiver Erkrankung wurde unter Therapie mit Vasodilatatoren (hauptsächlich Prostacycline) über Fälle von Lungenödemen berichtet.
- Daher sollte beim Auftreten von Symptomen eines Lungenödems die Möglichkeit einer pulmonalen venookklusiven Erkrankung in Betracht gezogen werden.
Antikoagulanzien oder Inhibitoren der Thrombozytenaggregation
- Selexipag ist in vitro ein Inhibitor der Thrombozytenaggregation. In der placebokontrollierten Phase-3-Studie mit PAH-Patienten ließ sich kein erhöhtes Blutungsrisiko im Vergleich mit Placebo feststellen.
- Das gilt auch, wenn Selexipag mit Antikoagulanzien (wie Heparin, Antikoagulanzien vom Cumarin-Typ) oder Inhibitoren der Thrombozytenaggregation verabreicht wurde.
Frauen im gebärfähigen Alter
- Frauen im gebärfähigen Alter sollten während der Einnahme eine wirksame Methode zur Empfängnisverhütung anwenden.
Wirkstoff-Informationen
Fachinformation Uptravi
-
Uptravi 1 000 Mikrogramm Filmtabletten
Janssen-Cilag GmbH Sps
-
Uptravi 1 200 Mikrogramm Filmtabletten
Janssen-Cilag GmbH Sps
-
Uptravi 1 400 Mikrogramm Filmtabletten
Janssen-Cilag GmbH Sps
-
Uptravi 1 600 Mikrogramm Filmtabletten
Janssen-Cilag GmbH Sps
-
Uptravi 200 Mikrogramm Filmtabletten
Janssen-Cilag GmbH
-
Uptravi 200 Mikrogramm Filmtabletten
Janssen-Cilag GmbH Sps
-
Uptravi 400 Mikrogramm Filmtabletten
Janssen-Cilag GmbH Sps
-
Uptravi 600 Mikrogramm Filmtabletten
Janssen-Cilag GmbH Sps
-
Uptravi 800 Mikrogramm Filmtabletten
Janssen-Cilag GmbH Sps











