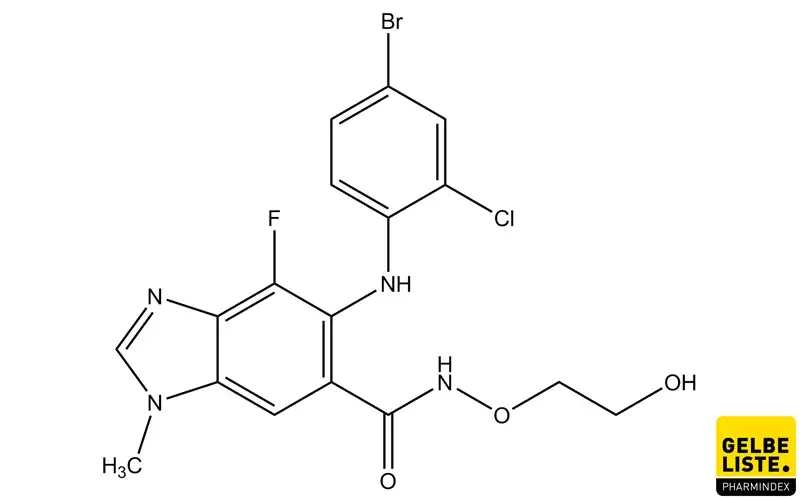
Selumetinib
Selumetinib ist ein selektiver Inhibitor der Mitogen-aktivierten Proteinkinase-Kinase 1 und 2 (MEK1/2), der somit die MEK-Aktivität und den RAF-MEK-ERK-Signalweg blockiert. Das Medikament wird angewendet zur Behandlung inoperabler plexiformer Neurofibromer bei Neurofibromatose Typ 1.
Selumetinib: Übersicht
Anwendung
Selumetinib ist ein selektiver Inhibitor der Mitogen-aktivierten Proteinkinase-Kinase 1 und 2 (MEK1/2), wodurch die Proliferation und das Überleben von Tumorzellen, bei denen der RAF-MEK-ERK-Signalweg aktiviert ist, gehemmt wird.
Das Arzneimittel ist bei Kindern ab 3 Jahren und Jugendlichen als Monotherapie zur symptomatischen Behandlung von inoperablen plexiformen Neurofibromen (PN) bei Neurofibromatose Typ 1 (NF1) indiziert.
Über Neurofibromatose Typ 1
Die Neurofibromatose Typ 1 (auch Von-Recklinghausen-Krankheit, Morbus Recklinghausen) ist eine genetische Erkrankung, bei der es zu multiplen Neurofibromen peripherer Nerven und zu Hautmissbildungen kommt. Bei 20 bis 50 % der Personen mit Neurofibromatose Typ 1 entwickeln sich plexiforme Neurofibrome, die erhebliche Komplikationen wie Schmerzen, Funktionseinschränkungen, Entstellungen und maligne Transformationen verursachen können. Die meisten plexiformen Neurofibrome werden in der frühen Kindheit diagnostiziert und wachsen in dieser Zeit am schnellsten. Eine vollständige chirurgische Resektion dieser Tumoren ist oft nicht möglich.
Anwendungsart
Selumetinib ist ist unter dem Namen Koselugo in Form von 10 mg- und 25 mg-Hartkapseln zum Einnehmen auf dem Markt. Es sollte auf nüchternen Magen eingenommen werden und 2 Stunden vor der Einnahme und 1 Stunde nach der Einnahme sollte keine Nahrungs- oder Flüssigkeitsaufnahme mit Ausnahme von Wasser erfolgen.
Die Kapseln dürfen nicht gekaut, aufgelöst oder geöffnet werden, da dies die Arzneimittelfreisetzung beeinträchtigen und die Absorption von Selumetinib beeinflussen könnte.
Wirkmechanismus
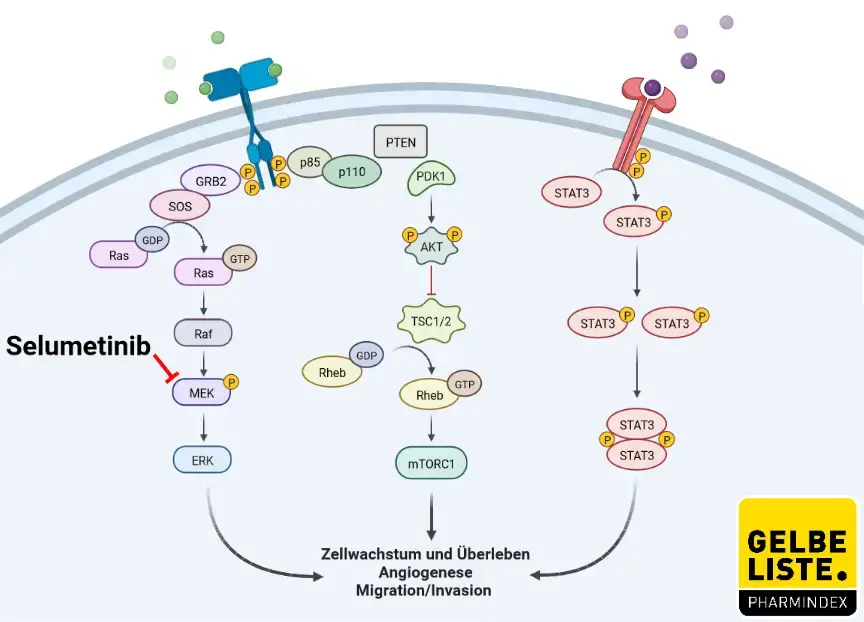
Selumetinib ist ein selektiver Inhibitor der Mitogen-aktivierten Proteinkinase-Kinase 1 und 2 (MEK1/2), der somit die MEK-Aktivität und den RAF-MEK-ERK-Signalweg (auch MAPK-Signalweg) blockiert. Eine MEK-Inhibition kann die Proliferation und das Überleben von Tumorzellen hemmen, bei denen der RAF-MEK-ERK-Signalweg aktiviert ist.
Dieser Signalweg wird durch eine große Anzahl von Wachstumsfaktoren wie bspw. EGF, IGF und TGF, meist über Rezeptor-Tyrosinkinasen, aktiviert. Ein charakteristisches Merkmal vieler Neoplasien ist eine unangemessene Aktivierung des MAPK-Signalwegs durch Mutationen in vorgelagerten Proteinen (EGFR, PIK3CA, RAS, RAF).
Das MEK-Protein ist in der Signalkaskade weiter unten angeordnet. Monotherapien mit MEK-Inhibitoren zeigen oft nur eine geringe klinische Aktivität (bei KRAS-Mutationen). Eine Erklärung hierfür ist, dass durch alternative (hochregulierte) Signalwege eine Kompensation der MEK-Inhibition möglich ist. Trotzdem gibt es auch Beispiele für erfolgreiche Monotherapien mit MEK-Inhibitoren (bei BRAF- oder NRAS-Mutationen).
Pharmakokinetik
Resorption
- Bei gesunden erwachsenen Probanden betrug die mittlere absolute orale Bioverfügbarkeit von Selumetinib 62%.
- Nach oraler Dosierung wird Selumetinib rasch resorbiert.
- Der Zeitpunkt der maximalen Plasmakonzentration im steady state (Tmax) wird 1 bis 1,5 Stunden nach der Dosierung erreicht.
Einfluss von Nahrungsmitteln
- In separaten klinischen Studien mit gesunden erwachsenen Probanden und erwachsenen Patienten mit fortgeschrittenen soliden Malignomen, die eine Dosis von 75 mg erhielten, führte eine gleichzeitige Gabe von Selumetinib und einer fettreichen Mahlzeit zu einer mittleren Verringerung der Cmax um jeweils 50% bzw. 62% im Vergleich zur Gabe im nüchternen Zustand.
- Die mittlere AUC von Selumetinib verringerte sich um jeweils 16% bzw. 19% und die Zeit bis zum Erreichen der Höchstkonzentration (Tmax) verlängerte sich um etwa 1,5 bis 3 Stunden.
- Bei gesunden erwachsenen Probanden führte die gleichzeitige Gabe von 50 mg Selumetinib und einer fettarmen Mahlzeit zu einer um 60% niedrigeren Cmax im Vergleich zur Gabe im nüchternen Zustand.
- Die AUC von Selumetinib verringerte sich um 38% und die Zeit bis zum Erreichen der Höchstkonzentration (Tmax) verlängerte sich um etwa 0,9 Stunden.
Verteilung
- Das mittlere apparente Verteilungsvolumen im steady state von Selumetinib im Bereich von 20 bis 30 mg/m2 lag bei Kindern und Jugendlichen zwischen 78 und 171 Litern, was auf eine mäßig starke Verteilung ins Gewebe schließen lässt.
- Die in-vitro-Plasmaproteinbindung beim Menschen beträgt 98,4%.
- Selumetinib bindet hauptsächlich an Serumalbumin (96,1 %) und in geringerem Maße an saures alpha-1-Glykoprotein (< 35%).
Biotransformation
- In vitro durchläuft Selumetinib in der ersten Phase der Biotransformation eine Oxidation der Seitenkette, N-Demethylierung und Verlust der Seitenkette mit Bildung von Amiden und sauren Metaboliten.
- CYP3A4 ist die hauptsächlich für den oxidativen Metabolismus von Selumetinib verantwortliche Isoform.
- CYP2C19, CYP2C9, CYP2E1 und CYP3A5 sind in geringerem Maße beteiligt.
- In-vitro-Studien weisen darauf hin, dass Selumetinib auch unmittelbare Stoffwechselreaktionen der Phase 2 durchläuft, wobei sich, hauptsächlich unter Beteiligung der Enzyme UGT1A1 and UGT1A3, Glucuronid-Konjugate bilden.
- Die Glucuronidierung ist ein wichtiger Eliminationsweg für Metabolite der Phase 1 von Selumetinib, an der mehrere UGT- Isoformen beteiligt sind.
- Nach oraler Dosierung von 14C-Selumetinib an gesunde männliche Probanden machte unverändertes Selumetinib (etwa 40% der Radioaktivität) zusammen mit anderen Metaboliten, einschließlich Glucuronid des Imidazoindazol-Metaboliten (M2, 22 %), Selumetinib-Glucuronid (M4, 7%), N-Desmethyl-Selumetinib (M8, 3%) und N-Desmethyl-Carboxylsäure (M11, 4%) den größten Teil der zirkulierenden Radioaktivität im menschlichen Plasma aus. N-Desmethyl-Selumetinib macht weniger als 10% der Selumetinib-Konzentration im menschlichen Plasma aus, ist jedoch etwa 3 bis 5 Mal so potent wie die Muttersubstanz und für etwa 21% bis 35% der pharmakologischen Gesamtaktivität verantwortlich.
Elimination
- Bei gesunden erwachsenen Probanden wurden nach einer oralen Einzeldosis von 75 mg radioaktiv markiertem Selumetinib nach 9-tägiger Probenahme 59% der Dosis im Fäzes (19% unverändert) und 33% der eingenommenen Dosis (< 1% als Muttersubstanz) im Urin wiedergefunden.
Dosierung
Die empfohlene Dosis Koselugo beträgt 25 mg/m2 Körperoberfläche (body surface area, BSA), zweimal täglich oral eingenommen (alle 12 Stunden). Die Dosierung wird auf den einzelnen Patienten basierend auf der BSA (mg/m2) individuell abgestimmt und auf die nächste erreichbare 5 mg- oder 10 mg-Dosis (bis zu einer maximalen Einzeldosis von 50 mg) gerundet. Es können unterschiedliche Stärken der Koselugo-Kapseln kombiniert werden, um die gewünschte Dosis zu erreichen. Diese können der Fachinformation entnommen werden.
Nebenwirkungen
Die häufigsten Nebenwirkungen bei der Anwendung von Selumetinib sind:
- Erbrechen (82%)
- Hautausschlag (80%)
- Erhöhung der Kreatinphosphokinase (CPK) im Blut (76%)
- Diarrhö (77%)
- Übelkeit (73%)
- asthenische Ereignisse (59%)
- trockene Haut (58%)
- Pyrexie (57%)
- akneähnlicher Ausschlag (54%)
- Hypoalbuminämie (50%)
- erhöhte Aspartataminotransferase (50%)
- Paronychie (45%)
Wechselwirkungen
Folgende Wechselwirkungen sind bei der Anwendung von Selumetinib zu beachten:
- CYP3A4- oder CYP2C19-Inhibitoren: Eine gleichzeitige Anwendung mit Arzneimitteln, die starke Inhibitoren von CYP3A4 (z. B. Clarithromycin, Grapefruitsaft, orales Ketoconazol) oder CYP2C19 (z. B. Ticlopidin) sind, sollte vermieden werden. Auch die gleichzeitige Anwendung von moderaten CYP3A4- (z.B. Erythromycin und Fluconazol) und CYP2C19-Inhibitoren (z. B. Omeprazol) sollte vermieden werden. Wenn die zeitgleiche Anwendung unvermeidbar ist, sollten die Patienten sorgfältig auf unerwünschte Ereignisse überwacht und die Selumetinib-Dosis reduziert werden.
- CYP3A4-Induktoren: Eine gleichzeitige Anwendung starker CYP3A4-Induktoren (z. B. Phenytoin, Rifampicin, Carbamazepin, Johanniskraut) oder moderater CYP3A4-Induktoren mit Koselugo sollte vermieden werden.
- OAT3-Substrate: n vitro ist Selumetinib ein Inhibitor von OAT3. Das Potenzial für einen klinisch relevanten Effekt auf die Pharmakokinetik von gleichzeitig angewendeten Substraten von OAT3 (z.B. Methotrexat und Furosemid) kann nicht ausgeschlossen werden.
- P-gp-Substrate: Koselugo enthält Vitamin E in Form des sonstigen Bestandteils Tocofersolan (TPGS). Dieses ist in vitro ein P-gp-Inhibitor, weshalb nicht ausgeschlossen werden kann, dass es zu klinisch relevanten Arzneimittelwechselwirkungen mit Substraten von P-gp (z. B. Digoxin oder Fexofenadin) kommen kann.
- Oraler Kontrazeptiva: Der Effekt von Selumetinib auf die Exposition oraler Kontrazeptiva wurde nicht untersucht. Daher sollte Frauen, die hormonelle Kontrazeptiva anwenden, die Anwendung einer zusätzlichen Barrieremethode empfohlen werden.
- Vitamin-E-Präparate: Patienten sollten auf die Einnahme ergänzender Vitamin-E-Präparate verzichten, da Koselugo-Kapseln Vitamin E in Form des sonstigen Bestandteils TPGS enthalten.
- Antikoagulanzien oder Thrombozytenaggregationshemmer: bei Patienten, die gleichzeitig Antikoagulanzien oder Thrombozytenaggregationshemmer einnehmen, sollte der Gerinnungsstatus häufiger untersucht werden.
Kontraindikationen
Selumetinib darf nicht angewendet werden bei Überempfindlichkeit gegen den Wirkstoff oder einen der genannten sonstigen Bestandteile des Arzneimittels, sowie bei schwerer Einschränkung der Leberfunktion.
Schwangerschaft
Es gibt keine Daten zur Anwendung von Selumetinib bei schwangeren Frauen. Tierexperimentelle Studien haben eine reproduktive Toxizität gezeigt, darunter embryofetalen Tod, strukturelle Defekte und reduziertes fetales Gewicht. Selumetinib wird während der Schwangerschaft und bei nicht verhütenden Frauen im gebärfähigen Alter nicht empfohlen. Wenn eine Patientin oder eine Partnerin eines männlichen Patienten, der Selumetinib erhält, schwanger wird, sollte sie auf das potentielle Risiko für den Foetus hingewiesen werden.
Stillzeit
Es ist nicht bekannt, ob Selumetinib oder seine Metaboliten in die menschliche Muttermilch übertreten. Selumetinib und sein aktiver Metabolit gehen in die Milch laktierender Mäuse über, weshalb ein Risiko für das gestillte Kind nicht ausgeschlossen werden kann. Aus diesem Grund sollte während der Behandlung mit Selumetinib nicht gestillt werden.
Verkehrstüchtigkeit
Selumetinib kann geringe Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen haben. Während der Behandlung mit Selumetinib wurde über Fatigue, Asthenie und Sehstörungen berichtet. Patienten, bei denen diese Symptome auftreten, sollten beim Führen von Fahrzeugen oder beim Bedienen von Maschinen vorsichtig sein.
Anwendungshinweise
Eingeschränkte Leberfunktion
Basierend auf klinischen Prüfungen wird bei Patienten mit einer leichten Einschränkung der Leberfunktion keine Dosisanpassung empfohlen. Bei Patienten mit einer mäßigen Einschränkung der Leberfunktion muss die Anfangsdosis von Koselugo auf 20 mg/m2 BSA zweimal täglich reduziert werden. Bei Patienten mit schwerer Einschränkung der Leberfunktion ist der Wirkstoff kontraindiziert.
Ethnische Abstammung
Eine erhöhte systemische Exposition wurde bei erwachsenen asiatischen Probanden beobachtet. Es gibt jedoch erhebliche Überlappungen mit westlichen Probanden nach Korrektur im Hinblick auf das Körpergewicht. Es werden keine spezifischen Anpassungen der Anfangsdosis bei asiatischen pädiatrischen Patienten empfohlen, jedoch sollten diese Patienten engmaschig auf unerwünschte Ereignisse überwacht werden.
- Neuro-Oncology Advances: The MEK inhibitor selumetinib reduces spinal neurofibroma burden in patients with NF1 and plexiform neurofibromas
- NEJM: Selumetinib in Children with Inoperable Plexiform Neurofibromas
- EMA: Fachinformation Koselugo
Abbildung
Adapted from „PI3K-Akt, RAS-MAPK, JAK-STAT Signaling”, by BioRender.com












