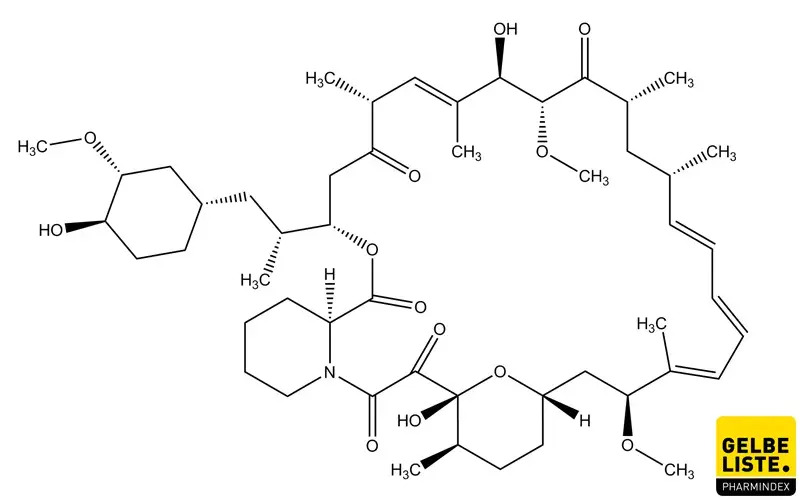
Sirolimus
Sirolimus (auch Rapamycin genannt) ist ein selektiver Inhibitor der Serin-/Threonin-Kinase mTOR (mechanistic Target of Rapamycin). Der oral verfügbare Wirkstoff wird zur Prophylaxe von Nierentransplantatabstoßungen und zur Behandlung von Lymphangioleiomyomatose (LAM) eingesetzt.
Sirolimus: Übersicht
Anwendung
Der mTOR-Inhibitor Sirolimus ist indiziert zur:
- Prophylaxe einer Nierentransplantatabstoßung bei erwachsenen Patienten mit einem geringen bis mittelgradigen immunologischen Risiko (dabei sollte Sirolimus initial in Kombination mit Ciclosporin Mikroemulsion und Kortikosteroiden für die Dauer von 2 bis 3 Monaten angewendet und anschließend nur dann zusammen mit Kortikosteroiden als Erhaltungstherapie fortgeführt werden, wenn Ciclosporin Mikroemulsion stufenweise abgesetzt werden kann).
- Behandlung von Patienten mit sporadischer Lymphangioleiomyomatose (LAM) mit mittelschwerer Lungenerkrankung oder abnehmender Lungenfunktion.
Anwendungsart
Sirolimus ist sowohl als überzogene Tablette in unterschiedlichen Dosierungen (0,5, 1, 2 mg) als auch als Lösung zum Einnehmen (1 mg/ml) erhältlich.Die Behandlung sollte von einem entsprechend qualifizierten Spezialisten eingeleitet werden und unter dessen Leitung verbleiben.
Wenn Patienten von der Lösung zum Einnehmen auf Tabletten oder umgekehrt umgestellt werden, sollte die gleiche Dosis eingenommen und der Sirolimus-Talspiegel 1 bis 2 Wochen später kontrolliert werden, um das Erreichen des empfohlenen Zielbereichs zu gewährleisten.
Da die Bioverfügbarkeit nicht für Tabletten untersucht wurde, die zerdrückt, gekaut oder geteilt wurden, kann dieses Vorgehen nicht empfohlen werden.
Es sollten außerdem nicht mehrere 0,5 mg Tabletten als Ersatz für die 1 mg Tablette oder anstelle anderer Stärken eingenommen werden, da die cmax-Werte unterschiedlich ausfallen können.
Wirkmechanismus
Sirolimus bzw. Rapamycin bindet an das zytoplasmatische Protein FKBP-12. Der daraus resultierende Sirolimus-FKBP-12-Komplex inhibiert die Aktivität des mTOR-Komplex-1 (mTORC1).
Der Komplex mTORC1, der unter anderem das eigentliche mTOR-Protein enthält, spielt eine wichtige Rolle im Hinblick auf Zellwachstum, -proliferation und -metabolismus. Die bekanntesten Targets des mTORC1 sind die Proteine S6K1 und 4EBP1, die jeweils eine bedeutende Funktion für die Translation haben. Die Aktivierung von mTORC1 durch beispielsweise Wachstumsfaktoren oder Aminosäuren führt zur:
- Phosphorylierung des Proteins S6K1 und dadurch zur Verstärkung der Translation.
- Phosphorylierung des Proteins 4EBP1, was dessen Dissoziation von eIF4E induziert und dadurch die Cap-abhängige Translation initiiert (hypophosphoryliertes 4EBP1 bindet und inhibiert eIF4E).
Eine Hemmung von mTORC1 durch Sirolimus beeinflusst infolgedessen die Translation und Synthese von Proteinen, die an der Regulation des Zellzyklus beteiligt sind.
Sirolimus inhibiert darüber hinaus eine durch die meisten Stimuli ausgelöste T-Zell-Aktivierung, indem es die calciumabhängige und die calciumunabhängige intrazelluläre Signaltransduktion blockiert, was letztendlich den immunsuppressiven Effekt begründet.
Bei der sporadischen Lymphangioleiomyomatose (LAM) kommt es zu einer überschießenden Wucherung krankhaft veränderter glatter Muskelzellen im Lungengewebe (LAM-Zellen). Verantwortlich sind somatische Mutationen im TSC2-Gen für Tuberöse Sklerose, (TSC, Tuberous Sclerosis Complex) Durch den Funktionsverlust des TSC-Gens wird die mTOR-Signalkaskade aktiviert, mit nachfolgender Zellproliferation und Freisetzung von Wachstumsfaktoren. Sirolimus hemmt als mTOR-Inhibitor die aktivierte mTOR-Signalkaskade und somit die Proliferation von LAM-Zellen.
Pharmakokinetik
Die folgenden pharmakokinetischen Daten basieren auf der Darreichungsform Lösung zum Einnehmen (außer die Darreichungsform Tablette wird explizit erwähnt).
Resorption
- Sirolimus wird schnell resorbiert.
- Maximale Plasmakonzentrationen (cmax) werden bei gesunden Probanden nach etwa 1 Stunde (tmax) erreicht (Einzeldosis).
- Die systemische Verfügbarkeit in Kombination mit Ciclosporin beträgt etwa 14%.
- Bei gesunden Probanden liegt die mittlere Bioverfügbarkeit von Sirolimus nach Anwendung einer Tablette ungefähr 27% höher als bei der Lösung zum Einnehmen (der mittlere cmax-Wert war um 35% erniedrigt und der mittlere tmax-Wert um 82% erhöht).
- Eine wiederholte Anwendung erhöht die mittlere Sirolimus-Konzentration etwa um das 3-fache.
- Bei gesunden Probanden, die Tabletten mit einer fettreichen Mahlzeit erhielten, war ein Anstieg der cmax-, tmax- und AUC-Werte von 65%, 32% bzw. 23% zu beobachten (um die Variabilität zu minimieren, sollten Tabletten durchgängig entweder mit oder ohne Nahrung eingenommen werden).
Verteilung
- Das Blut-Plasma-Verhältnis (B/P) von 36 zeigt, dass Sirolimus stark in feste Blutbestandteile übergeht.
Metabolismus (Biotransformation)
- Sirolimus ist (wie Everolimus) ein Substrat von CYP3A4 (CYP-Interaktionen) und P-gp.
- Sirolimus wird in beträchtlichem Ausmaß über O-Demethylierung und/oder Hydroxylierung metabolisiert.
- Es wurden sieben Hauptmetaboliten, einschließlich Hydroxyl-, Demethyl- und Hydroxydemethyl-Sirolimus, im Vollblut identifiziert.
- Sirolimus ist der Hauptbestandteil im menschlichen Vollblut und für mehr als 90% der immunsuppressiven Aktivität verantwortlich.
Elimination
- Sirolimus wird größtenteils über die Fäzes (> 90%) und nur zu kleinen Teilen über die Niere ausgeschieden.
- Für stabile nierentransplantierte Patienten betrug die terminale Halbwertszeit nach mehrfacher oraler Anwendung 62 16 Stunden (die effektive Halbwertszeit ist kürzer).
Pharmakokinetik bei Patienten mit Leberfunktionsstörung
- Bei Patienten mit leichter oder mittelgradiger Leberfunktionsstörung (Child-Pugh-Klasse A oder B) waren die Mittelwerte für die AUC und Halbwertszeit von Sirolimus im Vergleich zu normalen, gesunden Probanden um 61% bzw. um 43% erhöht und die CL/F um 33% erniedrigt.
- Bei Patienten mit schwerer Leberfunktionsstörung (Child-Pugh-Klasse C) waren die Mittelwerte für die AUC und Halbwertszeit von Sirolimus im Vergleich zu normalen, gesunden Probanden um 210% bzw. um 170% erhöht und die CL/F um 67% erniedrigt.
- Die bei Patienten mit Leberfunktionsstörungen beobachteten längeren Halbwertszeiten verzögern das Erreichen des Steady State.
Dosierung
Prophylaxe der Organabstoßung
Initialtherapie (für 2 bis 3 Monate nach Transplantation):
- 6 mg initiale Einzeldosis sobald wie möglich nach der Transplantation.
- 2 mg 1x täglich bis die Ergebnisse des therapeutischen Drug Monitorings (TDM) vorliegen.
- Mit Hilfe der TDM Ergebnisse sollte eine individuelle Dosisanpassung vorgenommen werden, um Vollblut-Talspiegel von 4 bis 12 ng/ml zu erhalten (chromatographischer Nachweis).
- Die Behandlung mit Sirolimus sollte durch eine langsam ausschleichende Begleitbehandlung mit Kortikosteroiden und Ciclosporin Mikroemulsion optimiert werden.
- Der empfohlene Bereich für die Ciclosporin-Talspiegelkonzentration in den ersten 2 bis 3 Monaten nach der Transplantation liegt bei 150 bis 400 ng/ml.
- Um Schwankungen zu minimieren, sollte Sirolimus bezogen auf Ciclosporin immer zur gleichen Zeit, und zwar 4 Stunden nach der Ciclosporin-Gabe, sowie durchgängig entweder mit oder ohne gleichzeitige Nahrungsaufnahme eingenommen werden.
Erhaltungstherapie:
- Ciclosporin sollte über 4 bis 8 Wochen stufenweise abgesetzt werden.
- Die Vollblut-Talspiegel von Sirolimus sollten 12 bis 20 ng/ml erreichen.
- Sirolimus sollte zusammen mit Kortikosteroiden angewendet werden.
- Bei Patienten, bei denen das Absetzen von Ciclosporin misslungen ist oder nicht versucht werden kann, darf die Kombination von Ciclosporin und Sirolimus nicht länger als 3 Monate nach der Transplantation gegeben werden (sofern klinisch angemessen, sollte Sirolimus in diesem Fall abgesetzt und ein anderes immunsuppressives Behandlungsschema gewählt werden).
TDM und Dosisanpassung:
Bei folgenden Patientenpopulationen sollten die Sirolimus-Vollblutspiegel engmaschig überwacht werden:
- Patienten mit Leberfunktionsstörungen
- Patienten, die gleichzeitig CYP3A4-Induktoren oder -Inhibitoren einnehmen sowie nach deren Absetzen.
- Patienten, bei denen Ciclosporin deutlich dosisreduziert oder abgesetzt wurde.
Das TDM sollte allerdings nicht die alleinige Grundlage für eine Anpassung der Sirolimus-Therapie sein. Klinische Anzeichen bzw. Symptome, Gewebebiopsien und Laborparameter sollten ebenfalls sorgfältig berücksichtigt werden.
Patienten mit sporadischer Lymphangioleiomyomatose (S-LAM)
Initialtherapie:
- Die Initialdosis beträgt 2 mg pro Tag.
- Eine Messung der Vollblut-Talspiegel von Sirolimus sollte nach 10 bis 20 Tagen erfolgen.
- Der Zielbereich der Sirolimus-Konzentration liegt zwischen 5 und 15 ng/ml (eventuell Dosisanpassung).
Erhaltungstherapie:
- Bei den meisten Patienten können Dosisanpassungen auf der Grundlage eines einfachen Dosisverhältnisses erfolgen: Neue Sirolimus-Dosis = derzeitige Dosis x (Zielkonzentration/derzeitige Konzentration).
- Häufige Anpassungen der Dosis aufgrund von Nicht-Steady-State-Konzentrationen von Sirolimus können zu Über- oder Unterdosierung führen, da Sirolimus eine lange Halbwertszeit hat.
- Nachdem die Erhaltungsdosis für Sirolimus eingestellt wurde, sollte die neue Dosis für die Erhaltungstherapie mindestens 7 bis 14 Tage lang fortgesetzt werden, vor einer weiteren Dosisanpassung unter Konzentrationsüberwachung.
- Sobald eine stabile Dosis erreicht ist, sollte mindestens alle 3 Monate ein TDM erfolgen.
Nebenwirkungen
Zu den häufigsten Nebenwirkungen unter der Therapie mit Sirolimus zählen:
- Blutbildveränderungen (Thrombozytopenie, Anämie, Leukopenie)
- Elektrolytverluste (Hypokaliämie, Hypophosphatämie)
- Fieber
- Hypertonie
- Stoffwechselstörungen (Hyperglykämie, Hyperlipidämie)
- Harnwegsinfektionen
- Periphere Ödeme
- Gastrointestinale Beschwerden (Bauchschmerzen, Diarrhö, Obstipation, Übelkeit)
Aufgrund des immunsuppressiven Effektes von Sirolimus kann es neben Wundheilungsstörungen auch zu schwerwiegenden opportunistischen Infektionen (bakteriell, mykotisch, viral und durch Protozoen) sowie zur Sepsis kommen. Zusätzlich erhöht die Immunsuppression die Anfälligkeit, Lymphome oder andere bösartige Neubildungen, vor allem der Haut, zu entwickeln.
Die Häufigkeit von Nebenwirkungen kann mit ansteigendem Sirolimus-Talspiegel zunehmen.
Wechselwirkungen
Sirolimus wird in beträchtlichem Umfang durch das CYP3A4-Isoenzym in der Darmwand und der Leber metabolisiert und ist darüber hinaus ein Substrat für die im Dünndarm lokalisierte Multisubstanz-Efflux-Pumpe P-Glykoprotein (P-gp). Deshalb kann die Pharmakokinetik von Sirolimus durch Substanzen beeinflusst werden, die auf diese Proteine einwirken. Prinzipiell wird aus diesem Grund die gleichzeitige Anwendung starker CYP3A4-/ -Inhibitoren wie Ketoconazol, Itraconazol, Clarithromycin oder Ritonavir nicht empfohlen. Gleiches gilt für starke CYP3A4-Induktoren wie Rifampicin.
- CYP3A4-Inhibitoren und/oder P-gp-Inhibitoren: Verringerung des Sirolimus-Metabolismus und dadurch Erhöhung der Sirolimus-Spiegel (Ketoconazol erhöht die cmax-, tmax- und AUC-Werte von Sirolimus auf das 4,4-fache, 1,4-fache bzw. 10,9-fache).
- CYP3A4-Induktoren Verstärkung des Sirolimus-Metabolismus und dadurch Senkung der Sirolimus-Spiegel (Rifampicin vermindert die AUC und cmax von Sirolimus um etwa 82% bzw. 71%).
Kontraindikationen
Sirolimus ist kontraindiziert bei Überempfindlichkeit gegen den Wirkstoff oder sonstige Bestandteile des Arzneimittels.
Schwangerschaft
Es liegen keine ausreichenden Daten für die Verwendung von Sirolimus bei Schwangeren vor. Tierexperimentelle Studien haben eine Reproduktionstoxizität gezeigt. Das potenzielle Risiko für den Menschen ist nicht bekannt.
Sirolimus darf während der Schwangerschaft nicht angewendet werden, es sei denn, dies ist eindeutig erforderlich.
Während der Therapie sowie für 12 Wochen nach der Behandlung muss eine zuverlässige Verhütungsmethode angewendet werden.
Stillzeit
Es ist nicht bekannt, ob Sirolimus beim Menschen in die Muttermilch übergeht. Im Tierexperiment ging Sirolimus in die Milch laktierender Ratten über. Aufgrund des möglichen Auftretens von Nebenwirkungen durch Sirolimus bei gestillten Kindern sollte das Stillen während der Behandlung mit Sirolimus unterbrochen werden.
Verkehrstüchtigkeit
Sirolimus hat keinen bekannten Einfluss auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen (es wurden keine Studien zu den Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen durchgeführt).
Anwendungshinweise
Allgemein
- Bei nierentransplantierten Patienten mit einem hohen immunologischen Risiko wurde Sirolimus nicht ausreichend untersucht, weshalb die Anwendung in dieser Patientengruppe nicht empfohlen wird.
- Bei nierentransplantierten Patienten mit verzögerter Transplantatfunktion kann Sirolimus die Wiederaufnahme der Nierenfunktion verzögern.
Gleichzeitige Anwendung mit anderen Arzneimitteln
- Sirolimus wurde bisher in klinischen Studien zusammen mit folgenden Arzneimitteln angewendet: Tacrolimus, Ciclosporin, Azathioprin, Mycophenolatmofetil, Kortikosteroiden und zytotoxischen Antikörpern (Sirolimus wurde nicht ausführlich in Kombination mit anderen immunsuppressiven Substanzen untersucht).
- Bei gleichzeitiger Anwendung von Sirolimus und Ciclosporin muss die Nierenfunktion überwacht werden (Vorsicht ist geboten bei der gleichzeitigen Anwendung von anderen Substanzen, die bekanntermaßen eine schädigende Wirkung auf die Nierenfunktion haben).
- Die gleichzeitige Gabe von Sirolimus mit einem Calcineurin-Inhibitor kann das Risiko für Calcineurin-Inhibitor-induziertes hämolytisch-urämisches Syndrom/ thrombotisch-thrombozytopenische Purpura/ thrombotische Mikroangiopathie (HUS/ TTP/ TMA) erhöhen.
HMG-CoA-Reduktase-Hemmer (Statine)/Fibrate:
- In klinischen Studien zeigte die gleichzeitige Anwendung von Sirolimus mit HMG-CoA-Reduktase-Hemmern und/oder Fibraten eine gute Verträglichkeit.
- Während der Sirolimus-Behandlung mit oder ohne Ciclosporin A sollten Patienten auf erhöhte Lipidwerte kontrolliert werden.
- Patienten, die einen HMG-CoA-Reduktase-Inhibitor und/oder ein Fibrat erhalten, sollten bezüglich der möglichen Entwicklung einer Rhabdomyolyse und anderer Nebenwirkungen (siehe Fachinformation des entsprechenden Wirkstoffs) überwacht werden.
- Die gleichzeitige Anwendung von Sirolimus und ACE-Hemmern kann zu angioneurotischen Ödemen führen.
- Außerdem wurden unter der gleichzeitigen Anwendung bei nierentransplantierten Patienten erhöhte biopsiegesicherte, akute Abstoßungsraten (BCAR) beobachtet.
- Erhöhte Sirolimus-Spiegel, zum Beispiel aufgrund einer Wechselwirkung mit starken CYP3A4-Inhibitoren (mit/ohne begleitende Gabe von ACE-Hemmern), können ebenfalls verstärkt zu einem Angioödem führen.
- Patienten, die Sirolimus erhalten, sollten engmaschig überwacht werden, falls sie gleichzeitig ACE-Hemmer einnehmen.
Impfungen:
- Immunsuppressiva können die Impfantwort beeinflussen, sodass während einer Behandlung mit Sirolimus eine Impfung weniger wirksam sein kann.
- Der Gebrauch von Lebendimpfstoffen sollte während einer Behandlung mit Sirolimus vermieden werden.
Maligne Erkrankungen
- Aufgrund der Immunsuppression besteht eine erhöhte Infektanfälligkeit sowie die Möglichkeit, Lymphome oder andere bösartige Neubildungen, vor allem der Haut, zu entwickeln.
- Wie bei Patienten mit einem erhöhten Risiko für Hautkrebs üblich, sollte die Exposition gegenüber Sonnenlicht und ultravioletter (UV-) Strahlung durch das Tragen schützender Kleidung und das Benutzen von Sonnencreme mit hohem Lichtschutzfaktor begrenzt werden.
Infektionen
- Eine übermäßige Suppression des Immunsystems kann ebenfalls die Anfälligkeit für Infektionen, einschließlich opportunistischer Infektionen (bakterielle, fungale, virale und Protozoen-Infektionen), tödliche Infektionen und Sepsis erhöhen.
- Zu diesen Erkrankungen bei nierentransplantierten Patienten zählen die BK-Virus-Nephropathie und die JC-Virus-assoziierte, progressive multifokale Leukenzephalopathie (PML).
- Diese Infektionen gehen oft mit einer hohen immunsuppressiven Gesamtbelastung einher und können schwere oder letale Verläufe annehmen, welche die Ärzte bei der Differenzialdiagnostik von immunsupprimierten Patienten mit sich verschlechternder Nierenfunktion oder neurologischen Symptomen berücksichtigen sollten.
- Fälle einer heißt heute Pneumocystis-jirovecii-Pneumonie sind bei nierentransplantierten Patienten, die keine antimikrobielle Prophylaxe erhielten, beobachtet worden (deshalb sollte während der ersten 12 Monate nach Transplantation eine antimikrobielle Prophylaxe gegen Pneumocystis-jirovecii-Pneumonie angewendet werden).
- Es wird außerdem eine Zytomegalievirus (CMV)-Prophylaxe über einen Zeitraum von 3 Monaten nach einer Nierentransplantation empfohlen, insbesondere für Patienten mit erhöhtem Risiko für eine CMV-Erkrankung.
Leberfunktionsstörung
- Bei Patienten mit eingeschränkter Leberfunktion wird eine engmaschige Überwachung der Sirolimus-Talspiegel im Vollblut empfohlen.
- Bei Patienten mit schwerer Leberfunktionsstörung wird eine Reduzierung der Erhaltungsdosis um die Hälfte aufgrund einer verminderten Clearance empfohlen.
- Da die Halbwertszeit bei diesen Patienten verlängert ist, sollte ein TDM nach einer Initialdosis oder einer Änderung der Dosis über einen verlängerten Zeitraum erfolgen, bis stabile Konzentrationen erreicht werden.
Alkohol
- Die Darreichungsform Lösung zum Einnehmen enthält bis zu 3,17 Vol.-% Ethanol (Alkohol).
- Eine Initialdosis von 6 mg enthält bis zu 150 mg Alkohol, entsprechend 3,80 ml Bier oder 1,58 ml Wein.
- Ein gesundheitliches Risiko besteht u. a. bei Leberkranken, Alkoholkranken, Epileptikern, Patienten mit organischen Erkrankungen des Gehirns, Schwangeren, Stillenden und Kindern.
Alternativen
Als alternative Immunsuppressiva kommen nach Nierentransplantation folgende Wirkstoffe in Frage:
- Calcineurin-Inhibitoren wie Ciclosporin und Tacrolimus
- Andere mTOR-Inhibitoren wie Everolimus
- Kortikosteroide
- Mycophenolsäure
- Azathioprin
- Belatacept (Fusionsprotein aus der extrazellulären Domäne des humanen Cytotoxic T-Lymphocyte-associated Protein CTLA-4 und einem Teil der Fc-Domäne eines humanen IgG1-Antikörpers)
- Basiliximab (Anti-IL-2-Rezeptor-Antikörper)
Weitere Informationen sind der jeweiligen Fachinformation zu entnehmen.
Wirkstoff-Informationen
- EMA: Rapamune
- Freissmuth et al., Pharmakologie und Toxikologie, 2020, Springer
- Mutschler et al., Mutschler Arzneimittelwirkungen, 2019, Wissenschaftliche Verlagsgesellschaft Stuttgart
- Kathryn G. Foster, Diane C. Fingar, Mammalian Target of Rapamycin (mTOR): Conducting the Cellular Signaling Symphony*, Journal of Biological Chemistry,Volume 285, Issue 19, 2010 https://www.sciencedirect.com/science/article/pii/S0021925820548515?via%3Dihub#fig2
-
Hyftor 2 mg/g Gel
Plusultra Pharma GmbH
-
Rapamune 0,5 mg Abacus überzogene Tabletten
Abacus Medicine A/S
-
Rapamune 0,5 mg Allomedic überzogene Tabletten
Allomedic GmbH
-
Rapamune 0,5 mg axicorp überzogene Tabletten
axicorp Pharma B.V.
-
Rapamune 0,5 mg Emra überzogene Tabletten
Emra-Med Arzneimittel GmbH
-
Rapamune 0,5 mg kohlpharma überzogene Tabletten
kohlpharma GmbH
-
Rapamune 0,5 mg Orifarm überzogene Tabletten
Orifarm GmbH
-
Rapamune 0,5 mg Originalis überzogene Tabletten
Originalis B.V.
-
Rapamune 0,5 mg Paranova überzogene Tabletten
Paranova Pack A/S
-
Rapamune® 0,5 mg überzogene Tabletten
Pfizer Pharma GmbH
-
Rapamune 1 mg 2care4 überzogene Tabletten
2care4 ApS
-
Rapamune 1 mg Abacus überzogene Tabletten
Abacus Medicine A/S
-
Rapamune 1 mg Adequapharm überzogene Tabletten
Adequapharm GmbH
-
Rapamune 1 mg Allomedic überzogene Tabletten
Allomedic GmbH
-
Rapamune 1 mg axicorp überzogene Tabletten
axicorp Pharma B.V.
-
Rapamune 1 mg BB Farma überzogene Tabletten
BB Farma S.R.L.
-
Rapamune 1 mg Beragena überzogene Tabletten
Docpharm GmbH
-
Rapamune 1 mg CC-Pharma überzogene Tabletten
CC Pharma GmbH
-
Rapamune 1 mg Emra überzogene Tabletten
Emra-Med Arzneimittel GmbH
-
Rapamune 1 mg Eurim überzogene Tabletten
Eurim-Pharm Arzneimittel GmbH
-
Rapamune 1 mg kohlpharma überzogene Tabletten
kohlpharma GmbH
-
Rapamune 1 mg/ml Abacus Lösung zum Einnehmen
Abacus Medicine A/S
-
Rapamune 1 mg/ml axicorp Lösung zum Einnehmen
axicorp Pharma B.V.
-
Rapamune 1 mg/ml Emra Lösung zum Einnehmen
Emra-Med Arzneimittel GmbH
-
Rapamune 1 mg/ml Eurim Lösung zum Einnehmen
Eurim-Pharm Arzneimittel GmbH
-
Rapamune 1 mg/ml kohlpharma Lösung zum Einnehmen
kohlpharma GmbH
-
Rapamune® 1 mg/ml Lösung zum Einnehmen
Pfizer Pharma GmbH
-
Rapamune 1 mg/ml Orifarm Lösung zum Einnehmen
Orifarm GmbH
-
Rapamune 1 mg Orifarm überzogene Tabletten
Orifarm GmbH
-
Rapamune 1 mg Originalis überzogene Tabletten
Originalis B.V.
-
Rapamune 1 mg Paranova überzogene Tabletten
Paranova Pack A/S
-
Rapamune® 1 mg überzogene Tabletten
Pfizer Pharma GmbH
-
Rapamune 2 mg Abacus überzogene Tabletten
Abacus Medicine A/S
-
Rapamune 2 mg Allomedic überzogene Tabletten
Allomedic GmbH
-
Rapamune 2 mg axicorp überzogene Tabletten
axicorp Pharma B.V.
-
Rapamune 2 mg BB Farma überzogene Tabletten
BB Farma S.R.L.
-
Rapamune 2 mg CC-Pharma überzogene Tabletten
CC Pharma GmbH
-
Rapamune 2 mg Emra überzogene Tabletten
Emra-Med Arzneimittel GmbH
-
Rapamune 2 mg Eurim überzogene Tabletten
Eurim-Pharm Arzneimittel GmbH
-
Rapamune 2 mg kohlpharma überzogene Tabletten
kohlpharma GmbH
-
Rapamune 2 mg Orifarm überzogene Tabletten
Orifarm GmbH
-
Rapamune 2 mg Originalis überzogene Tabletten
Originalis B.V.
-
Rapamune 2 mg Paranova überzogene Tabletten
Paranova Pack A/S
-
Rapamune® 2 mg überzogene Tabletten
Pfizer Pharma GmbH













