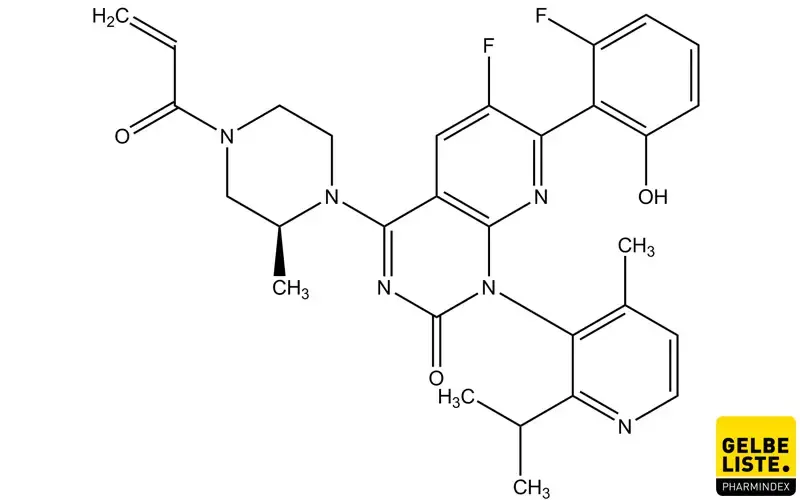
Sotorasib
Sotorasib ist der erste Wirkstoff, der zur Behandlung von fortgeschrittenem nicht-kleinzelligen Lungenkarzinom (NSCLC) mit KRAS G12C-Mutation zugelassen wurde. Es handelt sich um einen niedermolekularen, irreversiblen Inhibitor des KRAS G12C-mutierten Proteins.
Sotorasib: Übersicht
Anwendung
Sotorasib (Lumykras) ist ein selektiver Inhibitor des Proteins KRAS (Kirsten rat sarcoma viral oncogene homolog) mit einer G12C-Mutation. Das Arzneimittel ist als Monotherapie indiziert für die Behandlung von Erwachsenen mit fortgeschrittenem nicht-kleinzelligen Lungenkarzinom (NSCLC, non-small cell lung cancer) mit KRASG12C-Mutation, bei denen es nach mindestens einer vorherigen systemischen Therapie zu einer Progression kam.
Anwendungsart
Sotorasib ist für die orale Anwendung vorgesehen und kann zu einer Mahlzeit oder unabhängig von den Mahlzeiten eingenommen werden.
Wirkmechanismus
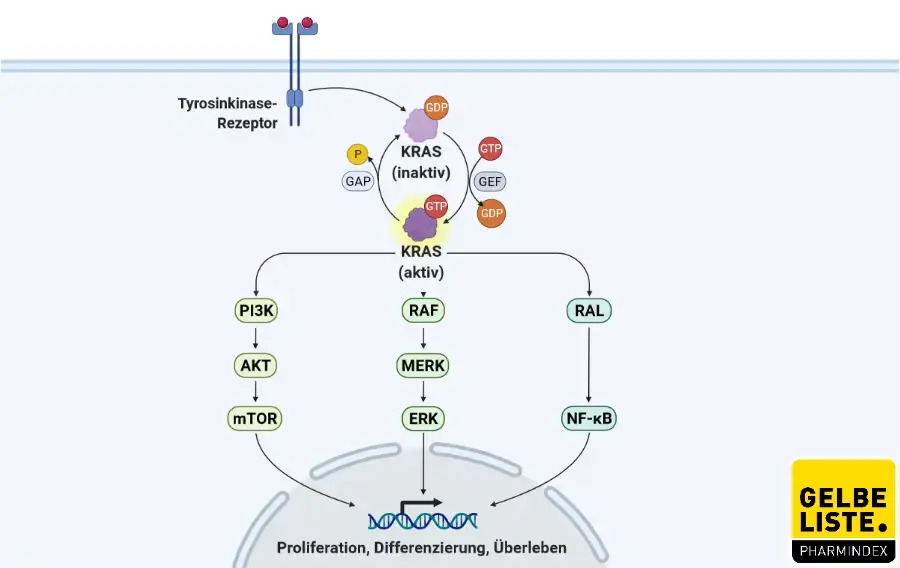
Sotorasib ist ein selektiver KRASG12C (Kirsten rat sarcoma viral oncogene homolog)-Inhibitor, der kovalent und irreversibel an das charakteristische Cystein von KRASG12C bindet. Die GTPase KRAS ist Teil des RAS/MAPK-Signalwegs. Diese Signale weisen die Zelle an, zu wachsen und sich zu teilen (proliferieren) oder zu reifen und spezialisierte Funktionen zu übernehmen (differenzieren). Bei Mutation kommt es zu einem Kontrollverlust des Proteins und somit zu unkontrolliertem Wachstum.
Die Inaktivierung von KRASG12C durch Sotorasib blockiert die Signalübertragung und das Überleben der Tumorzellen, hemmt das Zellwachstum und fördert selektiv die Apoptose bei Tumoren, die die KRASG12C-Mutation besitzen.
Dosierung
Die empfohlene Dosis beträgt einmal täglich zur gleichen Tageszeit 960 mg Sotorasib (8 Tabletten mit 120 mg).
Nebenwirkungen
Die am häufigsten berichteten Nebenwirkungen der Zulassungsstudie waren:
- Diarrhö (34%)
- Übelkeit (25%)
- Fatigue (21%)
Die häufigsten schweren (Grad ≥ 3) Nebenwirkungen waren erhöhte ALT (5%), erhöhte AST (4%) und Diarrhö (4%). Die häufigsten Nebenwirkungen, die zu einem dauerhaften Abbruch der Behandlung führten, waren erhöhte ALT (1%), erhöhte AST (1%) und arzneimittelbedingter Leberschaden (drug-induced liver injury, DILI) (1%).
Wechselwirkungen
Für Sotorasib sind mit folgenden Verbindungen Wechselwirkungen möglich:
- Säurereduzierende Wirkstoffe (PPI, H2-Rez.-Antagonisten): Verringerung der Sotorasib-Konzentration
- Inhibitoren von CYP3A4 und P-gp: Erhöhung der Sotorasib-Exposition
- Starke CYP3A4-Induktoren: Reduktion der der Sotorasib-Exposition
- CYP3A4-Substrate: Verringerung der Plasmakonzentrationen dieser Substrate
- CYP2D6- und BCRP-Substrate Substrate: Geeignete Überwachung wird empfohlen, da Sotorasib möglicherweise CYP2D6 und BCRP hemmen kann.
- P-gp-Substrate: Erhöhung der Exposition des P-gp-Substrats
Kontraindikationen
Sotorasib darf nicht angewendet werden bei Überempfindlichkeit gegen den Wirkstoff oder einen der sonstigen Bestandteile des Arzneimittels.
Schwangerschaft
Sotorasib sollte während der Schwangerschaft und bei Frauen im gebärfähigen Alter, die nicht verhüten, nicht angewendet werden, da tierexperimentelle Studien eine Reproduktionstoxizität gezeigt haben.
Stillzeit
Es ist nicht bekannt, ob Sotorasib oder seine Metaboliten in die Muttermilch übergehen. Da ein Risiko für gestillte Neugeborene/Säuglinge nicht ausgeschlossen werden kann, solte Sotorasib während der Stillzeit nicht angewendet werden.
Verkehrstüchtigkeit
Sotorasib hat keinen oder einen zu vernachlässigenden Einfluss auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen.
Anwendungshinweise
Hepatotoxizität
Unter der Anwendung von Sotorasib wurden Fälle von Hepatotoxizität beobachtet , die zu einem Leberschaden und zu Hepatitis führen kann. Darüber hhinaus wurde der Wirkstoff mit vorübergehenden Erhöhungen der Serum-Transaminasen (ALT und AST) in Verbindung gebracht. Dosisanpassung oder dauerhafter Abbruch der Behandlung verbessert diese Erhöhungen. Bei 38% der Patienten in klinischen Studien, bei denen eine Hepatotoxizität auftrat, führte die Hepatotoxizität zu einer Dosisunterbrechung oder Dosisreduktion. Insgesamt erhielten 26% der Patienten mit Hepatotoxizität gleichzeitig Kortikosteroide. Es wird empfohlen Patienten vor Beginn der Behandlung, alle 3 Wochen in den ersten 3 Behandlungsmonaten und anschließend einmal monatlich oder je nach klinischer Indikation hinsichtlich ihrer Leberfunktion (ALT, AST und Gesamtbilirubin) zu überwachen. Bei Patienten, die eine Erhöhung der Transaminasen und/oder des Bilirubins entwickeln werden häufigere Tests angeraten.
CAVE: Erhöhungen der Leberenzyme können asymptomatisch verlaufen.
Interstitielle Lungenerkrankung (ILD)/Pneumonitis
Bei Patienten, die in klinischen Studien Sotorasib und zuvor eine Immun- oder Strahlentherapie erhalten hatten, kam es zu Fällen von ILD/Pneumonitis. Patienten sind deshalb auf neue oder sich verschlechternde Symptome, die auf eine ILD/Pneumonitis hinweisen (z. B. Dyspnoe, Husten, Fieber) zu überwachen.
Wirkstoff-Informationen
- NUB Antrag 2021/2022 Sotorasib
- EMA. Fachinformation Lumykras
- HONG, David S., et al. KRASG12C inhibition with sotorasib in advanced solid tumors. New England Journal of Medicine, 2020, 383. Jg., Nr. 13, S. 1207-1217
Abbildung
Adapted from „KRAS Signaling Pathways”, by BioRender.com












