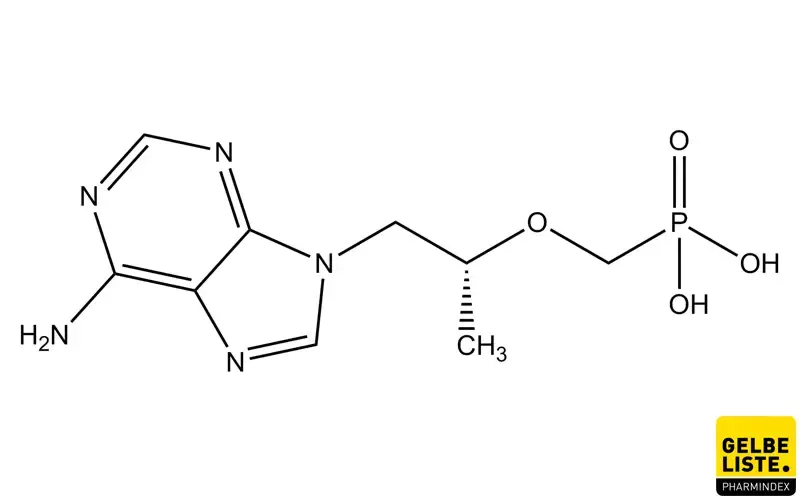
Tenofovir
Tenofovir ist ein nukleotidischer Reverse-Transkriptase-Inhibitor, der zur Behandlung von HIV und chronischer Hepatitis B angewendet wird. Der Wirkstoff wird in Form seines Prodrugs Tenofovirdisoproxil in Medikamenten eingesetzt.
Tenofovir: Übersicht
Anwendung
Der Reverse-Transkriptase-Inhibitor Tenofovir besitzt folgende Indikationsgebiete:
HIV-1-Infektion
Tenofovir wird in Kombination mit anderen antiretroviralen Arzneimitteln zur Behandlung HIV-1-angewendet, wenn der Einsatz von First-Line-Arzneimitteln aufgrund einer Resistenz gegenüber NRTI oder aufgrund von Unverträglichkeiten ausgeschlossen ist.
Die Entscheidung zur Behandlung von antiretroviral vorbehandelten Patienten mit HIV-1-Infektion sollte auf viralen Resistenztests und/oder der Behandlungshistorie der einzelnen Patienten basieren.
Hepatitis-B-Infektion
Tenofovir wird angewendet zur Behandlung der chronischen Hepatitis B bei:
- kompensierter Lebererkrankung mit nachgewiesener immunaktiver Erkrankung, d. h. aktiver viraler Replikation und dauerhaft erhöhten ALT-Werten im Serum oder histologischem Nachweis einer mäßigen bis schweren Entzündung und/oder Fibrose.
- nachgewiesenem Lamivudin-resistentem Hepatitis-B-Virus
- dekompensierter Lebererkrankung
Anwendungsart
Tenofovir ist als Filmtablette (25, 123, 163, 204 oder 245 mg), Granulat (33 mg/g) oder Fixkombination mit anderen antiretroviralen Wirkstoffen (meist 245 mg) erhältlich. Die Einnahme sollte zu einer Mahlzeit erfolgen.
Die Therapie soll nur durch einen Arzt eingeleitet werden, der in der Behandlung der HIV-Infektion und/oder der chronischen Hepatitis B erfahren ist.
Bei der Entscheidung über ein neues Behandlungsschema für Patienten, bei denen eine antiretrovirale Therapie versagt hat, müssen die Mutationsmuster der verschiedenen Arzneimittel und vorangegangene Therapien beim einzelnen Patienten sorgfältig berücksichtigt werden. Ein Resistenztest könnte angebracht sein.
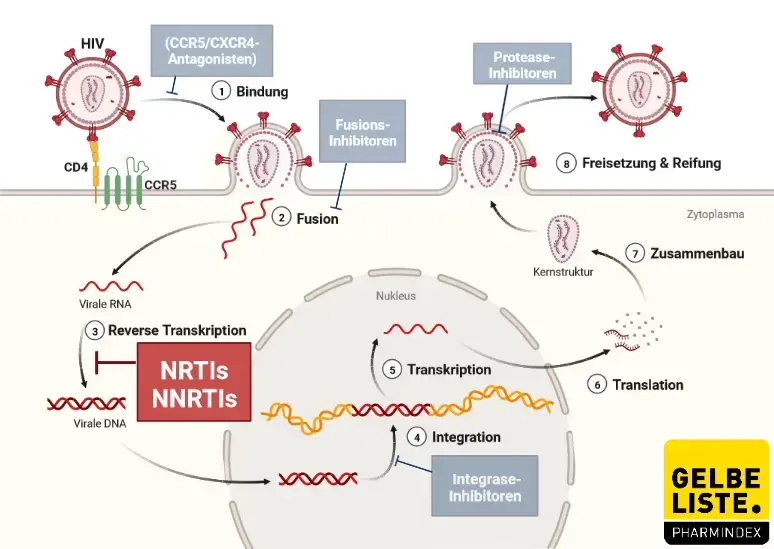
Wirkmechanismus
Tenofovir ist ein Nukleotidanalogon (NA) von Adenosin-5′-monophosphat. In seiner Ausgangsform liegt Tenofovir bei physiologischem pH-Wert als Dianion vor, das mit schlechter Membranpermeabilität und geringer oraler Bioverfügbarkeit assoziiert ist. Zur Verbesserung der oralen Bioverfügbarkeit und Membranpermeabilität ist Tenofovir in Form von Prodrugs wie TDF (Tenofovirdisoproxilfumarat) und TAF (Tenofoviralafenamid) erhältlich. Nach oraler Anwendung wird TDF durch Darm- und Plasmaesterasen zu Tenofovir hydrolysiert, und TAF hauptsächlich intrazellulär durch Cathepsin A zu Tenofovir metabolisiert.
Tenofovir wird dann intrazellulär zu Tenofovir-Diphosphat aktiviert. Tenofovir-Diphosphat hemmt die HIV-Replikation, indem es mit dem natürlichen Substrat Desoxyadenosin-5′-Triphosphat um den Einbau in die DNA während der HIV-Transkription konkurriert. Darüber hinaus hemmt Tenofovir-Diphosphat die Replikation von HBV durch Hemmung der HBV-Polymerase.
Das Prodrug TDF hat im Vergleich zum Ausgangsstoff Tenofovir in vitro und in vivo ein verbessertes PK-Profil und eine verbesserte antivirale Aktivität. In vitro konnte eine mehr als 100-fache Steigerung der Anti-HIV-Aktivität mit TDF im Vergleich zu Tenofovir gezeigt werden. Diese Verbesserung wird auf eine schnelle intrazelluläre Aufnahme von TDF zurückgeführt, was zu einer erhöhten intrazellulären Akkumulation von aktivem Tenofovir-Diphosphat führt.
Pharmakokinetik
Resorption
- Nach oraler Einnahme von Tenofovirdisoproxil (bei HIV-infizierten Patienten) wird dieses schnell resorbiert und in Tenofovir umgewandelt.
- Nach mehrfachen Dosen von Tenofovirdisoproxil zu einer Mahlzeit (bei HIV-infizierten Patienten) liegen die Durchschnittswerte (% Variationskoeffizient) von Tenofovir für cmax bei 326 (36,6%) ng/mL, für die AUC bei 3.324 (41,2%) ng·h/mL und für cmin bei 64,4 (39,4%) ng/mL.
- Die maximale Serumkonzentration von Tenofovir wird bei Einnahme auf nüchternen Magen innerhalb einer Stunde erreicht, bei Einnahme mit Nahrungsmitteln innerhalb von zwei Stunden.
- Die orale Bioverfügbarkeit von Tenofovir aus Tenofovirdisoproxil bei nüchternen Patienten beträgt ca. 25%.
- Bei Einnahme von Tenofovirdisoproxil mit einer fettreichen Mahlzeit erhöht sich die orale Bioverfügbarkeit (die AUC von Tenofovir steigt dabei um ca. 40%, der cmax-Wert um etwa 14%).
- Nach Gabe der ersten Dosis Tenofovirdisoproxil liegt der Medianwert für cmax im Serum zwischen 213 und 375 ng/mL.
- Die Einnahme von Tenofovirdisoproxil mit einer leichten Mahlzeit wirkt sich hingegen nicht signifikant auf die Pharmakokinetik von Tenofovir aus.
Verteilung
- Nach intravenöser Gabe wird das Verteilungsvolumen von Tenofovir im Steady-State auf etwa 800 mL/kg geschätzt.
- Nach oraler Gabe von Tenofovirdisoproxil verteilt sich Tenofovir in die meisten Gewebe, wobei sich die höchsten Konzentrationen in den Nieren, der Leber und im Darminhalt finden (präklinische Studien).
-
In vitro beträgt die Proteinbindung von Tenofovir bei einer
Tenofovir-Konzentration zwischen 0,01 und 25 μg/mL weniger als 0,7% bei Plasmaproteinen bzw. 7,2% bei Serumproteinen.
Metabolismus
- Weder Tenofovirdisoproxil noch Tenofovir sind Substrate für CYP450-Enzyme (in vitro).
-
Auch bei Konzentrationen, die wesentlich höher (ca. 300-fach) als die
In-vivo-Konzentrationen sind, hemmt Tenofovir in vitro nicht den Arzneimittel-Metabolismus, der von einem der wichtigen humanen CYP450-Isoformen, die an der Arzneimittel-Biotransformation
beteiligt sind (CYP3A4, CYP2D6, CYP2C9, CYP2E1 oder CYP1A1/2), vermittelt wird. - Tenofovirdisoproxil hat in einer Konzentration von 100 μmol/L keine Wirkung auf eine der CYP450-Isoformen, mit Ausnahme von CYP1A1/2, bei der eine geringfügige (6%) aber statistisch signifikante Reduzierung des CYP1A1/2-Substrat-Metabolismus zu beobachten ist.
- Ausgehend von diesen Daten ist es unwahrscheinlich, dass klinisch bedeutsame Interaktionen zwischen Tenofovirdisoproxil und Arzneimitteln, die durch CYP-Enzyme metabolisiert werden, auftreten.
Elimination
- Tenofovir wird primär renal eliminiert (sowohl durch Filtration als auch durch das aktive tubuläre Transportsystem), wobei nach intravenöser Applikation etwa 70-80% der Dosis als unveränderte Substanz über den Urin ausgeschieden werden.
- Die Aufnahme in die proximalen Tubuluszellen erfolgt über den human Organic Anion Transporter (hOAT) 1 und 3 und die Abgabe in den Urin über das Multi Drug Resistant Protein 4 (MRP 4).
- Die Gesamt-Clearance wird auf etwa 230 mL/h/kg (ca. 300 mL/min) geschätzt.
- Die renale Clearance beträgt ungefähr 160 mL/h/kg (ca. 210 mL/min), was die glomeruläre Filtrationsrate übersteigt (dies deutet darauf hin, dass die aktive tubuläre Sekretion bei der Ausscheidung von Tenofovir eine wichtige Rolle spielt).
- Nach oraler Gabe liegt die terminale Halbwertzeit von Tenofovir bei etwa 12-18 Stunden.
Nierenfunktionsstörung
-
Die pharmakokinetischen Parameter von Tenofovir wurden nach Gabe einer Einzeldosis Tenofovirdisoproxil 245 mg an 40 nicht-HIV- und nicht-HBV-infizierten erwachsenen Patienten ermittelt, die unterschiedlich stark ausgeprägte Nierenfunktionsstörungen aufwiesen, was auf Basis der Kreatinin-Clearance (CrCl) bei Erwachsenen zu Studienbeginn definiert wurde (normale Nierenfunktion bei CrCl > 80 mL/min; leichte Nierenfunktionsstörung bei CrCl = 50-79 mL/min;
mittelgradige Nierenfunktionsstörung bei CrCl = 30-49 mL/min und schwerwiegende Nierenfunktionsstörung bei CrCl = 10-29 mL/min). -
Im Vergleich zu Patienten mit normaler Nierenfunktion erhöht sich die mittlere Tenofovir-Exposition (% Variationskoeffizient) von
2.185 (12%) ng·h/mL bei Patienten mit CrCl > 80 mL/min auf 3.064 (30%) ng·h/mL (leichte Nierenfunktionsstörung), 6.009 (42%) ng·h/mL (mittelgradige Nierenfunktionsstörung) bzw. 15.985 (45%) ng·h/mL (schwerwiegende Nierenfunktionsstörung). - Die pharmakokinetische Modellierung von pharmakokinetischen Daten nach Einmalgabe bei nicht-HIV- und nicht-HBV-infizierten erwachsenen Patienten mit unterschiedlich stark ausgeprägten Nierenfunktionsstörungen wurde zur Bestimmung der Dosisempfehlung und der Empfehlung zum Dosierungsintervall bei erwachsenen Patienten mit unterschiedlich stark ausgeprägten Nierenfunktionsstörungen herangezogen.
- Für erwachsene Patienten mit einer berechneten Kreatinin-Clearance (CrCl) von 30-49 mL/min wird eine Dosis von 132 mg Tenofovirdisoproxil Granulat 1x täglich empfohlen, für 20-29 mL/min eine Dosis von 65 mg und für 10-19 mL/min eine Dosis von 33 mg Tenofovirdisoproxil Granulat 1x täglich.
-
Obwohl diese Dosierungen erwartungsgemäß nicht exakt das
pharmakokinetische Profil von Tenofovir bei Patienten mit normaler Nierenfunktion unter Tenofovirdisoproxil 245 mg Filmtabletten reproduzieren, betrachtet man sie als geeignet zur Darstellung eines bestmöglichen Nutzen-/Risiko-Verhältnisses bei Patienten mit einer
Nierenfunktionsstörung. -
Bei dialysepflichtigen Patienten mit terminaler Niereninsuffizienz (ESRD) (CrCl < 10 mL/min) limitiert eine Dosis von 16,5 mg Tenofovirdisoproxil im Anschluss an die Hämodialyse-Sitzung
voraussichtlich die systemische Akkumulation von Tenofovir auf ungefähr 2-fache Expositionen verglichen mit denen, die bei Patienten mit normaler Nierenfunktion unter Tenofovirdisoproxil 245 mg Filmtabletten beobachtet wurden. - Mit dieser Dosisempfehlung wird abgewogen zwischen der Notwendigkeit, die Akkumulation des Wirkstoffs zu begrenzen, und dem Bestreben, ausreichende Tenofovir-Konzentrationen während des Dosierungsintervalls zu erhalten (d.h. Talspiegel zu erreichen ähnlich denen, die bei Patienten mit normaler Nierenfunktion unter Tenofovirdisoproxil 245 mg Filmtabletten beobachtet werden).
- Bei nicht hämodialysepflichtigen Patienten mit einer Kreatinin-Clearance < 10 mL/min und bei Patienten mit terminaler Niereninsuffizienz, die Peritonealdialyse oder andere Dialyseformen anwenden, wurde die Pharmakokinetik von Tenofovir nicht untersucht.
- Die Pharmakokinetik von Tenofovir wurde bei Kindern und Jugendlichen mit Nierenfunktionsstörung nicht untersucht (es liegen keine Daten für eine Dosisempfehlung vor).
Dosierung
Die Dosierung von Tenofovir richtet sich primär nach patientenindividuellen Faktoren (Alter, Gewicht, Erkrankung). Dabei kann die Darreichungsform (Filmtablette bzw. Granulat) variieren, um eine optimale Patientencompliance zu erzielen, sofern beispielsweise Schwierigkeiten bei der Einnahme von Filmtabletten bestehen.
Das Granulat ist mit dem beiliegenden Messlöffel abzumessen. Ein gestrichener Messlöffel enthält 1 g Granulat mit 33 mg Tenofovirdisoproxil. Es sollte in einem Behältnis mit einem weichen Nahrungsmittel, das nicht gekaut werden muss (z.B. Joghurt, Apfelmus oder Babynahrung) gemischt werden. Für einen gestrichenen Messlöffel Granulat ist ein Esslöffel (15 mL) weicher Nahrung erforderlich. Dabei sollte gesamte Mischung sofort eingenommen werden.
Das Granulat darf nicht mit Flüssigkeiten gemischt werden.
HIV-1 und chronische Hepatitis B
Erwachsene und Jugendliche im Alter von 12 bis < 18 Jahren mit einem Körpergewicht ≥ 35 kg:
- Empfohlene Tagesdosis: 1x täglich 245 mg (eine Tablette) zu einer Mahlzeit
- Tenofovir ist zur Behandlung der HIV-1-Infektion und der chronischen Hepatitis B bei Erwachsenen oder Jugendlichen auch als 33 mg/g Granulat erhältlich (7,5 Messlöffel bei einem Körpergewicht ≥ 35 kg).
Kinder im Alter von 2 bis < 12 Jahren:
- Empfohlene Tagesdosis: 1x täglich 6,5 mg Tenofovirdisoproxil (Granulat) pro Kilogramm Körpergewicht zu einer Mahlzeit
Kinder und Jugendliche im Alter von 6 bis < 12 Jahren mit einem Körpergewicht von 17 kg bis < 22 kg, die in der Lage sind, Filmtabletten zu schlucken:
- Empfohlene Tagesdosis: 1x täglich 123 mg (eine Tablette) zu einer Mahlzeit
Kinder und Jugendliche im Alter von 6 bis < 12 Jahren mit einem Körpergewicht von 22 kg bis < 28 kg, die in der Lage sind, Filmtabletten zu schlucken:
- Empfohlene Tagesdosis: 1x täglich 163 mg (eine Tablette) zu einer Mahlzeit
Kinder und Jugendliche im Alter von 6 bis < 12 Jahren mit einem Körpergewicht von 28 kg bis < 35 kg, die in der Lage sind, Filmtabletten zu schlucken:
- Empfohlene Tagesdosis: 1x täglich 204 mg (eine Tablette) zu einer Mahlzeit
Nebenwirkungen
Die häufigsten Nebenwirkungen, die im Zusammenhang mit Tenofovir auftreten können, umfassen:
- Schwindelgefühl
- Gastrointestinale Beschwerden (Diarrhö, Übelkeit, Erbrechen, Flatulenz)
- Erhöhte Transaminasen
- Hautausschlag
- Asthenie
- Hypophosphatämie (infolge einer proximalen renalen Tubulopathie)
Zu den schwerwiegendsten Nebenwirkungen zählen:
- Nierenfunktionsstörungen und Nierenversagen
- Angioödem
- Laktatazidose
- Immunrekonstitutionssyndrom (entzündliche Reaktion auf asymptomatische oder residuale opportunistische Infektionen zum Zeitpunkt der Therapieeinleitung bei schwerem Immundefekt)
- Osteonekrose (bei Patienten mit Risikofaktoren, fortgeschrittener HIV-Erkrankung oder Langzeitanwendung einer antiretroviralen Therapie)
- Hepatitis-Exazerbationen (während der Behandlung sowie nach Absetzen der Therapie und HBV-Koinfektion)
- Rhabdomyolyse und Myopathie (infolge einer proximalen renalen Tubulopathie)
Wechselwirkungen
Im Gegensatz zu vielen anderen Komponenten der ARV-Therapie besitzen sowohl TDF als auch TAF aufgrund des fehlenden enzymatischen Metabolismus durch CYP450 nur minimale klinisch signifikante Arzneimittelwechselwirkungen.
Beide Wirkstoffe sind Substrate von BCRP/ABCG2 und P-Glykoprotein/ABCB1 sowie Inhibitoren von MRP2. Arzneimittel, die die P-Glykoprotein- und BCRP-Aktivität stark beeinflussen, können die TAF-Absorption beeinträchtigen. P-Glykoprotein-Induktoren verringern wahrscheinlich die Resorption von TAF, was möglicherweise zu einem Therapieversagen führt. P-Glykoprotein-Inhibitoren führen zu einer erhöhten Resorption und Plasmakonzentration des Arzneimittels, die höher als normal ist. Zu den starken P-Glykoprotein-Induktoren gehören Antikonvulsiva (Carbamazepin, Oxcarbazepin, Phenobarbital, Phenytoin) sowie Rifabutin, Rifampicin und Johanniskraut.
Da Tenofovir über die Nieren ausgeschieden wird, kann die gleichzeitige Verabreichung mit anderen Arzneimitteln, die um die aktive tubuläre Sekretion konkurrieren, die Plasmakonzentration von Tenofovir und/oder des gleichzeitig verabreichten Arzneimittels erhöhen. Dieser Warnhinweis zu Arzneimittelwechselwirkungen gilt sowohl für TDF als auch für TAF. Gängige Beispiele für Medikamente, die um die aktive tubuläre Sekretion in der Niere konkurrieren können, sind Aciclovir, Cidofovir, Ganciclovir, Valaciclovir, Valganciclovir, Aminoglykoside und NSAR.
Die Bioverfügbarkeit von TDF wird durch eine fetthaltige Mahlzeit um etwa 40% erhöht, dies hat jedoch keinen Einfluss auf die Verabreichungsempfehlungen. Die Bioverfügbarkeit von TAF wird durch eine fettreiche Mahlzeit um etwa 65% erhöht. Deshalb wird empfohlen, TAF zusammen mit Nahrung einzunehmen.
Kontraindikationen
Tenofovir darf nicht angewendet werden bei Überempfindlichkeit gegen den Wirkstoff.
Schwangerschaft
Umfassende Erfahrungen an schwangeren Frauen (über 1000 Schwangerschaftsausgänge) deuten nicht auf ein Fehlbildungsrisiko oder eine fetale/neonatale Toxizität in Verbindung mit Tenofovirdisoproxil hin. Auch tierexperimentelle Studien ergaben keine Hinweise auf eine Reproduktionstoxizität.
Falls notwendig kann eine Anwendung von Tenofovirdisoproxil während der Schwangerschaft in Betracht gezogen werden.
In drei kontrollierten klinischen Studien erhielten insgesamt 327 Schwangere mit chronischer HBV-Infektion ab der 28. bis 32. Schwangerschaftswoche durchgehend bis zu ein bis zwei Monate nach der Geburt einmal täglich Tenofovirdisoproxil (245 mg). Die Frauen und ihre Säuglinge wurden bis zu 12 Monate nach der Entbindung weiter beobachtet, wobei die Daten keine Warnsignale bezüglich der Sicherheit ergaben.
Stillzeit
Tenofovir geht in sehr geringen Mengen in die Muttermilch über, wobei die Exposition von Säuglingen über die Muttermilch als vernachlässigbar angesehen wird. Obwohl nur wenige Langzeitdaten zur Verfügung stehen, wurden keine Nebenwirkungen bei gestillten Säuglingen berichtet.
Im Allgemeinen kann eine Mutter mit Hepatitis B ihren Säugling stillen, wenn für das Neugeborene bei der Geburt angemessene Maßnahmen zur Hepatitis-B-Prävention ergriffen werden. Auch HBV-infizierte Mütter, die Tenofovirdisoproxil anwenden, dürfen stillen.
Generell wird empfohlen, dass HIV-infizierte Frauen ihre Kleinkinder auf keinen Fall stillen, um eine Übertragung von HIV auf das Kind zu vermeiden.
Verkehrstüchtigkeit
Es wurden keine Studien zu den Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen durchgeführt. Die Patienten sollten allerdings darüber informiert werden, dass im Zusammenhang mit der Anwendung von Tenofovir über Schwindelgefühle berichtet wurde.
Anwendungshinweise
Kombinationstherapie:
- Die antiretrovirale Therapie sollte immer aus einer Kombination mehrerer antiretroviraler Wirkstoffe bestehen, um in erster Linie Resistenzen zu minimieren und synergistische Wirkungen zu erzielen.
- Nicht alle antiretroviralen Wirkstoffe dürfen bedenkenlos kombiniert werden.
Opportunistische Infektionen:
- Patienten, die eine antiretrovirale Therapie erhalten, können dennoch opportunistische Infektionen und sonstige Komplikationen einer HIV-Infektion entwickeln.
- Deshalb ist auch weiterhin eine engmaschige klinische Überwachung durch Ärzte erforderlich, die in der Behandlung von Patienten mit Begleiterkrankungen einer HIV-Infektion erfahren sind.
HIV-Übertragung:
- Obwohl gezeigt wurde, dass die erfolgreiche Virussuppression durch eine antiretrovirale Therapie das Risiko einer sexuellen Übertragung erheblich reduziert, kann ein Restrisiko nicht ausgeschlossen werden.
- Insbesondere Patienten, die nicht in einer monogamen Partnerschaft leben, sollte daher auch unter erfolgreicher Therapie die Beibehaltung von Vorsichtsmaßnahmen zur Vermeidung einer Weitergabe der HIV-Infektion (v.a. Kondomgebrauch) empfohlen werden.
Alternativen
Nukleosidische Reverse-Transkriptase-Inhibitoren (NRTIs):
Nukleotidanaloge Reverse-Transkriptase-Inhibitoren (NtRTIs):
Nicht-nukleosidische Reverse-Transkriptase-Inhibitoren (NNRTI):
Wirkstoff-Informationen
- Fachinformation Viread
- Fachinformation Tenofovirdisoproxil AL
- Wassner, Chanie, Nicole Bradley, and Yuman Lee. "A review and clinical understanding of tenofovir: tenofovir disoproxil fumarate versus tenofovir alafenamide." Journal of the International Association of Providers of AIDS Care (JIAPAC) 19 (2020): 2325958220919231.
Abbildung
Adapted from „HIV Sites for Therapeutic Intervention”, by BioRender.com











