Tezepelumab
Tezepelumab (Tezspire) ist der erste monoklonale Antikörper, der die Wirkung von thymischem stromalem Lymphopoietin (TSLP) hemmt. Die Blockade von TSLP reduziert die Freisetzung proinflammatorischer Zytokine durch Immunzellen. Zugelassen ist Tezepelumab zur Add-on-Erhaltungstherapie von schwerem Asthma.
Tezepelumab : Übersicht
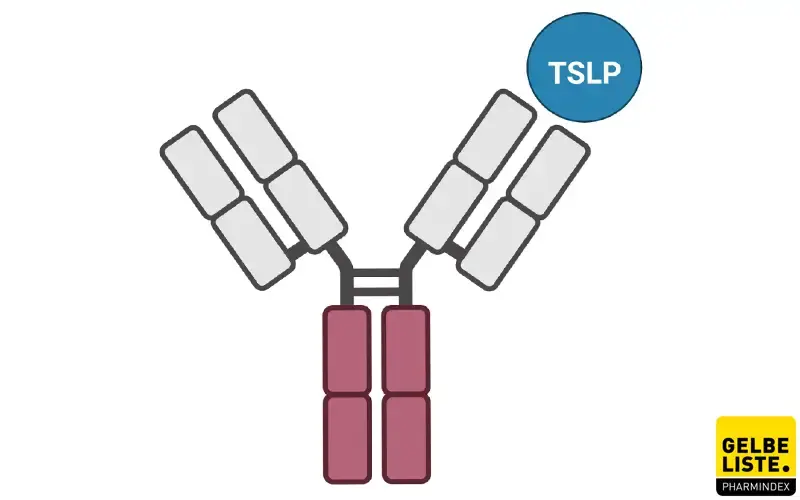
Anwendung
Tezepelumab ist ein gegen TSLP gerichteter Antikörper, der zur Add-on-Erhaltungstherapie von schwerem Asthma bei Erwachsenen und Jugendlichen ab 12 Jahren indiziert ist, das trotz hochdosierter inhalativer Kortikosteroide plus eines weiteren Arzneimittels zur Erhaltungstherapie unzureichend kontrolliert ist.
Anwendungsart
Tezepelumab wird als subkutane Injektion verabreicht und sollte in den Oberschenkel oder in den Bauch injiziert werden, jedoch nicht in den 5-cm-Bereich um den Bauchnabel herum. Nach Schulung in der subkutanen Injektionstechnik können sich Patienten dieses Arzneimittel selbst injizieren oder sich von ihren Betreuungspersonen injizieren lassen.
Wirkmechanismus
Tezepelumab greift sehr früh in die Entzündungskaskade ein. Dabei neutralisiert der monoklonale Antikörper das Zytokin TSLP, das in Haut- und Schleimhautepithelien gebildet wird. TSLP soll antigenpräsentierende Zellen alarmieren und so eine immunologische Reaktion einleiten. Bei Asthma induzieren sowohl allergische als auch nicht-allergische Auslöser die TSLP-Produktion. Das Blockieren von TSLP durch Tezepelumab verringert ein breites Spektrum an Biomarkern und Zytokinen, die mit Atemwegsentzündungen in Zusammenhang stehen (z. B. Eosinophile im Blut oder in der Atemwegsschleimhaut, IgE, FeNO, IL-5 und IL-13).

Pharmakokinetik
Resorption
- Nach einmaliger subkutaner Gabe wurde die maximale Serumkonzentration innerhalb von ca. 3 bis 10 Tagen erreicht.
- Die geschätzte absolute Bioverfügbarkeit beträgt ca. 77%.
- Es gab keinen klinisch relevanten Unterschied im Hinblick auf die Bioverfügbarkeit bei der Verabreichung an unterschiedlichen Injektionsstellen (Bauch, Oberschenkel oder Oberarm).
Verteilung
- Das zentrale und periphere Verteilungsvolumen von Tezepelumab wird mit 3,9 Liter bzw. 2,2 Liter bei einer 70 kg schweren Person angegeben.
Biotransformation
- Tezepelumab ist ein humaner monoklonaler Antikörper (IgG2λ), der durch im Körper weit verbreiteter proteolytischer Enzyme abgebaut wird.
- Tezepelumab wird nicht von Leberenzymen verstoffwechselt.
Elimination
- Als humaner monoklonaler Antikörper wird Tezepelumab durch intrazellulären Katabolismus eliminiert.
- Es gibt keinen Hinweis auf eine Target-vermittelte Clearance.
- Die geschätzte Clearance wird mit 0,17 Liter/Tag für eine 70 kg schwere Person angegeben.
- Die Eliminationshalbwertszeit beträgt etwa 26 Tage.
Nebenwirkungen
Die am häufigsten berichteten Nebenwirkungen, die in den klinischen Studien unter Tezepelumab auftraten, waren:
- Pharyngitis
- Hautausschlag
- Arthralgie
- Reaktionen an der Injektionsstelle
Wechselwirkungen
Es wurden keine Studien zur Erfassung von Wechselwirkungen durchgeführt. Die Anwendung attenuierter Lebendimpfstoffe sollte bei Patienten, die Tezepelumab erhalten, vermieden werden.
Es ist nicht zu erwarten, dass Tezepelumab einen klinisch relevanten Einfluss auf die Pharmakokinetik von gleichzeitig angewendeten Asthma-Arzneimitteln hat.
Auf Grundlage populationspharmakokinetischer Analysen hatten häufig gleichzeitig angewendete Asthma-Arzneimittel (einschließlich Leukotrienrezeptor-Antagonisten, Theophyllin/Aminophyllin und oraler Kortikosteroide) keinen Einfluss auf die Clearance von Tezepelumab.
Kontraindikationen
Tezepelumab darf nicht angewendet werden bei Überempfindlichkeit gegen den Wirkstoff oder einen der sonstigen Bestandteile des Arzneimittels.
Schwangerschaft
Bisher liegen keine oder nur sehr begrenzte Erfahrungen (weniger als 300 Schwangeschaftsverläufe) mit der Anwendung von Tezepelumab bei Schwangeren vor. Tierexperimentelle Studien ergaben
keine Hinweise auf direkte oder indirekte gesundheitsschädliche Auswirkungen in Bezug auf die Reproduktionstoxizität.
Humane IgG-Antikörper, wie z. B. Tezepelumab, werden über die Plazentaschranke transportiert; aus diesem Grund kann Tezepelumab von der Mutter auf den sich entwickelnden Fötus übergehen.
Aus Vorsichtsgründen soll eine Anwendung von Tezspire während der Schwangerschaft vermieden werden, es sei denn, der zu erwartende Nutzen für die schwangere Mutter überwiegt jedes potenzielle Risiko für das ungeborene Kind.
Stillzeit
Es ist bekannt, dass humane IgG-Antikörper innerhalb der ersten Tage nach der Geburt in die Muttermilch übergehen, wobei sich deren Konzentrationen kurz danach auf niedrige Werte reduzieren. Während dieses kurzen Zeitraums kann bei der Anwendung von Tezepelumabein ein Risiko für den gestillten Säugling nicht ausgeschlossen werden. Innerhalb dieser Zeit muss eine Entscheidung darüber getroffen werden, ob die Behandlung mit Tezepelumab unterbrochen/auf die Behandlung verzichtet werden soll. Dabei soll sowohl der Nutzen des Stillens für das Kind als auch der Nutzen der Therapie für die Frau berücksichtigt werden.
Danach kann Tezepelumab während der Stillzeit angewendet werden, wenn dies aus klinischer Sicht notwendig ist.
Verkehrstüchtigkeit
Tezepelumab hat keinen oder einen zu vernachlässigenden Einfluss auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen.
- EMA: Fachinformation Tezspire
- Hoy, Sheridan M. "Tezepelumab: First Approval." Drugs (2022): 1-8.
- Marone, Giancarlo, et al. "Tezepelumab: a novel biological therapy for the treatment of severe uncontrolled asthma." Expert opinion on investigational drugs 28.11 (2019): 931-940.
Abbildung
Created with Biorender
-
Tezspire 210 mg Abacus Injektionslösung in einer Fertigspritze
Abacus Medicine A/S
-
Tezspire® 210 mg Injektionslösung im Fertigpen
AstraZeneca GmbH
-
Tezspire® 210 mg Injektionslösung in einer Fertigspritze
AstraZeneca GmbH
-
Tezspire 210 mg Paranova Injektionslösung in einem Fertigpen
Paranova Pack A/S
-
Tezspire 210 mg Paranova Injektionslösung in einer Fertigspritze
Paranova Pack A/S