Thalidomid
Der immunmodulatorische Wirkstoff Thalidomid wird in Kombination mit Prednison und Melphalan bei Patienten zur Erstlinientherapie des Multiplen Myeloms angewendet. Zu beachten ist hierbei insbesondere die stark teratogene Wirkung, die zuverlässige Verhütungsmethoden nötig macht.
Thalidomid: Übersicht
Anwendung
Thalidomid ist durch den Contergan-Skandal bekannt. In den 1950er Jahren wurde der Wirkstoff als Schlafmittel (Contergan) eingeführt, allerdings in den 1960er Jahren aufgrund schwerwiegender teratogener Wirkungen (v.a. Phokomelie, Robbengliedrigkeit) wieder vom Markt genommen.
Heutzutage ist Thalidomid (Thalidomide Celgene) in Kombination mit dem Zytostatikum Melphalan und dem Glucocorticoid Prednison indiziert für die Erstlinienbehandlung von Patienten mit unbehandeltem Multiplen Myelom ab einem Alter von ≥65 Jahren, für die eine hochdosierte Chemotherapie nicht in Frage kommt.
Off Label wird der Wirkstoff außerdem gegen Lepra angewendet.
Anwendungsart
Thalidomid steht in Form von Hartkapseln in einer Wirkstärke von 50 mg zur Verfügung. Aufgrund der sedierenden Wirkung sollte das Arzneimittel vor dem Schlafengehen eingenommen werden, um die Verträglichkeit zu verbessern.
Wirkmechanismus
Thalidomid hat sowohl immunmodulatorische, anti-inflammatorische als auch potenziell anti-neoplastische Wirkungen und zählt zu den zentral aktiven, hypnotischen Sedativa. Der Wirkstoff hat ein chirales Zentrum und wird in Form des Racemats verwendet.
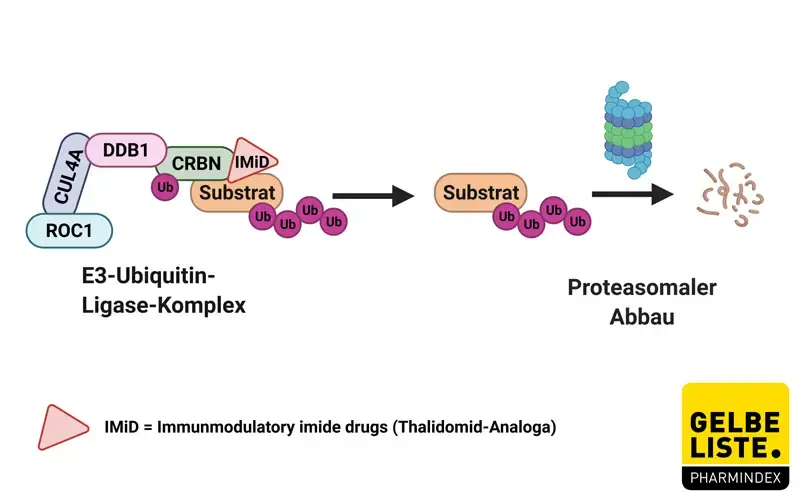
Für die immunmodulatorische sowie auch teratogene Wirkung verantwortlich ist die Interaktion von Thalidomid mit dem Protein Cereblon (CRBN). Dieses bildet mit weiteren Strukturen (ROC1, CUL4A, DDB1) einen E3-Ubiquitin-Ligase-Komplex, der zahlreiche Proteine modifiziert und zum proteasomalen Abbau dieser Substrate führt.
- Die Bindung von Thalidomid an CRBN führt zum Abbau bestimmter Transkriptionsfaktoren wie Ikaros (IKZF1) und Aiolos (IKZF3), was wahrscheinlich die immunmodulatorische Wirkung bedingt. Die beiden Transkriptionsfaktoren sind beispielsweise essenziell für die Differenzierung und das Überleben von B-Lymphozyten.
- CRBN bindet außerdem an die Proteine DC147 (Basisgin, extra-cellular matrix metalloproteinase inducer, EMMPRIN) und MCT1 (Monocarboxylattransporter 1, SLC16A1), die vor allem in Zellen des blutbildenden Systems und Immunzellen vorkommen und eine Rolle bei der Gefäßneubildung und dem Zellstoffwechsel spielen.
- CRBN kann den Transkriptionsfaktor SALL4 (Sal-like protein 4), ein C2H2-Zinkfingerprotein, für den proteasomalen Abbau markieren. SALL4 ist unter anderem für eine korrekte Gliedmaßenentwicklung verantwortlich, weshalb der Abbau die Phokomelie als schweren teratogenen Effekt von Thalidomid verursacht.
Unabhängig von der E3-Ubiquitin-Ligase-Funktion trägt CRBN zur korrekten Faltung zahlreicher Signalproteine bei und hat eine Rolle als transmembran-spezifisches Chaperon für das Heat-Shock-Protein (HSP) 90. Dier indirekte Hemmung der Signalproteine durch Thalidomid trägt zu den antiangiogenen Wirkungen bei.
Pharmakokinetik
Resorption
- Thalidomid wird nach oraler Gabe langsam absorbiert. Die maximalen Plasmaspiegel werden nach 1 bis 5 Stunden erreicht.
- Die gleichzeitige Einnahme des Arzneimittels mit Nahrung führt zu einer Resorptionsverzögerung. Das Gesamtausmaß der Aufnahme wird jedoch nicht beeinträchtigt.
Verteilung (Distribution)
- Die Thalidomid-Enantiomere sind zu 55% (R-Enantiomer) und 65% (S-Enantiomer) an Plasmaproteine gebunden.
- Die Konzentration in der Samenflüssigkeit bei Männern ist mit der Plasmakonzentration vergleichbar.
Metabolismus (Biotransformation)
- Thalidomid wird fast ausschließlich nicht-enzymatisch hydrolysiert.
- Neben zu etwa 80% unverändertem Thalidomid sind auch die hydrolytischen Abbauprodukte N-(O-Carboxybenzoyl)-Glutarimid und Phthaloylisoglutamin im Plasma vorhanden sowie zu einem überwiegenden Teil im Urin.
Elimination
- Die mittlere Eliminations-Halbwertszeit von Thalidomid liegt bei Dosierungen von 50 mg bis 400 mg zwischen 5,5 und 7,3 Stunden.
- Die Ausscheidung erfolgt hauptsächlich renal (>90%).
- Zwischen dem Körpergewicht und der geschätzten Thalidomid-Clearance besteht ein linearer Zusammenhang.
Dosierung
Die empfohlene Dosierung beträgt pro Zyklus 200 mg Thalidomid täglich über sechs Wochen. Melphalan und Prednison werden jeweils einmal täglich an den ersten vier Tagen eines Zyklus in Dosierungen von 0,125 bis 0,25 mg/kg bzw. 2 mg/kg eingenommen.
Es sollten maximal zwölf Zyklen von jeweils sechs Wochen (42 Tage) durchgeführt werden.
Dosisanpassung
Die Dosierung kann je nach Alter der Patienten sowie der absoluten Neutrophilenzahl (ANC) und der Thrombozytenzahl angepasst werden. Die beobachtete Toxizität von Thalidomid (z.B. thromboembolische Ereignisse, periphere Neuropathie, schwere Hautreaktionen, Neutropenie, Thrombozytopenie) kann, in Abhängigkeit vom NCI-CTC-(National Cancer Institute Common Toxicity Criteria) Grad, eine Dosisverzögerung, eine Dosisreduktion oder einen Behandlungsabbruch erforderlich machen.
Ältere Patienten
Für ältere Patienten >75 Jahre beträgt die empfohlene Initialdosis von Thalidomid 100 mg pro Tag. Die Initialdosis von Melphalan wird bei dieser Patientengruppe unter Berücksichtigung der Knochenmarkreserve und Nierenfunktion vor Therapiebeginn auf 0,1 bis 0,2 mg/kg täglich reduziert. Bei mäßiger (Kreatinin-Clearance [CrCl] ≥30 aber <50 ml/min) oder schwerer (CrCl: <30 ml/min) Niereninsuffizienz ist eine weitere Dosisreduktion um 50% vorgesehen. Die maximale Tagesdosis von Melphalan beträgt bei Patienten >75 Jahre 20 mg.
Nebenwirkungen
Die folgenden Nebenwirkungen können bei der Behandlung mit Thalidomid häufig (≥1/100, <1/10) bis sehr häufig (≥ 1/10) auftreten.
- Pneumonie
- Akute myeloische Leukämie
- Febrile Neutropenie, Panzytopenie
- Verwirrtheitszustand, Depression
- Krampfanfälle, Koordinationsstörungen
- Hypakusis oder Taubheit
- Herzinsuffizienz, Bradykardie
- Tiefe Beinvenenthrombose
- Lungenembolie, interstitielle Lungenerkrankung, Bronchopneumopthie, Dyspnoe
- Erbrechen, Mundtrockenheit
- Toxischer Hautausschlag, Ausschlag, trockene Haut
- Nierenversagen
- Fieber, Asthenie, Unwohlsein
- Neutropenie, Leukopenie, Anämie, Lymphopenie, Thrombozytopenie
- Periphere Neuropathie, Tremor, Schwindelgefühl, Parästhesie, Dysasthesie, Somnolenz
- Obstipation
- Peripheres Ödem
Periphere Neuropathie ist eine sehr häufige und potenziell schwere Nebenwirkung der Behandlung mit Thalidomid, die zu irreversiblen Schäden führen kann.
Wechselwirkungen
Die folgenden Wechselwirkungen sind bei der Anwendung von Thalidomid zu beachten.
- Anxiolytika, Hypnotika, Antipsychotika, H1-Antihistaminika, Opiatderivate, Barbiturate, Alkohol: Verstärkung der Sedierung
- Arzneimittel mit Risiko für Torsade de Pointes-Tachykardie, Betablocker, Cholinesterasehemmer: additive bradykarde Wirkung
- Arzneimittel mit Risiko für periphere Neuropathie (z.B. Vincristin, Bortezomib): erhöhtes Risiko für periphere Neuropathie
- Hormonelle Kontrazeptiva: erhöhtes Risiko für thromboembolische Ereignisse
- Warfarin: engmaschige Kontrolle der INR in den ersten Wochen nach Therapieende, aufgrund des potenziell beschleunigten Metabolismus durch die Kombination mit Glucocortociden und des erhöhten Thromboserisikos
Klinisch relevante Wechselwirkungen von Thalidomid mit dem Cytochrom-P450-Enzymsystem sind unwahrscheinlich.
Kontraindikationen
Thalidomid darf nicht angewendet werden bei:
- Überempfindlichkeit gegen den Wirkstoff
- Schwangeren Frauen
- Gebärfähigen Frauen (es sei denn, alle Anforderungen des Schwangerschaftsverhütungsprogramms werden erfüllt)
- Männlichen Patienten, die die erforderlichen Verhütungsmaßnahmen nicht anwenden können oder wollen
Schwangerschaft
Die Anwendung von Thalidomid ist aufgrund der hoch teratogenen Wirkung in der Schwangerschaft kontraindiziert. Das Risiko für einen intrauterinen Tod oder schwere Fehlbildungen, wie Ektromelie der oberen und/oder unteren Gliedmaßen, Mikrotie mit Anomalie des äußeren Gehörgangs, Fehlbildungen des Mittel- und Innenohrs, Anomalien des Auges, angeborene Herzerkrankungen und renale Fehlbildungen ist sehr hoch.
Stillzeit
Es liegen keine Daten dazu vor, ob Thalidomid in die menschliche Muttermilch übergeht. Tierstudien zeigten einen Übertritt des Wirkstoffs in die Muttermilch. Aus diesem Grund sollte das Stillen während einer Behandlung mit Thaliodmid unterbleiben.
Verkehrstüchtigkeit
Insgesamt hat Thalidomid in der empfohlenen Dosierung einen geringen bis mäßigen Einfluss auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen. Der Wirkstoff kann allerdings sehr häufig zu Fatigue, Benommenheit, Somnolenz und häufig auch zu unscharfem Sehen führen. Aus diesem Grund sollten Patienten angewiesen werden, keine Fahrzeuge zu lenken, Maschinen zu bedienen oder gefährlichen Arbeiten nachzugehen, wenn diese Beschwerden auftreten.
Anwendungshinweise
Die Therapie mit Thalidomid darf nur von Ärzten eingeleitet und beaufsichtigt werden, die Erfahrung in der Anwendung von immunmodulatorischen oder chemotherapeutischen Wirkstoffen haben und denen die Risiken einer Thalidomid-Behandlung sowie die notwendigen Kontrollmaßnahmen vollumfänglich bekannt sind.
Überwachung
Die Patienten sollten auf Folgendes überwacht werden:
- Thromboembolische Ereignisse
- Periphere Neuropathie
- Schwere Hautreaktionen
- Bradykardie
- Synkope
- Somnolenz
- Neutropenie (Leukozytenzahl und Differentialblutbild)
- Thrombozytopenie
Thromboseprophylaxe
Es sollte mindestens während der ersten fünf Monate der Behandlung eine Thromboseprophylaxe durchgeführt werden, insbesondere bei Pateinten mit thrombogenen Risikofaktoren. Hierzu können beispielsweise niedermolekulare Heparine oder Warfarin angewendet werden.
Falls bei einem Patienten ein thromboembolisches Ereignis auftritt, muss die Therapie unterbrochen und eine standardgemäße Antikoagulation eingeleitet werden. Ist der Patienten stabilisiert, kann die Thalidomid-Behandlung nach sorgfältiger Nutzen-Risiko-Abwägung wieder aufgenommen werden. Die Antikoagulation ist während der Therapie fortzuführen.
Empfängnisverhütung
Thalidomid wirkt beim Menschen hochgradig teratogen und führt in hohem Maße zu schweren und lebensbedrohlichen Fehlbildungen. Der Wirkstoff darf daher niemals von Schwangeren oder gebärfähigen Frauen eingenommen werden, es sei denn, alle Anforderungen des Schwangerschaftsverhütungsprogramms werden erfüllt.
- Die Patientin ist sich des teratogenen Risikos für das ungeborene Kind bewusst und versteht die Notwendigkeit einer zuverlässigen Kontrazeption
- Es muss eine zuverlässige Kontrazeption erfolgen, die ohne jegliche Unterbrechung mindestens vier Wochen vor Therapiebeginn, während der gesamten Therapiedauer und mindestens vier Wochen nach dem Ende der Behandlung angewendet wird
- Eine zuverlässige Empfängnisverhütung muss auch bei Amenorrhoe erfolgen
- Geeignete Methoden zur Empfängnisverhütung sind: Hormonimplantate, Levonorgestrel-freisetzendes Intrauterinpessar (IUP), Depot-Medroxyprogesteronacetat, Sterilisation (Tubenligatur), Geschlechtsverkehr ausschließlich mit einem vasektomierten Partner (die Vasektomie muss durch zwei negative Samenanalysen bestätigt sein) oder reine Progesteron-Pillen mit ovulationshemmender Wirkung
- Die Patientin muss die zuverlässigen Kontrazeptiven Maßnahmen einhalten können
- Die Patientin wurde informiert und versteht die möglichen Konsequenzen einer
- Schwangerschaft und die Notwendigkeit, sich bei möglicher Schwangerschaft sofort ärztlich untersuchen zu lassen
- Die Patientin versteht die Notwendigkeit, die Behandlung schnellstmöglich zu beginnen, sobald Thalidomid nach einem negativen Schwangerschaftstest an sie abgegeben wurde
- Die Patientin versteht die Notwendigkeit von Schwangerschaftstests und lässt alle vier Wochen einen Schwangerschaftstest (Sensitivität mind. 25 mIE/ml) durchführen (Ausnahme: bestätigte Sterilisation, Tubenligatur)
- Die Patientin bestätigt, dass sie die Gefahren und erforderlichen Vorsichtsmaßnahmen versteht, die mit der Anwendung von Thalidomid verbunden sind.
Die folgenden Anforderungen des Schwangerschaftsverhütungsprogramms gelten für Männer, die Thalidomid anwenden, da der Wirkstoff in der Samenflüssigkeit vorhanden ist.
- Der Patient ist sich des teratogenen Risikos bewusst, wenn er mit einer schwangeren oder einer gebärfähigen Frau sexuell verkehrt
- Der Patient versteht die Notwendigkeit der Verwendung eines Kondoms (auch nach Vasektomie), wenn er während der Behandlung, während Einnahmeunterbrechungen und bis mindestens 7 Tage nach Beendigung der Behandlung mit einer schwangeren oder einer gebärfähigen Frau, die keine zuverlässige Verhütungsmethode anwendet, sexuell verkehrt
- Der Patient versteht, dass er bei Eintritt einer Schwangerschaft seiner Partnerin während oder bis zu 7 Tage nach Beendigung der Einnahme von Thalidomid seinen behandelnden Arzt sofort informieren muss und dass empfohlen wird, die Partnerin zur weiteren Beurteilung und Beratung an einen auf dem Gebiet der Teratologie spezialisierten oder hierin erfahrenen Arzt zu überweisen
Verschreibung
Eine Verordnung von Thalidomid und seinen Analoga ist ausschließlich über die zweiteiligen, nummerierten und personengebundenen T-Rezepte möglich. Verschreibende Ärzte müssen die Formulare beim Bundesinstitut für Arzneimittel und Medizinprodukte (BfArM) anfordern.
Für Frauen im gebärfähigen Alter darf eine Höchstmenge des verordneten Arzneimittels von einem Bedarf für vier Wochen nicht überschritten werden. In allen anderen Fällen darf der Bedarf von bis zu zwölf Wochen verordnet werden.
Nach dem Tag ihrer Ausstellung sind T-Rezepte sechs Tage lang gültig.
Die Patienten erhalten notwendiges medizinisches Informationsmaterial (Schulungsmaterial) vom verschreibenden Arzt. Für die Abgabe der Packungsbeilage sind seit dem 1. März 2022 die Apotheken verantwortlich. Die Apotheken müssen den Erhalt der T-Rezepte dokumentieren und die Durchschriften wöchentlich an das BfArM übermitteln. Über das sogenannte T-Register wird die Verschreibung und Abgabe von Arzneimitteln mit Lenalidomid, Pomalidomid oder Thalidomid überwacht.
Handhabung
Die Patienten müssen dazu angehalten werden, Thalidomid-Arzneimittel niemals an andere Personen weiterzugeben und nicht verbrauchte Kapseln am Ende der Behandlung an die Apotheke zurückzugeben.
Angehörige der Heilberufe und Pflegekräfte müssen bei der Handhabung der Blister oder Kapseln Einweghandschuhe tragen. Schwangere oder Frauen, die schwanger sein könnten, dürfen die Blister oder Kapseln nicht handhaben.
Alternativen
Auch die beiden Thalidomid-Analoga Lenalidomid und Pomalidomid können zur Behandlung des Multiplen Myeloms angewendet werden. Außerdem stehen die folgenden Wirkstoffe anderer Substanzklassen zur Verfügung.
- Strahlentherapie
- Stammzelltransplantation
- Chemotherapie (Cyclophosphamid, Melphalan)
- Proteasom-Inhibitoren (Bortezomib, Carfilzomib)
- Immunsuppressiva (Dexamethason, Prednisolon)
- Anti-CD38-Antikörper (Daratumumab)
Wirkstoff-Informationen
- AWMF: S3-Leitlinie Multiples Myelom (2021)
- EMA: Fachinformation Thalidomide Celgene
- Fink, E. C., & Ebert, B. L. (2015). The novel mechanism of lenalidomide activity. Blood, 126(21), 2366–2369. DOI: 10.1182/blood-2015-07-567958
- Geisslinger, Menzel, Gundermann, Hinz, Ruth (2020) Mutschler Arzneimittelwirkungen, 11. Auflage, Wissenschaftliche Verlagsgesellschaft Stuttgart
Abbildung
Created with BioRender.com













