Ticagrelor
Der Wirkstoff Ticagrelor gehört zur Gruppe der Thrombozytenaggregationshemmer und wird üblicherweise mit Acetylsalicylsäure kombiniert um atherothrombotischen Ereignissen wie einem Herzinfarkt präventiv entgegenzuwirken.
Ticagrelor: Übersicht
Anwendung
Ticagrelor findet Anwendung im Bereich der Prävention von atherothrombotischen Ereignissen bei Erwachsenen mit akutem Koronarsyndrom (ACS) oder bereits erlittenem Myokardinfarkt (MI) und erhöhtem Risiko für atherothrombotische Ereignisse. Eine Kombination mit niedrig dosierter Acetylsalicylsäure (ASS), ebenfalls der Gruppe der Thrombozytenaggregationshemmer (TAH) zugehörig, wird empfohlen, sofern keine Kontraindikationen vorliegen.
Vorzeitiger Abbruch
Der vorzeitige Abbruch einer thrombozytenhemmenden Therapie, einschließlich Ticagrelor, könnte zu einem erhöhten Risiko für kardiovaskulären (CV) Tod, MI oder Schlaganfall aufgrund der zugrundeliegenden Erkrankung des Patienten führen. Daher sollte eine vorzeitige Beendigung der Therapie vermieden werden.
Anwendungsart
Ticagrelor ist als Film- und Schmelztablette (Brilique) auf dem Markt erhältlich.
Eine Schmelztablette wird beispielsweise für Patienten mit Schluckbeschwerden bevorzugt. Die Schmelztablette sollte auf die Zunge gelegt werden, wo sie sich schnell im Speichel auflöst.
Die Einnahme erfolgt nahrungsunabhängig.
Wirkmechanismus
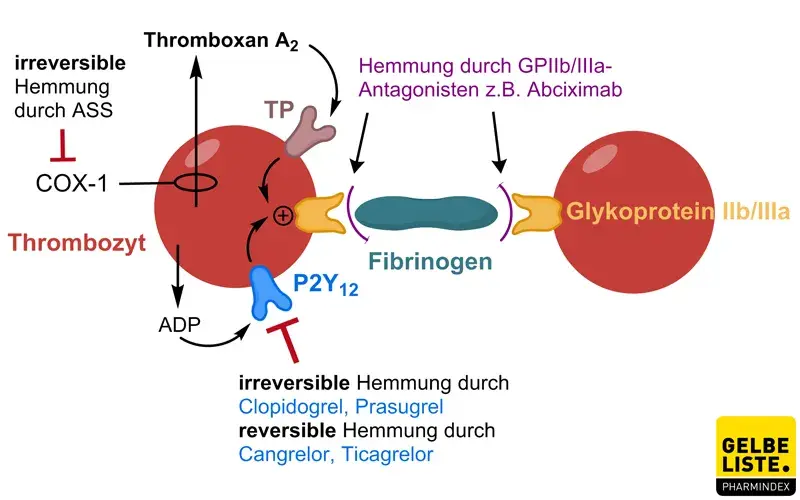
Ticagrelor ist ein selektiver, direkt wirkender und reversibler P2Y12-Rezeptorantagonist. Der natürliche Ligand des P2Y12-Rezeptors, Adenosindiphosphat (ADP), vermittelt über diesen die Thrombozytenaktivierung und folglich die Thrombozytenaggregation. Der Antagonismus durch Ticagrelor bewirkt demnach eine Thrombozytenaggregationshemmung. Ticagrelor verhindert allerdings nicht die Bindung von ADP an den P2Y12-Rezeptor, sondern blockiert in gebundener Form die ADP-induzierte Signalübertragung.
Ticagrelor unterscheidet sich pharmakologisch von anderen P2Y12-Rezeptorantagonisten, denn ältere Vertreter der Wirkstoffklasse wie Clopidogrel oder Prasugrel inhibieren den Rezeptor irreversibel. Eine Hemmung des equilibrativen Nukleosid-Transporters-1 (ENT-1) durch Ticagrelor erhöht zusätzlich lokale endogene Adenosin-Spiegel.
Pharmakokinetik
Die Pharmakokinetik von Ticagrelor ist linear, sodass die Konzentration von Ticagrelor und dessen aktivem Metabolit nahezu proportional zur Dosis ist (bis 1260 mg).
Resorption
Ticagrelor wird rasch resorbiert und erreicht nach circa 1,5 Stunden sein Konzentrationsmaximum (tmax). Der ebenfalls wirksame Hauptmetabolit (AR-C124910XX) wird schnell gebildet (mediane tmax 2,5 Stunden). Die maximale Konzentration (cmax) nach oraler, nüchterner Einnahme von 90 mg Ticagrelor beträgt 529 ng/ml und die AUC 3451 ng*h/ml. Das Verhältnis von Ticagrelor und Hauptmetabolit bezogen auf cmax beträgt 0,28. Die Pharmakokinetik von Ticagrelor und Hauptmetabolit unterscheidet sich bei Patienten mit ACS und Patienten mit MI in der Vorgeschichte nicht wesentlich und wird im Allgemeinen als vergleichbar eingestuft.
Die mittlere absolute Bioverfügbarkeit von Ticagrelor beträgt schätzungsweise 36%, wobei fettreiche Nahrung die AUC um etwa 21% steigert (Food-Effekt). Allerdings führen fettreiche Mahlzeiten zu einer Abnahme der maximalen Konzentration des aktiven Metaboliten um etwa 22%, nicht jedoch bei Ticagrelor selbst. Die klinische Relevanz dieses Food-Effekts wird als minimal bewertet, weshalb keine Abhängigkeit von Mahlzeiten zu erwarten ist.
Die Gabe einer zerstoßenen und in Wasser gegebenen Tablette oral oder über eine transnasale Magen-Sonde weist eine ähnliche Bioverfügbarkeit wie eine ganze, unveränderte Tablette auf.
Verteilung (Distribution)
Im Steady state beträgt das Verteilungsvolumen von Ticagrelor 87,6 L. Ticagrelor und sein aktiver Metabolit sind zu mehr als 99,0% an Plasmaproteine gebunden.
Metabolismus (Biotransformation)
Das Enzym CYP3A4 ist hauptsächlich für die Metabolisierung von Ticagrelor verantwortlich, weshalb Wechselwirkungen mit anderen CYP3A4-Substraten in Betracht gezogen werden sollten.
Der Hauptmetabolit AR-C124910XX von Ticagrelor ist ebenfalls aktiv. Dies wurde in in vitro Bindungsstudien am P2Y12-ADP-Rezeptor nachgewiesen.
Elimination
Ticagrelor wird hauptsächlich hepatisch eliminiert. Die angenommene primäre Elimination des aktiven Metaboliten ist die biliäre Sekretion. Die Halbwertszeit von Ticagrelor liegt bei etwa 7 Stunden, wohingegen die des aktiven Metaboliten etwa 8,5 Stunden beträgt.
Besondere Patientengruppen
Patienten ≥ 75 Jahre mit ACS wiesen im Vergleich zu jüngeren Patienten eine höhere Plasmakonzentration Ticagrelor bzw. aktiver Metabolit auf (circa 25% bezogen auf cmax und AUC), was klinisch aber nicht als signifikant einzustufen ist.
Eine höhere Konzentration Ticagrelor bzw. aktiver Metabolit wurde bei Frauen im Vergleich zu Männern beobachtet, allerdings klinisch ohne Signifikanz.
Bei Kindern und Jugendlichen wurde der Wirkstoff nicht untersucht.
Patienten mit eingeschränkter Nierenfunktion (Kreatinin-Clearance < 30 ml/min) weisen eine ungefähr 20% geringere Plasmakonzentration Ticagrelor als Patienten mit normaler Nierenfunktion auf. Die Konzentration des aktiven Metaboliten ist jedoch um ungefähr 17% erhöht.
Die thrombozytenaggregationshemmende Wirkung (inhibiton of platelet aggregation, IPA) von Ticagrelor ist unabhängig von der Dialyse von Patienten mit Nierenerkrankung im Endstadium und ähnlich wie bei Patienten mit normaler Nierenfunktion.
Bei eingeschränkter Leberfunktion ist der IPA-Effekt nahezu identisch im Vergleich zu gesunden Patienten. Eine geringfügig eingeschränkte Leberfunktion erfordert keine Dosisanpassung. Patienten mit schwerer Leberfunktionsstörung wurden nicht untersucht.
Asiaten haben eine um 39% höhere mittlere Bioverfügbarkeit als kaukasische Patienten. Patienten, die sich selbst als dunkelhäutig einstufen, haben wiederum eine um 18% geringere Bioverfügbarkeit als kaukasische Patienten.
Dosierung
Die Einnahme von Ticagrelor erfordert parallel die Einnahme einer täglichen ASS-Erhaltungsdosis von 75-150 mg, sofern keine Kontraindikation vorliegt. Basierend auf der in der klinischen Studie PLATO beobachteten Beziehung zwischen der ASS-Erhaltungsdosis und der relativen Wirksamkeit von Ticagrelor im Vergleich zu Clopidogrel, wird eine gleichzeitige Anwendung hoher ASS-Erhaltungsdosen (>300 mg) nicht empfohlen.
Bei Patienten mit akutem Koronarsyndrom (ACS) sollte mit einer einmaligen Initialdosis von 180 mg (2 x 90 mg Tablette) begonnen und anschließend mit 90 mg 2x täglich fortgesetzt werden. Eine Behandlungsdauer von 12 Monaten wird empfohlen, sofern kein Abbruch indiziert ist.
Bei Patienten mit einem mindestens ein Jahr zurückliegenden Myokardinfarkt (MI) und einem erhöhten atherothrombotischen Risiko beträgt die empfohlene Dosis 60 mg 2x täglich als Anschlussbehandlung.
Ein Auslassen der Dosis sollte vermieden werden. Bei Versäumnis sollte nur eine Tablette (die nächste Dosis) zur vorgesehenen Zeit eingenommen werden.
Bei älteren Patienten, Patienten mit eingeschränkter Nierenfunktion und Patienten mit leichter Leberfunktionsstörung ist keine Dosisanpassung erforderlich.
Nebenwirkungen
Die am häufigsten gemeldeten Nebenwirkungen waren Blutungen, was mit dem pharmakologischen Wirkmechanismus einhergeht sowie Dyspnoe (Atemnot) und Hyperurikämie. Aufgrund der erhöhten Blutungsneigung kann es zu schwerwiegenden, lebensbedrohlichen Blutungen (z.B. intrakranielle Blutungen) kommen. Ein Antidot für Ticagrelor ist bisher nicht auf dem Markt, wird aber erforscht (NCT04122170).
Das Sicherheitsprofil von Ticagrelor wurde in zwei großen Phase-III-Outcome-Studien (PLATO und PEGASUS) mit mehr als 39.000 Patienten evaluiert. In PLATO kam es bei den Ticagrelor-Patienten zu einer höheren Abbruchrate aufgrund von unerwünschten Ereignissen als bei den Clopidogrel-Patienten (7,4% versus 5,4%). In PEGASUS kam es bei den Ticagrelor-Patienten zu einer höheren Abbruchrate aufgrund von unerwünschten Ereignissen als bei den Patienten, die die ASS-Monotherapie erhielten (16,1% unter Ticagrelor 60 mg mit ASS versus 8,5 % unter ASS-Monotherapie).
Wechselwirkungen
Ticagrelor ist ein CYP3A4-Substrat und ein schwacher CYP3A4-Inhibitor. Zusätzlich ist Ticagrelor Substrat und schwacher Inhibitor von P-Glykoprotein (P-gp). Daraus ergeben sich einige potenzielle Wechselwirkungen
CYP3A4
-
CYP3A4-Inhibitoren (z.B. Ketoconazol oder Diltiazem) erhöhen die Plasmakonzentration von Ticagrelor. Die gleichzeitige Einnahme von Ketoconazol (Antimykotikum) und Ticagrelor erhöht beispielsweise cmax von Ticagrelor um das 2,4-fache und die AUC um das 7,3-fache. Unter paralleler Einnahme mit dem Calciumantagonisten Diltiazem erhöht sich cmax von Ticagrelor um 69% und die AUC um das 2,7-fache. Daher ist die gleichzeitige Gabe von starken CYP3A4-Inhibitoren kontraindiziert.
Die tägliche Einnahme von großen Mengen Grapefruitsaft (3 x 200 ml) verdoppelt die Ticagrelor-Konzentration, was jedoch keine klinische Relevanz erwarten lässt. - CYP3A4-Induktoren (z.B. Rifampicin und Carbamazepin) verringern die Plasmakonzentration von Ticagrelor. Die gleichzeitige Anwendung des Antituberkulotikums Rifampicin verringert beispielsweise die cmax und die AUC von Ticagrelor um 73% bzw. 86%. Aus diesem Grund wird von einer gleichzeitigen Gabe von CYP3A4-Induktoren abgeraten.
P-gp
- Das Immunsuppressivum Ciclosporin (600 mg), sowohl P-gp- als auch CYP3A4-Inhibitor, erhöht die cmax und AUC von Ticagrelor um das 2,3- bzw. 2,8-fache. Der aktive Metabolit von Ticagrelor zeigt eine um 32% erhöhte AUC, allerdings eine um 15% verringerte cmax.
Morphin
- Morphin verzögert und verringert die Konzentration oraler P2Y12-Inhibitoren, einschließlich Ticagrelor und aktivem Metabolit, bei ACS Patienten um etwa 35%. Dies beruht vermutlich auf verminderter Magen-Darm-Motilität und könnte demnach auch weitere Opioide betreffen. Eventuell ist die parenterale Gabe von P2Y12-Inhibitoren in Betracht zu ziehen.
Einfluss von Ticagrelor auf andere Arzneimittel
- CYP3A4-Substrate wie einige Statine, darunter Simvastatin, können eine veränderte Pharmakokinetik bei gleichzeitiger Gabe von Ticagrelor aufweisen (Simvastatin cmax + 81%, AUC + 52%). Dementsprechend wird von einer gleichzeitigen Einnahme mit höher dosierten Statinen (z.B. Simvastatin 40 mg) abgeraten, um das Risiko für unerwünschte Arzneimittelwirkungen – in diesem Fall vor allem Myopathien – zu minimieren.
- Das P-gp-Substrat Digoxin weist erhöhte Plasmaspiegel bei gleichzeitiger Anwendung von Ticagrelor auf (Digoxin cmax + 75%, AUC + 28%). Die Pharmakokinetik von Ticagrelor und aktivem Metabolit ist dabei weitestgehend unverändert. Aufgrund der geringen therapeutische Breite von Digitalisglykosiden wird in jedem Fall ein angemessenes Therapeutisches Drug Monitoring (TDM) empfohlen.
- Das P-gp Substrat Ciclosporin zeigt keine veränderten Blutspiegel bei gleichzeitiger Einnahme von Ticagrelor.
- Bei CYP2C9-Substraten wie Warfarin oder Tolbutamid sind pharmakokinetische Veränderungen unwahrscheinlich (Ticagrelor ist kein CYP2C9-Inhibitor).
- Orale Kontrazeptiva zeigen teilweise pharmakokinetische Veränderungen. Die Konzentration von Ethinylestradiol steigt um etwa 20%, während die Pharmakokinetik von Levonorgestrel unverändert bleibt.
- Bei Bradykardie-auslösenden Arzneimitteln wie Betablockern ist Vorsicht geboten. Die gleichzeitige Einnahme von Ticagrelor zeigt allerdings keine Hinweise auf klinisch signifikante Nebenwirkungen.
- Die Kombination mit SSRI (z.B. Citalopram oder Sertralin) kann das Blutungsrisiko erhöhen. Demnach ist auch hier Vorsicht geboten.
Kontraindikation
Ticagrelor darf nicht angewendet werden bei:
- Überempflindlichkeit gegen den Wirkstoff oder sonstige Bestandteile der Formulierung
- Aktiver pathologischer Blutung
- Intrakranieller Blutung in der Vorgeschichte
- Schwerer Leberfunktionsstörung
- Gleichzeitiger Einnahme von CYP3A4-Inhibitoren (z.B. Clarithromycin, Ketoconazol, Ritonavir)
Schwangerschaft
Es gibt keine bzw. nur begrenzte Daten zur Anwendung von Ticagrelor bei Schwangeren. In Tierstudien zeigte sich Reproduktionstoxizität, weshalb eine Anwendung von Ticagrelor während der Schwangerschaft nicht empfohlen wird.
Stillzeit
Versuche bei Tieren haben gezeigt, dass Ticagrelor und seine aktiven Metaboliten in die Muttermilch übergehen. Demnach kann ein Risiko für Neugeborene oder Säuglinge nicht ausgeschlossen werden, weshalb eine Entscheidung darüber getroffen werden muss, ob abgestillt oder die Behandlung mit Ticagrelor abgesetzt oder nicht durchgeführt werden soll. Dabei muss der Nutzen des Stillens für das Kind und der Nutzen der Behandlung für die Mutter berücksichtigt werden.
Verkehrstüchtigkeit
Der Einfluss von Ticagrelor auf die Verkehrstüchtigkeit ist zu vernachlässigen. Teilweise wurde von Patienten über Schwindel und Verwirrtheit berichtet, weshalb bei diesen Symptomen Vorsicht geboten ist bzw. das Führen von Fahrzeugen vermieden werden sollte.
Anwendungshinweise
Blutungsrisiko
Bei Patienten, bei denen ein erhöhtes Blutungsrisiko bekannt ist, muss eine Nutzen-Risiko-Abwägung von Ticagrelor im Hinblick auf die Prävention atherothrombotischer Ereignisse erstellt werden.
Dies gilt vor allem für:
- Patienten mit Blutungsneigung (z.B. aufgrund eines kürzlich zurückliegenden Traumas, einer kürzlich durchgeführten Operation, Blutgerinnungsstörungen, einer aktiven oder vor Kurzem aufgetretenen gastrointestinalen Blutung) oder mit erhöhtem Traumarisiko.
- Patienten, die innerhalb von 24 Stunden nach der Anwendung von Ticagrelor gleichzeitig Arzneimittel erhalten, die das Blutungsrisiko erhöhen können (z.B. nichtsteroidale antiinflammatorische Arzneimittel (NSAR), orale Antikoagulanzien und/oder Fibrinolytika).
Thrombozytentransfusionen konnten bei gesunden Probanden den thrombozytenfunktionshemmenden Effekt von Ticagrelor nicht aufheben und es ist unwahrscheinlich, dass diese von klinischem Nutzen bei Patienten mit Blutungen sind. Da die Blutungszeit durch die gleichzeitige Anwendung von Ticagrelor und Desmopressin nicht reduziert wurde, ist es unwahrscheinlich, dass klinische Blutungsereignisse mit Desmopressin wirksam behandelt werden können.
Eine antifibrinolytische Therapie (Aminocapronsäure oder Tranexamsäure) und/oder die Behandlung mit rekombinantem Faktor VIIa können die Hämostase erhöhen. Die Anwendung von Ticagrelor kann wiederaufgenommen werden, wenn die Ursache der Blutung festgestellt und unter Kontrolle gebracht wurde.
Operation
Patienten sollten darauf hingewiesen werden, den Arzt oder Zahnarzt vor jeder geplanten Operation und bevor ein neues Arzneimittel eingenommen wird, über die Einnahme von Ticagrelor zu informieren.
Patienten mit vorangegangenem ischämischem Schlaganfall
ACS-Patienten mit einem vorangegangenen ischämischen Schlaganfall können bis zu 12 Monate lang mit Ticagrelor behandelt werden (PLATO-Studie).
In PEGASUS waren Patienten mit MI in der Vorgeschichte mit vorangegangenem ischämischem Schlaganfall nicht eingeschlossen. Aufgrund fehlender Daten wird daher bei diesen Patienten eine Behandlung über ein Jahr hinaus nicht empfohlen.
Eingeschränke Leberfunktion
Die Anwendung von Ticagrelor ist bei Patienten mit schwerer Leberfunktionsstörung kontraindiziert. Die Erfahrungen mit Ticagrelor bei Patienten mit mäßiger Leberfunktionsstörung sind begrenzt, deshalb ist bei diesem Patientenkollektiv Vorsicht geboten.
Patienten mit einem Risiko für bradykarde Ereignisse
Die Überwachung mittels Holter-EKG hat während der Behandlung mit Ticagrelor, verglichen mit Clopidogrel, eine erhöhte Häufigkeit von meist asymptomatischen ventrikulären Pausen gezeigt. Patienten mit einem erhöhten Risiko für bradykarde Ereignisse (z.B. Patienten ohne Herzschrittmacher, die Sinusknotensyndrom, AV-Block II. oder III. Grades oder bradykardiebedingte Synkopen aufweisen) wurden von den Hauptstudien ausgeschlossen, in denen die Sicherheit und Wirksamkeit von Ticagrelor bewertet wurden. Daher sollte Ticagrelor aufgrund der begrenzten klinischen Erfahrung bei diesen Patienten mit Vorsicht angewendet werden.
Zusätzlich sollte die gleichzeitige Anwendung von Ticagrelor mit Arzneimitteln, die bekanntermaßen eine Bradykardie auslösen, mit Vorsicht erfolgen. Allerdings wurden in der PLATO-Studie nach gleichzeitiger Anwendung von einem oder mehreren Arzneimitteln, die bekanntermaßen eine Bradykardie auslösen (z.B. 96% Betablocker, 33% Calciumkanalblocker Diltiazem und Verapamil und 4% Digoxin), keine Hinweise auf klinisch signifikante unerwünschte Wechselwirkungen beobachtet.
Dyspnoe (Atemnot)
Von Atemnot wurde bei Patienten, die mit Ticagrelor behandelt wurden, berichtet. Die Dyspnoe ist üblicherweise von leichter bis mittelschwerer Intensität und geht oft zurück, ohne dass ein Absetzen der Therapie erforderlich ist. Patienten mit Asthma oder chronisch obstruktiver Lungenerkrankung (chronic obstructive pulmonary disease, COPD) haben unter Ticagrelor möglicherweise ein erhöhtes absolutes Risiko, eine Dyspnoe zu erleiden.
Die Einnahme von Ticagrelor sollte bei Patienten mit Asthma und/oder COPD in der Vorgeschichte mit Vorsicht angewendet werden. Der zugrundeliegende Mechanismus wurde noch nicht geklärt. Sollte ein Patient über eine neu aufgetretene Dyspnoe oder eine Verlängerung bzw. Verschlechterung einer bestehenden Dyspnoe berichten, wird eine vollständige Abklärung empfohlen. Wenn die Behandlung mit Ticagrelor nicht toleriert wird, sollte sie beendet werden.
Kreatinin-Erhöhungen
Die Kreatinin-Werte können während der Behandlung mit Ticagrelor ansteigen. Der zugrundeliegende Mechanismus ist noch nicht geklärt. Deshalb sollte die Nierenfunktion gemäß der medizinischen Routine überprüft werden. Bei ACS-Patienten wird einen Monat nach Beginn der Ticagrelor-Behandlung außerdem eine Kontrolle der Nierenfunktion empfohlen, mit besonderer Aufmerksamkeit bei Patienten ≥ 75 Jahre, Patienten mit mäßigen/schweren Nierenfunktionsstörungen und denjenigen, die gleichzeitig mit einem Angiotensin-II-Rezeptorblocker (ARB) behandelt werden.
Harnsäure-Erhöhungen
Hyperurikämie kann während der Behandlung mit Ticagrelor auftreten.
Bei Patienten mit Hyperurikämie oder arthritischer Gicht in der Vorgeschichte ist Vorsicht geboten. Als Vorsichtsmaßnahme wird von der Anwendung von Ticagrelor bei Patienten mit Harnsäure-Nephropathie abgeraten.
Thrombotisch-thrombozytopenische Purpura (TTP)
Thrombotisch-thrombozytopenische Purpura (TTP) wurde sehr selten unter Anwendung von Ticagrelor berichtet. Anzeichen hierfür sind Thrombozytopenie und mikroangiopathische hämolytische Anämie, die entweder mit neurologischen Symptomen, Nierenfunktionsstörungen oder Fieber einhergehen. Eine TTP kann potenziell letal verlaufen und erfordert daher eine sofortige Behandlung einschließlich Plasmapherese.
Beeinflussung von Plättchen-Funktionstests zur Diagnose Heparin-induzierter Thrombozytopenien (HIT)
Bei Patienten, die Ticagrelor eingenommen hatten, wurden falsch negative Ergebnisse für HIT mittels eines Plättchen-Funktionstests (einschließlich, aber möglicherweise nicht beschränkt auf den HIPA-Test) berichtet. Dies hängt mit der Hemmung des P2Y12-Rezeptors auf den gesunden Spenderplättchen im Test durch Ticagrelor im Serum/Plasma des Patienten zusammen.
Alternativen
Zur Risikoreduktion atherothrombotische Ereignisse können auch folgende Medikamente eingesetzt werden:
- Andere P2Y12-Rezeptorantagonisten wie Clopidogrel oder Prasugrel
- Glykoprotein-IIb/IIIa-Rezeptorantagonisten wie Tirofiban
- Vitamin-K-Antagonisten wie Phenprocoumon
- Direkte orale Antikoagulanzien (DOAKs) wie Rivaroxaban (Faktor Xa Inhibitor) oder Dabigatran (Faktor IIa/Thrombin Inhibitor)
- Heparin(e)
Weitere Informationen sind der jeweiligen Fachinformation zu entnehmen.
Wirkstoff-Informationen
-
Brilique 60 mg Eurim Filmtabletten
Eurim-Pharm Arzneimittel GmbH
-
Brilique® 60 mg Filmtabletten
AstraZeneca GmbH
-
Brilique 60 mg kohlpharma Filmtabletten
kohlpharma GmbH
-
Brilique® 90 mg Filmtabletten
AstraZeneca GmbH
-
Brilique® 90 mg Schmelztabletten
AstraZeneca GmbH
-
Ticabril® 60 mg Filmtabletten
TAD Pharma GmbH
-
Ticabril® 90 mg Filmtabletten
TAD Pharma GmbH
-
Ticagrelor - 1 A Pharma® 60 mg Filmtabletten
1 A Pharma GmbH
-
Ticagrelor - 1 A Pharma® 90 mg Filmtabletten
1 A Pharma GmbH
-
Ticagrelor 089PHARM 60 mg Filmtabletten
089PHARM GmbH
-
Ticagrelor 089PHARM 90 mg Filmtabletten
089PHARM GmbH
-
Ticagrelor 123-Acurae Pharma 60 mg Filmtabletten
123 Acurae Pharma GmbH
-
Ticagrelor 123-Acurae Pharma 90 mg Filmtabletten
123 Acurae Pharma GmbH
-
Ticagrelor Abdi 60 mg Filmtabletten
Abdi Farma GmbH
-
Ticagrelor Abdi 90 mg Filmtabletten
Abdi Farma GmbH
-
Ticagrelor AL 60 mg Filmtabletten
ALIUD PHARMA® GmbH
-
Ticagrelor AL 90 mg Filmtabletten
ALIUD PHARMA® GmbH
-
Ticagrelor Amarox 60 mg Filmtabletten
Amarox Pharma GmbH
-
Ticagrelor Amarox 90 mg Filmtabletten
Amarox Pharma GmbH
-
Ticagrelor Ascend 60 mg Filmtabletten
Ascend GmbH
-
Ticagrelor Ascend 90 mg Filmtabletten
Ascend GmbH
-
Ticagrelor AXiromed 60 mg Filmtabletten
Medical Valley Invest AB
-
Ticagrelor AXiromed 90 mg Filmtabletten
Medical Valley Invest AB
-
Ticagrelor Basics 60 mg Filmtabletten
Basics GmbH
-
Ticagrelor Basics 90 mg Filmtabletten
Basics GmbH
-
Ticagrelor beta 60 mg Filmtabletten
betapharm Arzneimittel GmbH
-
Ticagrelor beta 90 mg Filmtabletten
betapharm Arzneimittel GmbH
-
Ticagrelor ELPEN 60 mg Filmtabletten
ELPEN Pharmaceutical Co. Inc.
-
Ticagrelor ELPEN 90 mg Filmtabletten
ELPEN Pharmaceutical Co. Inc.
-
Ticagrelor Heumann 60 mg Filmtabletten
Heumann Pharma GmbH & Co. Generica KG
-
Ticagrelor Heumann 90 mg Filmtabletten
Heumann Pharma GmbH & Co. Generica KG
-
Ticagrelor Holsten 60 mg Filmtabletten
Holsten Pharma GmbH
-
Ticagrelor Holsten 90 mg Filmtabletten
Holsten Pharma GmbH
-
Ticagrelor Juta 60 mg Filmtabletten
Juta Pharma GmbH
-
Ticagrelor Juta 90 mg Filmtabletten
Juta Pharma GmbH
-
Ticagrelor Macleods 60 mg Filmtabletten
Macleods Pharma Espana S.L.U.
-
Ticagrelor Macleods 90 mg Filmtabletten
Macleods Pharma Espana S.L.U.
-
Ticagrelor Micro Labs 60 mg Filmtabletten
Micro Labs GmbH
-
Ticagrelor Micro Labs 90 mg Filmtabletten
Micro Labs GmbH
-
Ticagrelor-ratiopharm® 60 mg Filmtabletten
ratiopharm GmbH
-
Ticagrelor-ratiopharm® 90 mg Filmtabletten
ratiopharm GmbH
-
Ticagrelor STADA® 60 mg Filmtabletten
STADAPHARM GmbH
-
Ticagrelor STADA® 90 mg Filmtabletten
STADAPHARM GmbH
-
Ticagrelor Viatris 60 mg Filmtabletten
Viatris Healthcare GmbH
-
Ticagrelor Viatris 90 mg Filmtabletten
Viatris Healthcare GmbH
-
Ticagrelor Vivanta 60 mg Filmtabletten
Vivanta Generics s.r.o
-
Ticagrelor Vivanta 90 mg Filmtabletten
Vivanta Generics s.r.o
-
Ticagrelor Zentiva 60 mg Filmtabletten
Zentiva Pharma GmbH
-
Ticagrelor Zentiva 90 mg Filmtabletten
Zentiva Pharma GmbH













