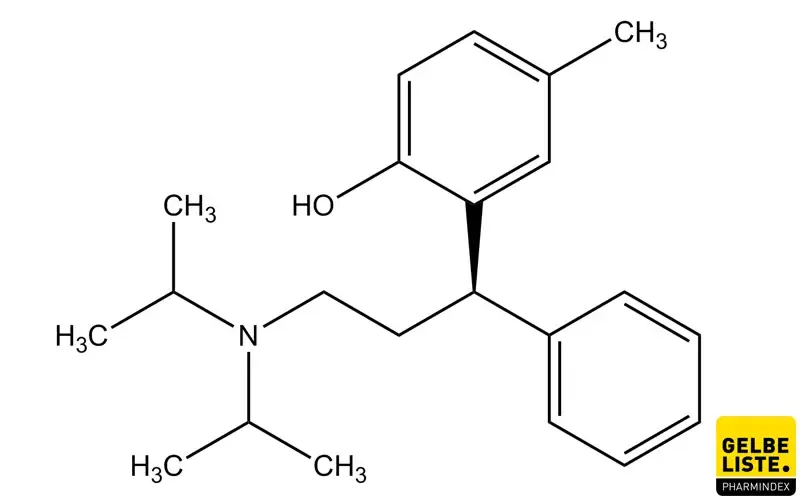
Tolterodin
Tolterodin ist ein anticholinerger Wirkstoff aus der Gruppe der Muskarinrezeptor-Antagonisten (Parasympatholytika), der zur symptomatischen Behandlung einer überaktiven Blase (overactive bladder, OAB) eingesetzt wird.
Tolterodin: Übersicht
Anwendung
Der anticholinerge Wirkstoff Tolterodin ist indiziert zur symptomatischen Behandlung der Dranginkontinenz und/oder der Pollakisurie und des imperativen Harndrangs (wie sie bei erwachsenen Patienten mit dem Syndrom der überaktiven Harnblase auftreten können).
Anwendungsart
Tolterodin ist in den Darreichungsformen Filmtablette (1 und 2 mg) und Retardkapsel (4 mg) erhältlich. Die Einnahme kann unabhängig von den Mahlzeiten mit etwas Flüssigkeit erfolgen. Die Retardkapseln müssen im Ganzen geschluckt und dürfen nicht zerkaut werden.
Wirkmechanismus
Tolterodin wird durch CYP2D6 zum pharmakologisch äquipotenten Metaboliten 5-Hydroxymethyl-Tolterodin (5-HMT bzw. Desfesoterodin, ebenfalls pharmakologisch aktiver Metabolit von Fesoterodin) metabolisiert. Beide Substanzen (Tolterodin und 5-HMT) sind kompetitive und spezifische Muskarinrezeptor-Antagonisten, deren pharmakologische Wirkung primär durch Inhibition des muskarinischen M3-Rezeptors vermittelt wird.
Die Harnblase, die bei Überaktivität Symptome wie Dranginkontinenz und/oder Pollakisurie (häufiges Wasserlassen, meist in kleinen Mengen) verursachen kann, wird von parasympathischen, cholinergen Nerven innerviert. Dabei löst Acetylcholin (ACh) vor allem über den muskarinischen M3-Rezeptor eine Kontraktion der glatten Muskulatur des M. detrusor aus. Folglich wirkt die Hemmung dieses Rezeptorsubtyps durch Tolterodin spasmolytisch auf die Harnblase, weshalb der Wirkstoff auch den (urologischen) Spasmolytika zugeordnet werden kann.
Pharmakokinetik
Darreichungsformspezifische Pharmakokinetik
- Die Resorption von Tolterodin aus den Retardkapseln erfolgt langsamer als aus schnell freisetzenden Filmtabletten, weshalb die maximalen Serumkonzentrationen etwa 4 (2 bis 6) Stunden nach Einnahme beobachtet werden (1 bis 3 Stunden nach Einnahme der Filmtabletten).
- Die Halbwertszeit von Tolterodin liegt nach der Einnahme der Retardkapseln bei schnellen Metabolisierern bei 6 Stunden (bei 2-3 Stunden nach Einnahme der Filmtabletten), bei langsamen Metabolisierern (CYP2D6-Mangel) bei 10 Stunden.
- Steady-State-Konzentrationen werden innerhalb von 4 Tagen nach Einnahme der Retardkapseln erreicht (nach Einnahme der Filmtabletten innerhalb von 2 Tagen). Gleichzeitige Nahrungsaufnahme hat keinen Einfluss auf die Bioverfügbarkeit der Retardkapseln.
Resorption
- Nach der Einnahme unterliegt Tolterodin einem durch CYP2D6 katalysierten First-Pass-Metabolismus in der Leber, was zur Bildung des pharmakologisch äquipotenten Hauptmetaboliten 5-Hydroxymethyl-Tolterodin (Desfesoterodin) führt.
- Die absolute Bioverfügbarkeit von Tolterodin beträgt bei schnellen bzw. extensiven Metabolisierern (Mehrheit der Patienten) 17% und bei langsamen Metabolisierern (ohne CYP2D6) 65%.
Verteilung
- Tolterodin und der Metabolit 5-Hydroxymethyl-Tolterodin binden primär an Orosomukoid.
- Der ungebundene Anteil beträgt 3,7% bzw. 36%.
- Das Verteilungsvolumen von Tolterodin beträgt 113 L.
Metabolismus
- Tolterodin wird nach oraler Einnahme überwiegend in der Leber metabolisiert.
- Der primäre Metabolismus wird durch das polymorphe Enzym CYP2D6 vermittelt und führt zur Bildung des 5-Hydroxymethyl-Metaboliten.
- Durch weitere Metabolisierung entstehen die 5-Carbonsäure- und N- dealkylierte 5-Carbonsäure-Metaboliten, die etwa 51% bzw. 29% der im Urin nachgewiesenen Metaboliten ausmachen.
- Ein Anteil von ca. 7% der Bevölkerung hat einen Mangel an CYP2D6-Aktivität, weshalb der Metabolismus bei diesen Personen ("langsame Metabolisierer") über CYP3A4 zu N-dealkyliertem Tolterodin verläuft, das zur klinischen Wirkung nicht beiträgt.
- Bei schnellen Metabolisierern beträgt die systemische Clearance von Tolterodin ca. 30 L/Stunde.
- Bei langsamen Metabolisierern führt die reduzierte Clearance zu signifikant höheren Serumkonzentrationen von Tolterodin (ca. 7-fach) und vernachlässigbaren Konzentrationen des 5-Hydroxymethyl-Metaboliten.
- Der 5-Hydroxymethyl-Metabolit ist pharmakologisch aktiv und mit Tolterodin äquipotent.
- Durch das unterschiedliche Proteinbindungsverhalten von Tolterodin und dem 5-Hydroxymethyl-Metaboliten sind unter gleicher Dosierung die Serumspiegel (AUC) von ungebundenem Tolterodin bei langsamen Metabolisierern den kombinierten Serumspiegeln von ungebundenem Tolterodin und dem 5-Hydroxymethyl-Metaboliten bei Patienten mit CYP2D6-Aktivität ähnlich.
- Unabhängig vom Phänotyp sind Sicherheit, Verträglichkeit und klinisches Ansprechen vergleichbar.
Elimination
- Etwa 77% der Dosis werden über den Urin und 17% über die Fäzes ausgeschieden.
- Weniger als 1% der Dosis wird als unveränderte Substanz und ca. 4% als 5-Hydroxymethyl-Metabolit eliminiert.
- Der carboxylierte Metabolit sowie der entsprechende dealkylierte Metabolit machen ca. 51% bzw. 29% der Wiederfindungsrate im Urin aus.
- Im therapeutischen Dosisbereich verläuft die Pharmakokinetik linear.
Patientenindividuelle Pharmakokinetik
- Eingeschränkte Nierenfunktion: Bei Patienten mit schwerer Nierenfunktionsstörung (Inulin-Clearance GFR ≤ 30 mL/min) ist die mittlere Serumkonzentration von ungebundenem Tolterodin und seinem 5-Hydroxymethyl-Metaboliten verdoppelt. Die Plasmaspiegel anderer Metaboliten waren bei diesen Patienten deutlich erhöht (bis zu zwölffach). Die klinische Relevanz der erhöhten Konzentrationen dieser Metaboliten ist nicht bekannt (es liegen keine Daten für leichte bis mäßige Nierenfunktionsstörungen vor).
- Eingeschränkte Leberfunktion: Bei Patienten mit Leberzirrhose findet man eine ca. zweifach höhere Konzentration an ungebundenem Tolterodin und dem 5-Hydroxymethyl-Metaboliten.
- Kinder und Jugendliche: Bei Erwachsenen und Jugendlichen sind die Serumkonzentrationen des Wirkstoffs ähnlich hoch. Bei Kindern im Alter von 5 bis 10 Jahren sind die durchschnittlichen Serumkonzentrationen ungefähr zweimal so hoch wie bei Erwachsenen (die Wirksamkeit bei Kindern wurde nicht nachgewiesen, weshalb die Anwendung von Tolterodin bei Kindern nicht empfohlen wird).
Dosierung
- Empfohlene Tagesdosis: 1x täglich 4 mg (1 Retardkapsel) oder 2x täglich 2 mg (2 Filmtabletten)
- Patienten mit eingeschränkter Leberfunktion oder stark eingeschränkter Nierenfunktion (GFR ≤ 30 mL/min) oder beeinträchtigenden Nebenwirkungen: 1x täglich 2 mg oder 2x täglich 1 mg
- Der Behandlungserfolg sollte nach 2-3 Monaten überprüft werden.
Nebenwirkungen
Aufgrund des pharmakologischen Wirkmechanismus kann Tolterodin anticholinerge Nebenwirkungen verursachen, die im Allgemeinen dosisabhängig sind.
Die am häufigsten gemeldeten (anticholinergen) Nebenwirkungen von Tolterodin (Filmtabletten) waren Mundtrockenheit (Häufigkeit 35% in der Tolterodin-Gruppe im Vergleich zu 10% in der Placebo-Gruppe) und Kopfschmerzen (Häufigkeit 10,1% in der Tolterodin-Gruppe im Vergleich zu 7,8% in der Placebo-Gruppe).
Weitere häufige Nebenwirkungen umfassen:
- Bronchitis
- Schwindel(gefühl)
- Schläfrigkeit und Müdigkeit
- Trockene Augen und Haut
- Sehstörungen einschließlich Akkomodationsstörungen
- Bauchschmerzen
- Übelkeit und Erbrechen
- Dyspepsie
- Obstipation
- Diarrhö
- Dysurie
- Harnverhalt
- Palpitationen
- Thoraxschmerzen
- Peripheres Ödem
- Gewichtszunahme
Wechselwirkungen
Pharmakodynamische Wechselwirkungen
- Die gleichzeitige Applikation anderer Wirkstoffe mit anticholinergen Eigenschaften kann sowohl die therapeutischen Effekte als auch die (anticholinergen) Nebenwirkungen verstärken.
- Die therapeutische Wirkung von Tolterodin kann durch die gleichzeitige Gabe cholinerger Rezeptoragonisten vermindert werden.
- Tolterodin kann die Wirkung von Arzneimitteln vermindern, die die Motilität des Gastrointestinaltrakts anregen (Prokinetika wie z.B. Metoclopramid).
Pharmakokinetische Wechselwirkungen
- CYP3A4-Inhibitoren: Eine gleichzeitige systemische Anwendung von potenten CYP3A4-Inhibitoren wie Makrolidantibiotika (z.B. Erythromycin und Clarithromycin), Antimykotika (z.B. Ketoconazol und Itraconazol) und Proteasehemmern wird aufgrund erhöhter Serumkonzentrationen von Tolterodin bei schlechten CYP2D6-Metabolisierern mit nachfolgendem Risiko einer Überdosierung nicht empfohlen.
- CYP2D6: Eine gleichzeitige Therapie mit Fluoxetin (potenter CYP2D6-Inhibitor) führt nicht zu klinisch signifikanten Wechselwirkungen, da Tolterodin und sein CYP2D6-abhängiger Metabolit 5-Hydroxymethyl-Tolterodin gleichermaßen wirksam sind.
- In einer klinischen Studie gab es Hinweise darauf, dass Tolterodin kein metabolischer Inhibitor von CYP2D6, 2C19, 3A4 oder 1A2 ist, weshalb ein Anstieg der Plasmaspiegel von Arzneimitteln, die über diese Isoenzymsysteme metabolisiert werden, bei einer Anwendung in Kombination mit Tolterodin nicht zu erwarten ist.
Kontraindikationen
Tolterodin ist kontraindiziert bei Patienten mit:
- Überempfindlichkeit gegen den Wirkstoff oder sonstige Bestandteile des Arzneimittels
- Harnretention
- Unbehandeltem Engwinkelglaukom
- Myasthenia gravis
- Schwerer Colitis ulcerosa
- Toxischem Megakolon
Schwangerschaft
Es liegen keine hinreichenden Daten für die Anwendung von Tolterodin bei Schwangeren vor. Tierexperimentelle Studien haben eine Reproduktionstoxizität gezeigt. Das potenzielle Risiko für den Menschen ist allerdings nicht bekannt, weshalb die Anwendung von Tolterodin während der Schwangerschaft nicht empfohlen wird.
Stillzeit
Es ist nicht bekannt, ob Tolterodin oder die entstehenden Metaboliten beim Menschen in die Muttermilch übergehen, weshalb Tolterodin während der Stillzeit nicht verwendet werden soll.
Verkehrstüchtigkeit
Da Tolterodin wie andere Anticholinergika zu verschwommenem Sehen und/oder zu Somnolenz und Müdigkeit führen kann, können die Verkehrstüchtigkeit und die Fähigkeit, Maschinen zu bedienen, eingeschränkt sein.
Anwendungshinweise
Allgemein
- Bevor eine Behandlung mit Antimuskarinika in Betracht gezogen wird, müssen organische Ursachen ausgeschlossen werden.
- Andere Ursachen für häufiges Wasserlassen (Behandlung von Herzinsuffizienz oder Nierenerkrankung) müssen vor der Behandlung mit Tolterodin abgeklärt werden.
- Falls eine Harnwegsinfektion vorliegt, müssen geeignete medizinische Maßnahmen ergriffen bzw. eine antibakterielle Therapie eingeleitet werden.
-
Tolterodin ist mit Vorsicht anzuwenden bei Patienten mit:
o Klinisch relevanten obstruktiven Harnabflussstörungen mit dem Risiko eines Harnverhalts (z.B. klinisch relevante Vergrößerung der Prostata bei benigner Prostatahyperplasie)
o Obstruktiven gastrointestinalen Störungen (z.B. Pylorusstenose)
o Risiko einer verringerten gastrointestinalen Motilität
o Autonomer Neuropathie
o Hiatushernie
o Niereninsuffizienz
o Lebererkrankung
QT-Verlängerung
- Die mehrfache Einnahme von Tolterodin mit sofortiger Freisetzung in einer Dosis von 4 mg (therapeutisch) und 8 mg (supratherapeutisch) kann zu einer Verlängerung des QTc-Intervalls führen (die klinische Relevanz dieser Befunde ist unklar und abhängig von den Risikofaktoren und Prädispositionen der einzelnen Patienten).
-
Tolterodin ist demnach mit Vorsicht anzuwenden bei Patienten mit Risikofaktoren einer QT-Verlängerung einschließlich:
o Kongenitaler oder belegter erworbener QT-Verlängerung
o Elektrolytstörungen wie Hypokaliämie, Hypomagnesiämie und Hypokalzämie
o Bradykardie
o Relevanter vorbestehender Herzkrankheit (Kardiomyopathie, Myokardischämie, Arrhythmie, dekompensierte Herzinsuffizienz)
o Gleichzeitiger Anwendung von Arzneimitteln, die bekanntermaßen das QT-Intervall verlängern einschließlich Klasse-IA-Antiarrhythmika (z.B. Chinidin, Procainamid) und Klasse-III Antiarrhythmika (z.B. Amiodaron, Sotalol) - Dies gilt insbesondere bei der Einnahme potenter CYP3A4-Inhibitoren (eine gleichzeitige Behandlung mit potenten CYP3A4-Inhibitoren ist zu vermeiden).
Alternativen
Die medikamentösen Therapiealternativen richten sich nach dem Indikationsgebiet bzw. den Symptomen und sind darüber hinaus abhängig von patientenindividuellen Faktoren wie dem Alter der Patienten, Komorbiditäten oder dem Schweregrad der Erkrankung.
OAB
- Andere Muskarinrezeptor-Antagonisten wie Oxybutynin, Propiverin. Trospium, Solifenacin, Darifenacin und Fesoterodin
- Mirabegron
- Botulinumneurotoxin A
Weitere Informationen können der jeweiligen Fachinformation entnommen werden.
- Ratiopharm: Fachinformation Tolterodin Filmtabletten
- Ratiopharm: Fachinformation Tolterodin Retardkapseln
- Freissmuth et al., Pharmakologie und Toxikologie, 2020, Springer
- Mutschler et al., Mutschler Arzneimittelwirkungen, 2019, Wissenschaftliche Verlagsgesellschaft Stuttgart
- AWMF: S2k-Leitlinie Medikamentöse Therapie der neurogenen Dysfunktion des unteren Harntraktes (NLUTD) (2022)
-
Detrusitol® 1 mg Filmtabletten
Viatris Healthcare GmbH
-
Detrusitol 2 mg ACA Müller Filmtabletten
A.C.A. Müller ADAG Pharma AG
-
Detrusitol 2 mg axicorp Filmtabletten
axicorp Pharma GmbH
-
Detrusitol 2 mg Emra Filmtabletten
Emra-Med Arzneimittel GmbH
-
Detrusitol 2 mg Eurim Filmtabletten
Eurim-Pharm Arzneimittel GmbH
-
Detrusitol® 2 mg Filmtabletten
Viatris Healthcare GmbH
-
Detrusitol 2 mg kohlpharma Filmtabletten
kohlpharma GmbH
-
Detrusitol 2 mg Orifarm Filmtabletten
Orifarm GmbH
-
Detrusitol® retard 4 mg Hartkapsel
Viatris Healthcare GmbH
-
Tolterodin - 1 A Pharma® 4 mg Hartkapseln, retardiert
1 A Pharma GmbH
-
Tolterodin AbZ 4 mg Retardkapseln
AbZ-Pharma GmbH
-
Tolterodin Aristo® 1 mg Filmtabletten
Aristo Pharma GmbH
-
Tolterodin Aristo® 2 mg Filmtabletten
Aristo Pharma GmbH
-
Tolterodin-Aristo® 4 mg Hartkapseln, retardiert
Aristo Pharma GmbH
-
Tolterodin Heumann 4 mg Hartkapseln, retardiert
Heumann Pharma GmbH & Co. Generica KG
-
Tolterodin PUREN 4 mg Hartkapseln, retardiert
PUREN Pharma GmbH & Co. KG
-
Tolterodin-ratiopharm® 1 mg Filmtabletten
ratiopharm GmbH
-
Tolterodin-ratiopharm® 2 mg Filmtabletten
ratiopharm GmbH
-
Tolterodin-ratiopharm® 4 mg Retardkapseln
ratiopharm GmbH











