Tralokinumab
Tralokinumab ist ein vollständig humaner monoklonaler IgG4-Antikörper, der spezifisch IL-13 bindet und zur Behandlung der atopischen Dermatitis/Neurodermitis angewendet wird.
Tralokinumab: Übersicht
Anwendung
Tralokinumab (Adtralza) wird angewendet zur Behandlung mittelschwerer bis schwerer atopischer Dermatitis bei Erwachsenen, die für eine systemische Therapie in Frage kommen.
Der Antikörper kann mit oder ohne topische Kortikosteroide angewendet werden. Topische Calcineurininhibitoren können angewendet werden, sollten aber nur auf die Problemzonen wie Gesicht, Hals, intertriginöse Bereiche und den Genitalbereich beschränkt bleiben.
Anwendungsart
Tralokinumab wird subkutan in den Oberschenkel oder den Bauch injiziert, außerhalb eines 5 cm großen Bereiches um den Bauchnabel. Bei Verabreichung durch eine andere Person kann die Injektion auch in den Oberarm erfolgen.
Es soll darauf geachtet werden für jede Injektion eine andere Injektionsstelle zu wählen und Tralokinumab nicht an Stellen, an denen die Haut empfindlich oder verletzt ist, oder in Narbengewebe bzw. Hämatome zu injizieren.
Wirkmechanismus
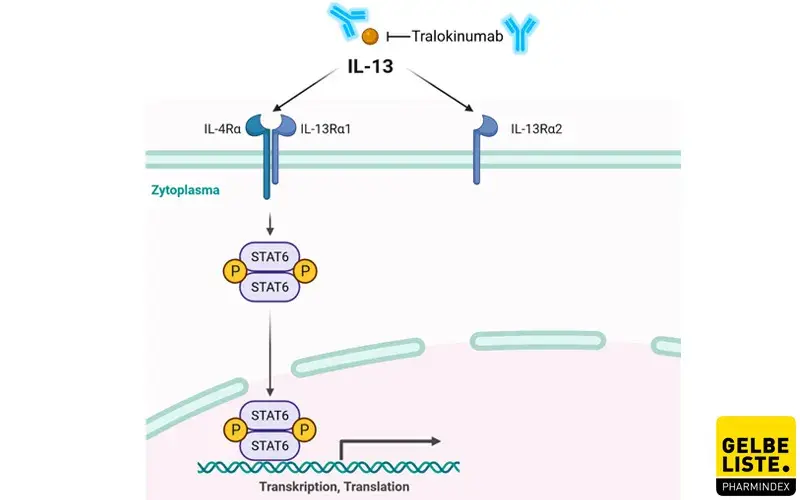
Tralokinumab ist ein vollständig humaner monoklonaler IgG4-Antikörper, der spezifisch an das Typ-2-Zytokin Interleukin-13 (IL-13) bindet und dessen Wechselwirkung mit den IL-13-Rezeptoren hemmt. IL-13 ist ein pleiotropes T-Helfer-Typ-2-Zytokin, das häufig mit Asthma und atopischer Dermatitis in Verbindung gebracht wird. Die IL-13-vermittelte Signalübertragung wird durch die Bindung an IL-13Rα1 initiiert, das dann IL-4Rα rekrutiert, um einen heterodimeren Rezeptorkomplex zu bilden. Darüber hinaus bindet IL-13 auch an IL-13Rα2.
Durch die Bindung von Tralokinumab an IL-13 wird also dessen Interaktion mit IL-13Rα1 und IL-13Rα2 verhindert, was wiederum zu einer Hemmung der IL-13-Signalgebung führt. Die IL-13-Signalgebung wird durch die Bindung an IL-13Rα1 initiiert, das dann IL-4Rα rekrutiert, einen heterodimeren Rezeptorkomplex bildet und nachgeschaltete Effekte induziert. Nachgelagerte biologische Prozesse, die durch IL-13-Signalgebung vermittelt werden, umfassen Typ-2-Inflammationen wie z. B. atopische Dermatitis, schweres Asthma oder chronische Rhinosinusitis.
Pharmakokinetik
Resorption
- Die mediane Zeit bis zur maximalen Serumkonzentration (tmax) betrug nach einer subkutan (s.c.) verabreichten Tralokinumab-Dosis 5 bis 8 Tage.
- Durch Populations-PK-Analyse wurde ermittelt, dass die absolute Bioverfügbarkeit von Tralokinumab nach s.c. Verabreichung bei 76 % liegt.
- In einer Phase-I-Studie (10 Probanden pro Studienarm) wurde die Bioverfügbarkeit für die 150 mg Dosis auf 62 % und für die 300 mg Dosis auf 60 % geschätzt. Steady-State-Konzentrationen wurden nach einer Anfangsdosis von 600 mg gefolgt von 300 mg alle zwei Wochen an Woche 16 erreicht. In allen klinischen Studien (ECZTRA 1, ECZTRA 2 und ECZTRA 3) lag die mittlere Talkonzentration (±SD) im Steady-State nach Gabe von 300 mg alle zwei Wochen zwischen 98,0 ± 41,1 μg/ml und 101,4 ± 42,7 μg/ml.
Verteilung
- Basierend auf populationsbezogener PK-Analyse wurde das Verteilungsvolumen von Tralokinumab auf etwa 4,2 l geschätzt.
Biotransformation
- Es wurden keine spezifischen Metabolismus-Studien durchgeführt, da Tralokinumab ein Protein ist, wird erwartet, dass es zu kleinen Peptiden und einzelnen Aminosäuren abgebaut wird.
Elimination
- Tralokinumab wird durch eine nicht sättigbare Proteolyse eliminiert.
- Die Halbwertzeit beträgt 22 Tage. Dies entspricht dem typischen Schätzwert für humane monoklonale IgG4-Antikörper, die gegen lösliche Zytokine gerichtet sind.
- In ECZTRA 1, ECZTRA 2 und ECZTRA 3 wurde durch Populations-PK-Analyse eine Clearance von 0,149 l/Tag ermittelt.
- In Phase-I-Studien mit intravenöser Verabreichung wurde ermittelt, dass die Clearance zwischen 0,179 und 0,211 l/Tag liegt.
Linearität/Nicht-Linearität
- Die Exposition gegenüber Tralokinumab steigt zwischen 150 und 600 mg proportional zur Dosis an.
Hohes Körpergewicht
- Die Talkonzentrationen von Tralokinumab waren bei Personen mit höherem Körpergewicht niedriger.
Dosierung
Die empfohlene Dosis für Erwachsene beträgt 600 mg Tralokinumab (vier Injektionen zu je 150 mg) als Anfangsdosis, gefolgt von 300 mg (zwei Injektionen zu je 150 mg) alle zwei Wochen als subkutane Injektion.
Nebenwirkungen
Die häufigsten Nebenwirkungen unter der Anwendung von Tralokinumab sind:
- Infektionen der oberen Atemwege; hauptsächlich als Erkältung gemeldet (23,4%)
- Reaktionen an der Injektionsstelle (7,2%)
- Konjunktivitis (5,4%)
- allergische Konjunktivitis (2,0%)
Wechselwirkungen
Folgende Wechselwirkungen sind bei der Anwendung von Tralokinumab zu beachten:
Totimpfstoffe
- Die Immunantworten auf Totimpfstoffe wurden in einer Studie in Erwachsenen mit atopischer Dermatitis untersucht.
- Da sich keine Unterschiede der Antikörperantworten ergaben, können mit Tralokinumab behandelte Patienten gleichzeitig inaktivierte Impfstoffe oder Totimpfstoffe erhalten.
Lebendimpfstoffe und attenuierte Lebendimpfstoffe
- Lebendimpfstoffe und attenuierte Lebendimpfstoffe dürfen nicht gleichzeitig mit Tralokinumab angewendet werden, da die klinische Sicherheit und Wirksamkeit nicht erwiesen sind.
- Es wird deshalb empfohlen, vor der Behandlung mit Tralokinumab den Impfstatus der Patienten mit Lebendimpfstoffen und attenuierten Lebendimpfstoffen gemäß den aktuellen Impfempfehlungen auf den neuesten Stand zu bringen.
CYP-Enzyme
- Die Wirkungen von Tralokinumab auf die Pharmakokinetik (PK) von CYP-Substraten wurden nicht untersucht.
Kontraindikationen
Tralokinumab darf nicht angewendet werden bei Überempfindlichkeit gegen den Wirkstoff oder einen der genannten sonstigen Bestandteile des Arzneimittels.
Schwangerschaft
Bisher liegen nur begrenzte Erfahrungen mit der Anwendung von Tralokinumab bei Schwangeren vor. Tierexperimentelle Studien ergaben keine Hinweise auf direkte oder indirekte gesundheitsschädliche Wirkungen in Bezug auf eine Reproduktionstoxizität. Als Vorsichtsmaßnahme sollte eine Anwendung von Tralokinumab während der Schwangerschaft vermieden werden.
Stillzeit
Es ist nicht bekannt, ob Tralokinumab in die Muttermilch übergeht oder nach Einnahme systemisch absorbiert wird. Es muss eine Entscheidung darüber getroffen werden, ob das Stillen zu unterbrechen ist oder ob auf die Behandlung mit Tralokinumab verzichtet werden soll. Dabei soll sowohl der Nutzen des Stillens für das Kind als auch der Nutzen der Therapie für die Frau berücksichtigt werden.
Verkehrstüchtigkeit
Tralokinumab hat keinen oder einen zu vernachlässigenden Einfluss auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen.
Anwendungshinweise
Überempfindlichkeit
Wenn eine systemische Überempfindlichkeitsreaktion (unmittelbar oder verzögert) auftritt, soll die Anwendung von Tralokinumab beendet und eine geeignete Therapie eingeleitet werden.
Bindehautentzündung
Patienten, die mit Tralokinumab behandelt werden und eine Bindehautentzündung entwickeln, die nach Standardbehandlung nicht abklingt, sollten sich einer augenärztlichen Untersuchung
unterziehen.
Helminthose
Patienten mit bekannter Helminthose wurden von der Teilnahme an klinischen Studien ausgeschlossen. Es ist nicht bekannt, ob Tralokinumab die Immunantwort auf eine Helminthose durch
Inhibition des IL-13-Signalwegs beeinflusst. Patienten mit einer bestehenden Helminthose sind vor Einleitung der Tralokinumab-Therapie zu behandeln. Wenn sich Patienten während der Tralokinumab-Therapie infizieren und auf eine Behandlung der Helminthose nicht ansprechen, ist die Behandlung mit Tralokinumab zu unterbrechen, bis die Infektion abgeklungen ist.
Impfungen
Lebendimpfstoffe und attenuierte Lebendimpfstoffe dürfen nicht gleichzeitig mit Tralokinumab angewendet werden, da die klinische Sicherheit und Wirksamkeit nicht erwiesen sind. Die
Immunantworten auf Tetanus-Totimpfstoff und Meningokokken-Impfstoff wurden untersucht. Es wird empfohlen, vor der Behandlung mit Tralokinumab den Impfstatus der Patienten mit Lebendimpfstoffen und attenuierten Lebendimpfstoffen gemäß den aktuellen Impfempfehlungen auf den neuesten Stand zu bringen.
Alternativen
Neben Tralokinumab ist der monoklonale Antikörper Dupilumab zugelassen, der an die gemeinsame α-Untereinheit des IL-4- und IL-13-Rezeptors bindet und so in der Folge den IL4-/IL13-Signalweg inhibiert.
-
Adtralza 150 mg Abacus Injektionslösung in einer Fertigspritze
Abacus Medicine A/S
-
Adtralza® 150 mg Injektionslösung in einer Fertigspritze
LEO Pharma GmbH
-
Adtralza 150 mg kohlpharma Injektionslösung in einer Fertigspritze
kohlpharma GmbH
-
Adtralza® 300 mg Injektionslösung in einem Fertigpen
LEO Pharma GmbH
-
Adtralza 300 mg kohlpharma Injektionslösung in einem Fertigpen
kohlpharma GmbH