Trastuzumab deruxtecan
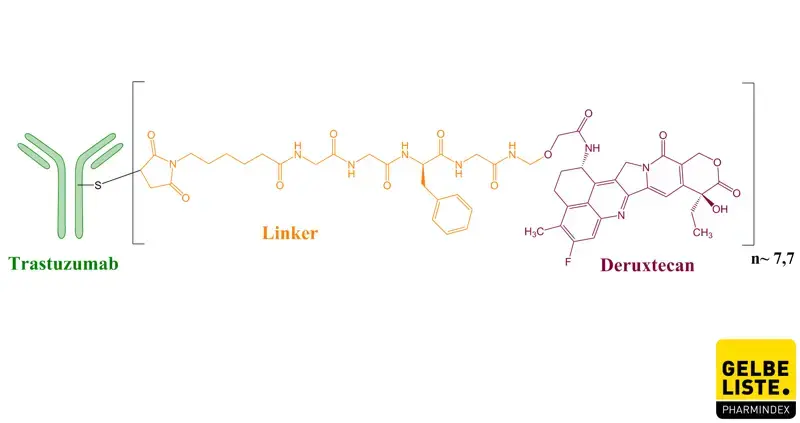
Trastuzumab Deruxtecan ist ein Antikörper-Wirkstoff-Konjugat, das als Monotherapie zur Behandlung von inoperablem oder metastasiertem HER2-positivem Brustkrebs indiziert ist. Das Präparat besteht aus einem humanisierten monoklonalen Anti-HER2-IgG1-Antikörper, der über einen Tetrapeptid-basierten abspaltbaren Linker kovalent an das Zytostatikum Deruxtecan, ein potenter Topoisomerase-I-Inhibitor, gebunden ist.
Trastuzumab Deruxtecan: Übersicht
Anwendung
Trastuzumab-Deruxtecan (Enhertu) ist ein HER2-gerichtetes Antikörper-Wirkstoff-Konjugat, das gemeinsam von AstraZeneca und Daiichi Sankyo entwickelt wurde und als Monotherapie zur Behandlung von inoperablem oder metastasiertem HER2-positivem Brustkrebs bei Patientinnen indiziert ist, die bereits mindestens zwei gegen HER2 gerichtete Vorbehandlungen erhalten haben.
Anwendungsart
Enhertu ist zur intravenösen Anwendung bestimmt und darf nicht als intravenöse Druck- oder Bolusinjektion gegeben werden. Je nach Verträglichkeit können zur Prophylaxe oder Behandlung Antiemetika gegeben werden. Wenn der Patient infusionsbedingte Symptome zeigt, muss die Infusionsgeschwindigkeit von Enhertu reduziert oder die Infusion unterbrochen werden.
Wirkmechanismus
Trastuzumab-Deruxtecan ist ein gegen HER2 gerichtetes Antikörper-Wirkstoff-Konjugat. Der Antikörper ist ein humanisierter Anti-HER2-IgG1-Antikörper, der über einen abspaltbaren Linker auf Tetrapeptidbasis an Deruxtecan, einen Topoisomerase-I-Inhibitor (DXd), gebunden ist. Nach der Bindung an HER2 durch Trastuzumab kommt es zu einer Internalisierung des Trastuzumab-Deruxtecan-Komplexes und der proprietäre Linker wird in der Zelle durch Cathepsine abgespalten, die in Tumorzellen hochreguliert sind. Nach der Freisetzung verursacht das membrangängige Deruxtecan DNA-Schäden, was zur Apoptose der Tumorzelle führt.
Deruxtecan ist etwa 10-mal wirksamer als der aktive Metabolit von Irinotecan SN-38.
Dosierung
Die empfohlene Dosis von Enhertu beträgt 5,4 mg/kg und wird als intravenöse Infusion einmal alle drei Wochen (21-tägiger Zyklus) bis zur Krankheitsprogression oder bis zum Auftreten einer inakzeptablen Toxizität angewendet.
Die Initialdosis ist als 90-minütige intravenöse Infusion zu geben. Wenn die vorausgegangene Infusion gut vertragen wurde, können die nachfolgenden Dosen von Enhertu als 30-minütige Infusionen gegeben werden.
Nebenwirkungen
Die häufigsten Nebenwirkungen von Enhertu sind:
- Übelkeit (79,9%)
- Erschöpfung (60,3%)
- Erbrechen (48,7%)
- Alopezie (46,2%)
- Obstipation (35,9%)
- verminderter Appetit (34,6%)
- Anämie (33,8%)
- Neutropenie (32,5%)
- Diarrhoe (30,8%)
- Thrombozytopenie (23,1%)
- Husten (21,4%)
- Leukopenie (20,5 %)
- Kopfschmerz (20,1%)
Bei 27% der mit Enhertu behandelten Patienten kam es zu Behandlungsunterbrechungen aufgrund von Nebenwirkungen.
Wechselwirkungen
Die gemeinsame Anwendung mit Ritonavir, einem Inhibitor von OATP1B, CYP3A und P-gp, oder mit Itraconazol, einem starken CYP3A- und P-gp-Inhibitor, führte zu keinem klinisch bedeutsamen (ungefähr 10-20%) Anstieg der Expositionen gegenüber Trastuzumab-Deruxtecan oder des freigesetzten Topoisomerase-I-Inhibitors DXd. Bei gleichzeitiger Anwendung von Trastuzumab-Deruxtecan mit Arzneimitteln, die CYP3A- oder OATP1B-Inhibitoren oder P-gp-Transporter sind, ist keine Dosisanpassung erforderlich
Kontraindikationen
Trastuzumab Deruxtecan darf nicht angewendet werden bei Überempfindlichkeit gegen den Wirkstoff oder einen sonstigen Bestandteil des Arzneimittels.
Schwangerschaft
Trastuzumab Deruxtecan kann Schäden bei Feten verursachen. Aus Berichten nach der Markteinführung geht hervor, dass die Anwendung von Trastuzumab während der Schwangerschaft zu Fällen von Oligohydramnions führte, die sich manchmal als lebensbedrohliche Lungenhypoplasie, Skelettanomalien und Tod des Neugeborenen manifestierten. Ausgehend von Erkenntnissen bei Tieren und aufgrund des Wirkungsmechanismus ist zu erwarten, dass der Topoisomerase-I-Inhibitor Deruxtecan auch zu einer Schädigung des Embryos/Fetus führen kann.
Die Anwendung während der Schwangerschaft wird deshalb nicht empfohlen. Patientinnen müssen über die potenziellen Risiken für den Fetus aufgeklärt werden, bevor sie schwanger werden. Frauen, die schwanger werden, müssen sofort ihren Arzt kontaktieren. Wenn eine Frau während der Behandlung mit Trastuzumab Deruxtecan oder innerhalb von 7 Monaten nach der letzten Dosis von Enhertu schwanger wird, wird eine strenge Überwachung empfohlen.
Stillzeit
Es ist nicht bekannt, ob Trastuzumab Deruxtecan in die Muttermilch übergeht, da allerdings humanes IgG in die Muttermilch ausgeschieden wird, kann für Trastuzumab Deruxtecan das Potenzial für eine Resorption und schwerwiegende Nebenwirkungen beim Kind nicht ausgeschlossen werden. Daher dürfen Frauen während der Behandlung und für sieben Monate nach der letzten Dosis nicht stillen. Es muss eine Entscheidung darüber getroffen werden, ob das Stillen zu unterbrechen ist oder ob die Behandlung zu unterbrechen ist. Dabei soll sowohl der Nutzen des Stillens für das Kind als auch der Nutzen der Behandlung mit Trastuzumab Deruxtecan für die Frau berücksichtigt werden.
Verkehrstüchtigkeit
Trastuzumab Deruxtecan kann einen geringen Einfluss auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen haben. Patienten müssen angewiesen werden, beim Führen von Fahrzeugen oder Bedienen von Maschinen Vorsicht walten zu lassen, wenn sie während der Behandlung an Erschöpfung, Kopfschmerz oder Schwindelgefühl leiden.
Anwendungshinweise
Unter der Anwendung von Enhertu kam es zu einigen Fällen von interstitieller Lungenerkrankung (ILD) und/oder Pneumonitis, die zum Teil tödlich endeten. Patienten müssen deshalb darauf hingewiesen werden Symptome wie Husten, Dyspnoe, Fieber und/oder neue oder sich verschlechternde Atemwegssymptome unverzüglich dem behandelnden Arzt zu melden. Bei Verdacht auf ILD/Pneumonitis ist dann eine Röntgenuntersuchung, vorzugsweise eine Computertomographie (CT), durchzuführen.
Alternativen
Für Patienten mit HER2-positivem Brustkrebs im lokal fortgeschrittenen inoperablem oder metastasiertem Stadium, die bereits zwei HER2-gerichtete Therapieregime erhalten haben, gibt es bisher aufgrund limitierter Evidenz keine allgemeine Standardtherapie.
Zur Behandlung des HER2-positiven Brustkrebs wird von deutschen, europäischen und nordamerikanischen Leitlinien grundsätzlich eine HER2-gerichtete Therapie empfohlen. Als Erstlinientherapie der metastasierten Erkrankung wird übereinstimmend eine duale HER2-Blockade mit Pertuzumab und Trastuzumab in Kombination mit einem Taxan und als Zweitlinientherapie das Antikörper-Wirkstoff-Konjugat Trastuzumab-Emtansin empfohlen.
Für Patienten, bei denen während oder nach einer Therapie mit Trastuzumab-Emtansin ein Progress eintritt, wird in den Leitlinien aufgrund limitierter Evidenz keine allgemeine Standardtherapie genannt. Stattdessen wird eine Reihe von Kombinationstherapien einschließlich eines HER2-gerichteten Wirkstoffs, z.B. die fortgesetzte bzw. erneute Gabe von Trastuzumab in Kombination mit verschiedenen zytotoxischen Chemotherapeutika oder Lapatinib, entweder in Kombination mit Trastuzumab oder verschiedenen zytotoxischen Chemotherapeutika empfohlen.
- MODI, Shanu, et al. Trastuzumab deruxtecan in previously treated HER2-positive breast cancer. New England Journal of Medicine, 2020, 382. Jg., Nr. 7, S. 610-621.
- EMA Fachinformation Enhertu
- NUB Antrag 2021/2022: Trastuzumab-Deruxtecan














