Upadacitinib
Der Wirkstoff Upadacitinib ist ein neuer Januskinase (JAK)-Inhibitor, der in den intrazellulären JAK-STAT-Signalweg eingreift und zur Behandlung einer therapierefraktären rheumatoiden Arthritis, Psoriasis-Arthritis, ankylosierende Spondylitis (Morbus Bechterew) und Neurodermitis.
Upadacitinib: Übersicht
Anwendung
Das Immunsuppressivum Upadacitinib wird angewendet zur Behandlung der mittelschweren bis schweren aktiven rheumatoiden Arthritis und Psoriasis-Arthritis, wenn das Ansprechen auf ein oder mehrere krankheitsmodifizierende Antirheumatika (DMARDs) unzureichend war oder diese nicht vertragen wurden. Das Medikament kann als Monotherapie oder in Kombination mit Methotrexat (MTX) eingesetzt werden.
Darüber hinaus ist der Wirkstoff indiziert für die Behandlung der aktiven ankylosierenden Spondylitis (Morbus Bechterew) bei erwachsenen Patienten, die auf eine konventionelle Therapie unzureichend angesprochen haben und für die Behandlung der mittelschweren bis schweren atopischen Dermatitis bei Erwachsenen und Jugendlichen ab 12 Jahren, die für eine systemische Therapie infrage kommen.
Anwendungsart
Upadacitinib ist in Form von Retardtabletten auf dem deutschen Markt zugelassen und kann unabhängig von einer Mahlzeit zu einer beliebigen Uhrzeit eingenommen werden. Die Tabletten sollen im Ganzen geschluckt und nicht geteilt, zerdrückt oder zerkaut werden.
Wirkmechanismus
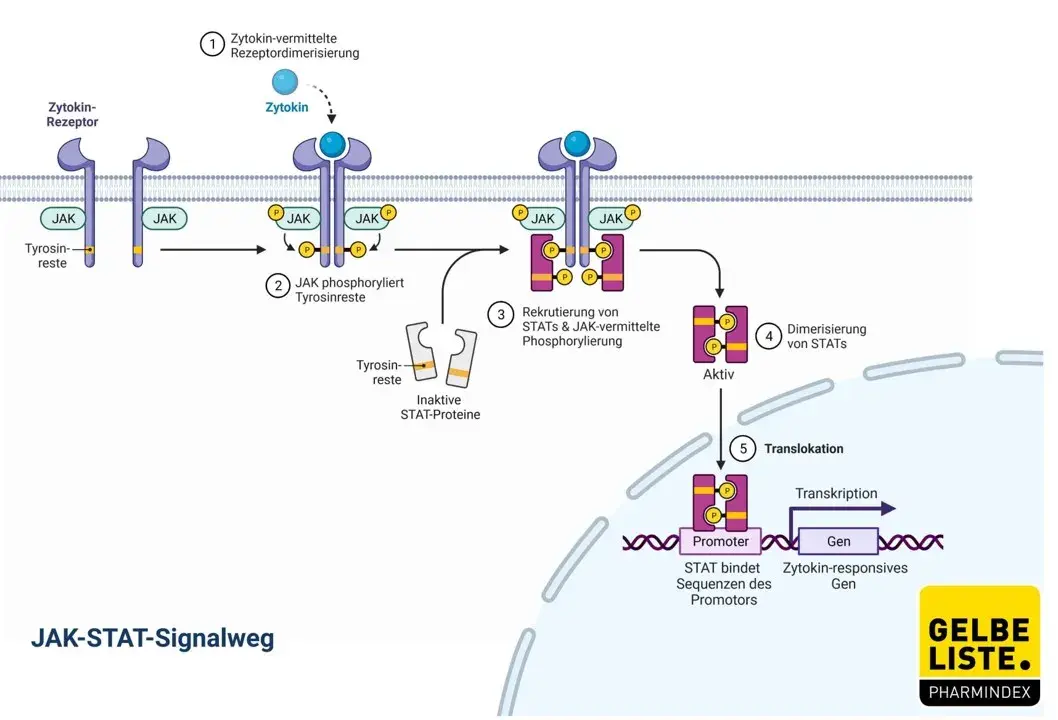
Upadacitinib ist ein selektiver und reversibler Inhibitor der Januskinase (JAK) 1. Die JAK-Enzymfamilie umfasst die vier Mitglieder JAK1, JAK2, JAK3 und Tyrosinkinase 2 (TYK2), die paarweise Signaltransduktoren und Aktivatoren der Transkription phosphorylieren und dadurch aktivieren. Anders als bei den bislang zur Behandlung der rheumatoiden Arthritis zugelassenen JAK-Inhibitoren Baricitinib (Olumiant) und Tofacitinib (Xeljanz), blockiert Upadacitinib nur die Wirkung von JAK1.
Die Wirkung beruht auf immunsuppressiven, antiinflammatorischen und antiproliferativen Effekten.
Pharmakokinetik
Resorption
Nach oraler Anwendung beträgt die mittlere tmax von retardiertem Upadacitinib 2 bis 4 Stunden. Eine Einnahme zusammen mit einer fettreichen Mahlzeit hatte keine klinisch relevante Auswirkung auf die Upadacitinib-Exposition. Upadacitinib ist in vitro ein Substrat für die Effluxtransporter P-gp und BCRP.
Verteilung
Upadacitinib wird zu 52% an Plasmaproteine gebunden und verteilt sich gleichermaßen auf Zellbestandteile von Plasma und Blut.
Metabolismus
Upadacitinib wird durch CYP3A4 und möglicherweise in geringem Maße auch durch CYP2D6 metabolisiert. Die pharmakologische Wirkung von Upadacitinib wird dem Grundmolekül zugeschrieben. Für Upadacitinib wurden keine aktiven Metaboliten identifiziert.
Elimination
Upadacitinib wird vorwiegend als unverändertes Grundmolekül im Urin (24%) und im Stuhl (38%) ausgeschieden. Etwa 34% der Upadacitinib-Dosis wurden als Metaboliten ausgeschieden. Die mittlere terminale Eliminationshalbwertszeit von Upadacitinib beträgt 9 bis 14 Stunden.
Dosierung
Die Dosierungsempfehlung für Upadacitinib bei der Behandlung der rheumatoiden Arthritis, Psoriasis-Arthritis und ankylosierende Spondylitis beträgt 15 mg einmal täglich.
Bei der Behandlung der atopischen Dermatitis ´liegt die Dosierungsempfehlung bei 15 mg oder 30 mg einmal täglich, je nach individuellem Krankheitsbild.
Liegt die absoluten Lymphozytenzahl (ALC) unter 500 Zellen/mm3, die absoluten Neutrophilenzahl (ANC) unter 1.000 Zellen/mm3 oder der Hämoglobinspiegel unter 8 g/dl sollte die Behandlung mit Upadacitinib nicht begonnen werden.
Nebenwirkungen
Die am häufigsten berichteten Nebenwirkungen sind:
- Infektionen der oberen Atemwege (13,5%)
- Übelkeit (3,5%)
- Erhöhungen der Kreatinphosphokinase (CPK) im Blut (2,5%)
- Husten (2,2%)
Die häufigsten schwerwiegenden Nebenwirkungen waren schwerwiegende Infektionen
Wechselwirkungen
Die Metabolisierung von Upadacitinib erfolgt hauptsächlich über CYP3A4, weshalb die Plasmaexposition von Arzneimitteln oder Substanzen beeinflusst wird, die CYP3A4 stark inhibieren oder induzieren:
- Starke CYP3A4-Inhibitoren (z. B. Ketoconazol, Itraconazol, Posaconazol, Voriconazol und Clarithromycin) erhöhen bei gleichzeitiger Anwendung die Upadacitinib-Exposition.
- Starke CYP3A4-Induktoren (z. B. Rifampicin und Phenytoin)verringern bei gleichzeitiger Anwendung die Upadacitinib-Exposition.
- Es gibt Hinweise darauf, dass Upadacitinib 30 mg einmal täglich einen schwachen induzierenden Effekt auf CYP3A haben kann.
Kontraindikation
Upadacitinib darf nicht angewendet werden bei:
- Überempfindlichkeit gegen den Wirkstoff oder einen der sonstigen Bestandteile.
- Aktiver Tuberkulose oder aktiver schwerwiegender Infektionen
- Schwerer Leberinsuffizienz
- Schwangerschaft
Schwangerschaft
Upadacitinib ist während der Schwangerschaft kontraindiziert. Tierexperimentelle Studien haben eine Reproduktionstoxizität gezeigt. Upadacitinib war bei Ratten und Kaninchen teratogen und hatte bei Exposition in utero bei Rattenföten Auswirkungen auf die Knochen und bei Kaninchenföten Auswirkungen auf das Herz.
Stillzeit
Daten aus tierexperimentellen Studien haben gezeigt, dass Upadacitinib in die Milch übergeht. Upadacitinib sollte während der Stillzeit nicht angewendet werden. Es muss eine Entscheidung darüber getroffen werden, ob das Stillen zu unterbrechen ist oder ob auf die Behandlung mit Upadacitinib verzichtet werden. Dabei soll sowohl der Nutzen des Stillens für das Kind als auch der Nutzen der Therapie für die Frau berücksichtigt werden.
Verkehrstüchtigkeit
Upadacitinib hat keinen oder einen zu vernachlässigenden Einfluss auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen.
Anwendungshinweise
- Unter der Anwendung kann es zu schwerwiegenden Infektionen kommen, weshalb die Behandlung mit Upadacitinib bei Patienten mit aktiver, schwerwiegender Infektion, einschließlich lokaler Infektionen, nicht begonnen werden darf.
- Vor Beginn der Behandlung mit Upadacitinibsollten Patienten auf Tuberkulose getestet werden.
- Unter Upadacitinib ist eine Virusreaktivierung möglich, einschließlich Fälle der Reaktivierung von Herpes-Viren (z. B. Herpes zoster, Herpes simplex), weshalb vor Beginn und während der Therapie ein Screening auf eine Virushepatitis durchgeführt werden sollte.
- Die Anwendung von attenuierten Lebendimpfstoffen sollte während oder unmittelbar vor der Behandlung vermieden werden.
- Maligne Erkrankungen, einschließlich nicht-melanozytärer Hautkrebs (non-melanoma skin cancer, NMSC), wurden in klinischen Studien zu Upadacitinib beobachtet.
- Bei Patienten, bei denen eine ANC von < 1 x 109 Zellen/l, eine ALC von < 0,5 x 109 Zellen/l oder ein Hämoglobinwert von < 8 g/dl beobachtet wird, sollte mit der Behandlung nicht begonnen werden bzw. sollte die Behandlung vorübergehend unterbrochen werden
- Es gibt Berichte zu dosisabhängigen Erhöhungen der Blutlipidwerte unter Upadacitinib, weshalb die Lipidparameter etwa vier Wochen nach Beginn der Therapie und anschließend entsprechend dem Risiko des Patienten für kardiovaskuläre Erkrankungen überprüft werden sollten.
- Bei Patienten, die Upadacitinib erhielten, wurden tiefe Venenthrombosen (TVT) und Lungenembolien (LE) berichtet, weshalb Upadacitinib bei Patienten mit hohem Risiko für TVT/LE nur mit Vorsicht angewendet werden sollte. Faktoren, die bei der Beurteilung des TVT/LE-Risikos berücksichtigt werden sollten, sind höheres Alter, Adipositas, TVT/LE in der Vorgeschichte, prothrombotische Störung, Anwendung kombinierter hormoneller Kontrazeptiva oder Hormonersatztherapie und Patienten, die sich einem größeren chirurgischen Eingriff unterziehen oder für längere Zeit immobilisiert werden.
- Die Behandlung mit Upadacitinib war im Vergleich zu Placebo mit einer höheren Inzidenz für erhöhte Leberwerte verbunden.
- Nach der Markteinführung und in klinischen Studien wurde unter Upadacitinib über Fälle von Divertikulitis berichtet.
Alternativen
Zur medikamentösen Therapie der rheumatoiden Arthritis stehen weitere Wirkstoffgruppen zur Verfügung:
- nichtsteroidale Antirheumatika (NSAR)
- Coxibe
- Glukokortikoide
- DMARDs (Disease Modifying Anti-Rheumatic Drugs)
Darüber hinaus sind für die Behandlung der rheumatoiden Arthritis die Januskinase-Inhibitoren Baricitinib und Tofacitinib zugelassen.
Tofacitinib ist ein Pan-JAK-Inhibitor, welcher in Enzym-Assays JAK1, JAK2, JAK3, sowie in geringerem Maße TYK2 hemmt, während Baricitinib sowohl JAK1 als auch JAK2 inhibiert. Upadacitinib hingegen inhibiert bevorzugt JAK1- oder JAK1/3-Signalwege im Vergleich zu anderen Zytokin-Signalwegen, die über JAK2-Paare vermittelt werden.
Für die Behandlung der Neurodermitis stehen noch die zwei weiteren Januskinase-Inibitoren Baricitinib (Olumiant) und Abrocitinib (Cibinqo) zur Verfügung.
-
Rinvoq 15 mg 2care4 Retardtabletten
2care4 ApS
-
Rinvoq 15 mg Abacus Retardtabletten
Abacus Medicine A/S
-
Rinvoq 15 mg axicorp Retardtabletten
axicorp Pharma B.V.
-
Rinvoq 15 mg CC Pharma Retardtabletten
CC Pharma GmbH
-
Rinvoq 15 mg Eurim Retardtabletten
Eurim-Pharm Arzneimittel GmbH
-
Rinvoq 15 mg Haemato-Pharm Retardtabletten
HAEMATO PHARM GmbH
-
Rinvoq 15 mg kohlpharma Retardtabletten
kohlpharma GmbH
-
Rinvoq 15 mg NMG Pharma Retardtabletten
NMG Pharma GmbH
-
Rinvoq 15 mg Orifarm Retardtabletten
Orifarm GmbH
-
Rinvoq 15 mg Paranova Retardtabletten
Paranova Pack A/S
-
RINVOQ® 15 mg Retardtabletten
AbbVie Deutschland GmbH & Co. KG
-
Rinvoq 15mg SynCo pharma Retardtabletten
SynCo pharma B.V.
-
Rinvoq 30 mg Abacus Retardtabletten
Abacus Medicine A/S
-
Rinvoq 30 mg Orifarm Retardtabletten
Orifarm GmbH
-
RINVOQ® 30 mg Retardtabletten
AbbVie Deutschland GmbH & Co. KG
-
Rinvoq 30 mg SynCo pharma Retardtabletten
SynCo pharma B.V.
-
Rinvoq 45 mg Abacus Retardtabletten
Abacus Medicine A/S
-
Rinvoq 45 mg Eurim Retardtabletten
Eurim-Pharm Arzneimittel GmbH
-
Rinvoq 45 mg kohlpharma Retardtabletten
kohlpharma GmbH
-
Rinvoq 45 mg Orifarm Retardtabletten
Orifarm GmbH
-
RINVOQ® 45 mg Retardtabletten
AbbVie Deutschland GmbH & Co. KG
-
Rinvoq 45 mg SynCo pharma Retardtabletten
SynCo pharma B.V.













