Vemurafenib
Vemurafenib ist ein niedermolekularer Inhibitor der onkogenen BRAF-Kinase, der für die Behandlung von Patienten mit inoperablem oder metastasiertem Melanom mit BRAF-V600-Mutationen indiziert ist.
Vemurafenib: Übersicht
Anwendung
Vemurafenib (Zelboraf) ist als Monotherapie indiziert zur Behandlung von erwachsenen Patienten mit BRAF-V600 Mutation-positivem nicht resezierbarem oder metastasiertem Melanom.
Wirkmechanismus
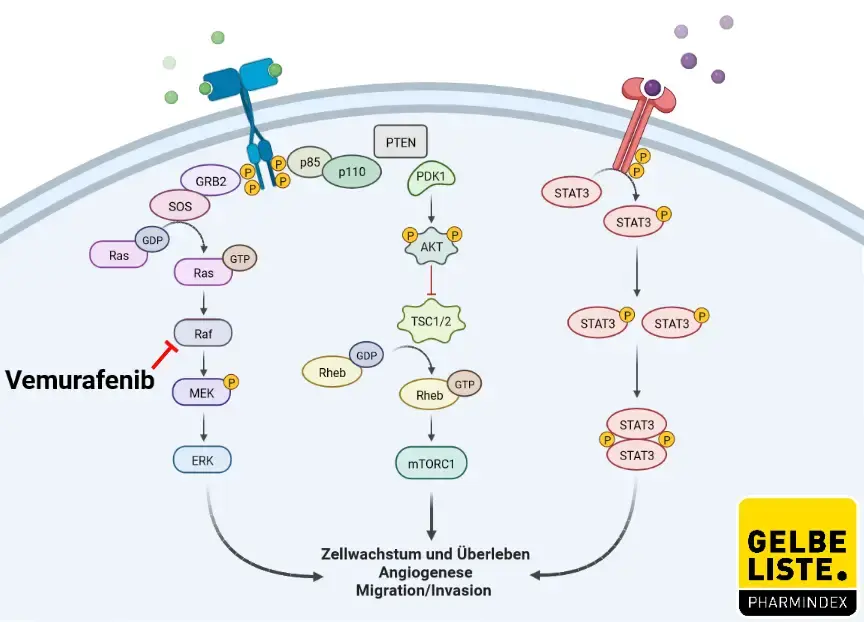
Der RAS-RAF-MEK-ERK-Weg ist eine Kinase-Kaskade, die Signale von extrazellulären Wachstumsfaktoren an Effektoren im Zytoplasma und Zellkern überträgt, die eine Vielzahl kritischer zellulärer Prozesse steuern, einschließlich Fortschreiten des Zellzyklus, Differenzierung, Überleben, Migration und Angiogenese. BRAF ist eines von drei hochkonservierten Serin-Threonin-Proteinkinase-Genen (ARAF, BRAF und CRAF) in der RAS-RAF-MEK-ERK-Kaskade. Mutationen im BRAF-Gen wurden bei 7–15% aller menschlichen Krebserkrankungen berichtet und gehören zu den häufigsten somatischen Mutationen beim Melanom, die in etwa 50% der Fälle auftreten. Vemurafenib ist ein selektiver, reversibler Inhibitor der BRAF-Kinase, der für die BRAF-V600E-Mutation selektiv ist.
Pharmakokinetik
- Vemurafenib wird nach einer oralen Einzeldosis von 960 mg schnell resorbiert und erreicht die maximale Wirkstoffkonzentration etwa 4 Stunden nach der Einnahme.
- Nach mehrfacher Gabe von 960 mg zweimal täglich kommt es zu einer starken Akkumulation.
- Der Steady State wird nach etwa 15–21 Tagen erreicht und die Exposition im Steady State ist relativ konstant.
- Populationspharmakokinetische Analysen ergaben eine Vemurafenib-Halbwertszeit von ≈57 Stunden.
- Die Elimination scheint überwiegend über die Leber zu erfolgen.
- Pharmakokinetische Parameter sind im Allgemeinen unabhängig von Alter, Geschlecht oder Rasse konsistent.
- Bei Patienten mit leichter oder mittelschwerer Leber- oder Nierenfunktionsstörung sind keine Dosisanpassungen erforderlich, aber die Auswirkungen einer schweren Leber- oder Nierenfunktionsstörung auf die Pharmakokinetik von Vemurafenib sind ungewiss.
- Vemurafenib scheint ein Substrat und Induktor von Cytochrom P450 (CYP) 3A4 zu sein, ein mäßiger Inhibitor von CYP1A2 und sowohl ein Substrat als auch ein Inhibitor der Arzneimittel-Efflux-Transporter P-Glykoprotein und Brustkrebs-Resistenzprotein.
- Die Beziehung zwischen den Plasmakonzentrationen von Vemurafenib und dem Ansprechen muss noch geklärt werden.
Dosierung
Die empfohlene Dosis von Vemurafenib beträgt 960 mg zweimal täglich (entsprechend einer Tagesgesamtdosis von 1.920 mg).
Nebenwirkungen
Die häufigsten bei der Anwendung von Vemurafenib aufgetretenen Nebenwirkungen aller Schweregrade (>30%) beinhalten:
- Arthralgie
- Abgeschlagenheit
- Ausschlag
- Lichtempfindlichkeitsreaktionen
- Alopezie
- Übelkeit
- Diarrhö
- Kopfschmerzen
- Pruritus
- Erbrechen
- Hautpapillome
- Hyperkeratose
Wechselwirkungen
- Vemurafenib scheint ein Substrat und Induktor von CYP3A4, ein moderater Inhibitor von CYP1A2 und sowohl ein Substrat als auch ein Inhibitor von P-gp und BCRP zu sein.
- Obwohl Vemurafenib keiner umfassenden metabolischen Biotransformation unterliegt, deuten In-vitro-Studien darauf hin, dass CYP3A4 das primäre oxidative Enzym ist, das für die Metabolisierung von Vemurafenib verantwortlich ist.
- Vemurafenib kann die Exposition gegenüber Substanzen verringern, die hauptsächlich durch CYP3A4 metabolisiert werden und Dosisanpassungen für CYP3A4-Substrate mit einer engen therapeutischen Breite erforderlich machen. Insbesondere die Wirksamkeit von oralen Kontrazeptiva, die durch CYP3A4 metabolisiert werden, kann verringert werden, wenn sie zusammen mit Vemurafenib angewendet werden.
- Vemurafenib ist ein mäßiger Inhibitor von CYP1A2. In einer klinischen Studie bei Patienten mit Melanom führte die Gabe einer Einzeldosis Coffein (CYP1A2-Substrat) nach mehrfacher Gabe von Vemurafenib 960 mg zweimal täglich über 15 Tage zu einem mittleren 2,6-fachen Anstieg des Plasma-Coffeins, was darauf hindeutet, dass Vemurafenib die CYP1A2-Aktivität hemmen könnte.
- Die Gabe einer Einzeldosis von 2 mg Tizanidin (CYP1A2-Substrat, das umfassend von CYP1A2 metabolisiert wird) nach zweimal täglicher Gabe von 960 mg Vemurafenib führte zu einer erhöhten Tizanidin-Exposition im Vergleich zur Gabe von Tizanidin allein, mit einem geometrischen Mittelwertverhältnis von 2,2 (Bereich 0,7–4,9) für Cmax und 4,7 (Bereich 0,9–16,0) für AUC∞. Diese Ergebnisse deuten darauf hin, dass Vemurafenib die Exposition gegenüber Substanzen erhöhen kann, die überwiegend durch CYP1A2 metabolisiert werden.
- Darüber hinaus sollte bei gleichzeitiger Anwendung von Vemurafenib und Warfarin bei Patienten mit Melanom eine zusätzliche Überwachung des International Normalized Ratio in Betracht gezogen werden.
- In-vitro-Studien haben gezeigt, dass Vemurafenib sowohl ein Substrat als auch ein Inhibitor der Efflux-Transporter P-gp und BCRP ist. Eine klinische Arzneimittelwechselwirkungsstudie zeigte, dass die Verabreichung einer oralen Einzeldosis von 0,25 mg Digoxin (P-gp-Substrat) nach mehreren oralen Dosen von Vemurafenib (960 mg zweimal täglich über 21 Tage) die Digoxin-Exposition im Vergleich zur Verabreichung einer Einzeldosis erhöhte. Deshalb ist Vorsicht geboten, wenn Vemurafenib gleichzeitig mit P-gp-Substraten verabreicht wird.
- Bei gleichzeitiger Anwendung von Vemurafenib mit Substraten, Inhibitoren oder Induktoren von BCRP ist Vorsicht geboten, um suboptimale Konzentrationen von Vemurafenib und/oder der Begleitmedikation zu vermeiden.
Kontraindikationen
Vemurafenib darf nicht bei Überempfindlichkeit gegen den Wirkstoff angewendet werden.
Schwangerschaft
Es liegen keine Daten zur Anwendung von Vemurafenib bei Schwangeren vor. Vemurafenib zeigte an Rattenembryonen/-föten oder an Kaninchenembryonen/-föten keinen Hinweis für Teratogenität. In tierexperimentellen Studien wurde eine Plazentagängigkeit von Vemurafenib nachgewiesen. Aufgrund seines Wirkmechanismus könnte Vemurafenib eine fruchtschädigende Wirkung haben, wenn es bei einer schwangeren Frau angewendet wird. Vemurafenib soll von schwangeren Frauen nicht angewendet werden, es sei denn, der mögliche Nutzen für die Mutter wiegt das mögliche Risiko für den Fötus auf.
Stillzeit
Es ist nicht bekannt, ob Vemurafenib in die Muttermilch übergeht. Ein Risiko für das Neugeborene/den Säugling kann nicht ausgeschlossen werden. Unter Berücksichtigung des Nutzens des Stillens für das Kind und des Nutzens der Behandlung für die Mutter muss die Entscheidung getroffen werden, entweder das Stillen oder die Behandlung mit Vemurafenib abzubrechen.
Verkehrstüchtigkeit
Vemurafenib hat geringen Einfluss auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen. Die Patienten sollen darauf hingewiesen werden, dass möglicherweise Abgeschlagenheit oder Augenprobleme auftreten können, wodurch die Fahrtüchtigkeit nicht mehr gewährleistet ist.
Wirkstoff-Informationen
- Fachinformation Zelboraf
- Zhang, W., Heinzmann, D. & Grippo, J.F. Clinical Pharmacokinetics of Vemurafenib. Clin Pharmacokinet 56, 1033–1043 (2017)
Abbildung
Adapted from „ PI3K/Akt, RAS/MAPK, JAK/STAT Signaling”, by BioRender.com
-
Zelboraf 240 mg Abacus Filmtabletten
Abacus Medicine A/S
-
Zelboraf 240 mg axicorp Filmtabletten
axicorp Pharma B.V.
-
Zelboraf 240 mg B2B Medical Filmtabletten
B2B Medical GmbH
-
Zelboraf 240 mg CC Pharma Filmtabletten
CC Pharma GmbH
-
Zelboraf 240 mg Eurim Filmtabletten
Eurim-Pharm Arzneimittel GmbH
-
Zelboraf® 240 mg Filmtabletten
Roche Pharma AG
-
Zelboraf 240 mg kohlpharma Filmtabletten
kohlpharma GmbH
-
Zelboraf 240 mg Orifarm Filmtabletten
Orifarm GmbH
-
Zelboraf 240 mg Paranova Filmtabletten
Paranova Pack A/S
-
Zelboraf 240 mg SynCo pharma Filmtabletten
SynCo pharma B.V.











