Vosoritid
Vosoritid ist ein Analogon des natriuretischen Peptids vom Typ C (CNP), das zur Behandlung von Achondroplasie bei Patienten ab dem 2. Lebensjahr, bei denen die Epiphysen noch nicht geschlossen sind, angewendet wird.
Vosoritid: Übersicht
Anwendung
Vosoritid ist unter dem Handelsnamen Voxzogo seit dem 1. Oktober 2021 auf dem deutschen Markt und indiziert zur Behandlung von Achondroplasie bei Patienten ab dem 2. Lebensjahr, bei denen die Epiphysen noch nicht geschlossen sind, indiziert ist. Die Diagnose Achondroplasie muss durch einen entsprechenden Gentest verifiziert werden.
Über Achondroplasie
Achondroplasie ist eine seltene genetisch bedingte Erkrankung, die zu Kleinwuchs führt. Die Lebenserwartung der an Achondroplasie leidenden Patienten bleibt grundsätzlich unbeeinflusst. Die Erkrankung ist gekennzeichnet durch dysproportionierten Kleinwuchs und vor allem proximal verkürzte Extremitäten. Die geschätzte Prävalenz beträgt weltweit etwa 1/25.000.
Eine Gain-of-Function-Mutation im Fibroplasten-Wachstumsfaktor-Rezeptor 3 (FGFR3) bewirkt bei Patienten mit Achondroplasie eine negative Regulation des endochondralen Knochenwachstums. Infolgedessen kommt es zu Kleinwuchs, verkürzten Extremitäten, Makrozephalie aber auch Hypotonie. Die Diagnose basiert auf radiologischen und klinischen Befunden.
Anwendungsart
Voxzogo ist in der Darreichungsform Pulver und Lösungsmittel zur Herstellung einer Injektionslösung auf dem Markt:
- 0,4 mg Pulver in 0,5 ml Lösung (0,8 mg/ml nach Rekonstitution)
- 0,56 mg Pulver in 0,7 ml Lösung (0,8 mg/ml nach Rekonstitution)
- 1,2 mg Pulver in 0,6 ml Lösung (1,2 mg/ml nach Rekonstitution)
Die Behandlung mit Vosoritid muss von einem Arzt begonnen und geleitet werden, der angemessen im Management solcher Wachstumsstörungen oder skelettalen Dysplasien qualifiziert ist.
Wirkmechanismus
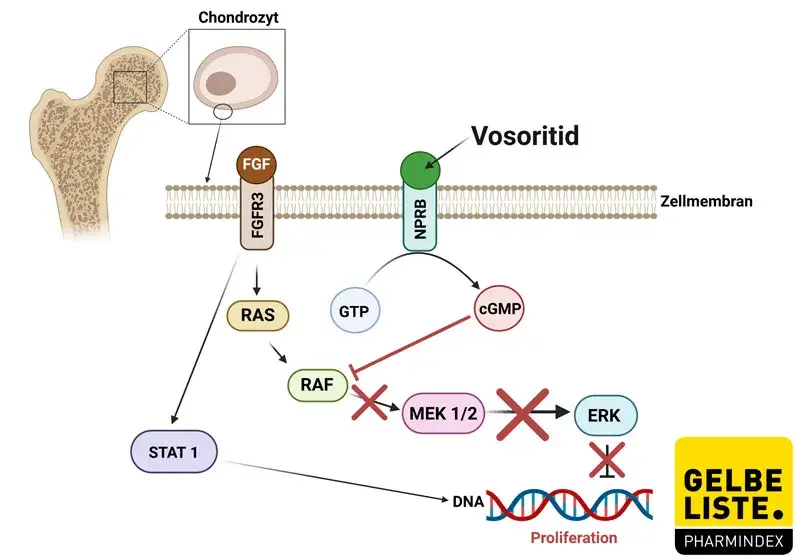
Das C-natriuretische Peptid (CNP) und dessen Rezeptor, der natriuretische Peptid-Rezeptor B (NPR-B), gelten als Schlüsselregulatoren des longitudinalen Knochenwachstums. Hierbei fördert der CNP-Signalweg das Knochenwachstum durch Hemmung des MAPK-Signalwegs. Vosoritid ist ein modifiziertes Analogon von CNP, das als Agonist von NPR-B fungiert. Durch Bindung an NPR-B hemmt Vosoritid die Signalkaskade des Fibroplasten-Wachstumsfaktor-Rezeptor 3 (FGFR3), die bei Achondroplasie durch eine Gain-of-Function-Mutation negativ reguliert ist.
Dabei werden die extrazelullär Signal-regulierten Kinasen 1 und 2 (ERK1/2) im sich überschneidenden MAP-Kinase-Signalweg (MAPK) als Folge der Hemmung der Serin/Threonin-Kinase Rapidly-Accelerated-Fibrosarcoma (RAF-1) inhibiert. Somit dient das CNP Analogon Vosoritid wie das physiologische CNP als positiver Regulator des endochondralen Knochenwachstums, indem es die Proliferation und Differenzierung von Chondrozyten stimuliert.
Pharmakokinetik
Resorption
- Vosoritid wird im Median nach 15 Minuten absorbiert.
- Die mittlere Cmax und AUC (± SA) vom Zeitpunkt null bis zur letzten messbaren Konzentration, die nach 52 Wochen Behandlung beobachtet wurde, war 5 800 (± 3680) bzw. 290000 (±235000) pg-min/ml.
Verteilung
- Das mittlere (± SA) scheinbare Verteilungsvolumen betrug nach 52 Behandlungswochen 2910 (± 1660) ml/kg.
Biotransformation
- Die Metabolisierung wird aller Voraussicht nach über katabole Pfade erfolgen
Elimination
- Die mittlere (± SA) scheinbare Clearance betrug nach 52 Behandlungswochen 79,4 (53,0) ml/min/kg.
- Die mittlere (± SA) Halbwertszeit liegt bei 27,9 (9,9) Minuten. Die Variabilität von Patient zu Patient (Variationskoeffizient) der scheinbaren Clearance betrugt 33,6%.
Linearität/Nichtlinearität
- Der Anstieg der Plasma-Exposition (AUC und Cmax) mit der Dosis war höher als dosisproportional im Dosisbereich von 2,5 (das 0,17-Fache der empfohlenen Dosis) bis 30,0 μg/kg/Tag (das Doppelte der zugelassenen Dosis).
Körpergewicht
- Das Körpergewicht ist die einzige signifikante Kovariable für die Clearance oder das Verteilungsvolumen von Vosoritid.
- Clearance und Verteilungsvolumen von Vosoritid stiegen mit zunehmendem Körpergewicht bei Patienten mit Achondroplasie (9 bis 74,5 kg).
- Die empfohlene Dosierung berücksichtigt diese Abweichung und empfiehlt die Anwendung von Dosen über (bei Patienten mit einem Körpergewicht zwischen 10 und 16 kg) oder unter (bei Patienten mit einem Körpergewicht von über 44 kg) der „Standarddosis“ von 15 μg/kg, um in allen Gewichtsklassen einen ähnlichen Expositionsgrad zu erzielen.
Patienten mit Beeinträchtigung der Nieren- und Leberfunktion
- Basierend auf dem Eliminationsmechanismus wird nicht erwartet,dass eine Beeinträchtigung von Nieren- oder Leberfunktion die Pharmakokinetik von Vosoritid verändert.
Dosierung
Die empfohlene Dosierung orientiert sich am Körpergewicht des Patienten und der Vosoritid-Konzentration. Üblicherweise wird eine Dosis von 15 µg/kg Körpergewicht empfohlen. Unter Berücksichtigung gewichtsbedingter Veränderungen der Pharmakokinetik können der Fachinformation Volumina der Einzeldosis in Abhängigkeit vom Körpergewicht entnommen werden.
Die Behandlungsdauer richtet sich nach dem individuellen Wachstumspotenzial der Patienten. Die Behandlung mit Voxzogo sollte beendet werden, sobald bestätigt ist, dass kein weiteres Wachstumspotenzial mehr besteht. Dies zeigt sich durch eine Wachstumsgeschwindigkeit von <1,5 cm/Jahr und dem Schließen der Epiphysen.
Nebenwirkungen
Die häufigsten Nebenwirkungen, die unter einer Therapie mit Vosoritid auftreten können, sind:
- Reaktionen an der Injektionsstelle
- Erbrechen
- Hypotonie
- Schwindelgefühl und Synkope
Das Arzneimittel ist darüber hinaus mit dem schwarzen Dreieck gekennzeichnet und wird dementsprechend stetig auf weitere, neu auftretende Nebenwirkungen überwacht.
Wechselwirkungen
Bisherige Untersuchungen deuten darauf hin, dass CYP- oder Transporter-bedingte Wechselwirkungen bei der Anwendung von Vosoritid unwahrscheinlich sind. Da es sich bei Vosoritid außerdem um ein rekombinantes Peptid handelt, ist es generell unwahrscheinlich, dass Arzneimittelwechselwirkungen auftreten
Kontraindikationen
Vosoritid darf nicht angewendet werden bei Überempfindlichkeit gegen den Wirkstoff oder sonstige Bestandteile des Arzneimittels.
Schwangerschaft
Bisher liegen keine oder nur sehr begrenzte Erfahrungen mit der Anwendung von Vosoritid bei Schwangeren vor. Tierexperimentelle Studien ergaben keine Hinweise auf direkte oder indirekte
gesundheitsschädliche Wirkungen in Bezug auf eine Reproduktionstoxizität. Aus Vorsichtsgründen soll eine Anwendung von Vosoritid während der Schwangerschaft vermieden werden.
Stillzeit
Tierexperimentelle Daten zeigen, dass Vosoritid in die Milch übergeht, weshalb ein Risiko für das Neugeborene/Kind nicht ausgeschlossen werden kann. Vosoritid soll deshalb während der Stillzeit nicht angewendet werden.
Verkehrstüchtigkeit
Vosoritid kann zu einer vorübergehenden Hypotonie führen, die in der Regel leicht ist. Jedoch können Synkope, Präsynkope, Schwindelgefühl sowie andere Anzeichen und Symptome eines verminderten Blutdrucks einen Einfluss auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen haben, weshalb Patienten geraten wird, nach der Injektion mindestens 60 Minuten lang nicht Auto bzw. Fahrrad zu fahren oder Maschinen zu bedienen.
- EMA: Fachinformation Voxzogo
- Savarirayan R et al., Once-daily, subcutaneous vosoritide therapy in children with achondroplasia: a randomised, double-blind, phase 3, placebo-controlled, multicentre trial. Lancet. 2020 Sep 5;396(10252):684-692. doi: 10.1016/S0140-6736(20)31541-5
- Pauli, Richard M. Achondroplasia: a comprehensive clinical review. Orphanet journal of rare diseases vol. 14,1 1. 3 Jan. 2019, doi:10.1186/s13023-018-0972-6
- Högler, W., Ward, L.M. New developments in the management of achondroplasia. Wien Med Wochenschr 170, 104–111 (2020), doi:10.1007/s10354-020-00741-6
Abbildung:
Created with Biorender
-
VOXZOGO® 0,4 mg Pulver und Lösungsmittel zur Herstellung einer Injektionslösung
Biomarin International Ltd.
-
VOXZOGO® 0,56 mg Pulver und Lösungsmittel zur Herstellung einer Injektionslösung
Biomarin International Ltd.
-
VOXZOGO® 1,2 mg Pulver und Lösungsmittel zur Herstellung einer Injektionslösung
Biomarin International Ltd.











