Zanubrutinib
Zanubrutinib ist ein Bruton-Tyrosinkinase-Inhibitor. Der Wirkstoff wird zur Behandlung der seltenen Erkrankung Morbus Waldenström, einer Art des lymphoplasmozytischen Lymphoms, angewendet.
Zanubrutinib: Übersicht

Anwendung
Zanubrutinib ist indiziert bei erwachsenen Patienten mit Morbus Waldenström, die mindesteins eine vorherige Therapie erhalten haben oder zur Erstlinientherapie bei Patienten, die nicht für eine Chemoimmuntherapie geeignet sind. Morbus Waldenström ist eine seltene Erkrankung und die häufigste Form des lymphoplasmozytischen Lymphoms. Etwa 90% der Patienten weisen eine Mutation des MYD88-Gens auf, was aber nicht spezifisch für die Erkrankung ist. Morbus Waldenström kann mit einer erheblichen Morbidität einhergehen. Der Verlauf ist langsam und chronisch, eine Heilungsmöglichkeit besteht derzeit nicht.
Zanubrutinib ist außerdem indiziert als Monotherapie bei erwachsenen Patienten mit Marginalzonenlymphom, die mindestens eine vorherige Therapie mit einem Anti-CD20-Antikörper erhalten haben.
Der Wirkstoff kann zudem bei erwachsenen Patienten mit chronischer lymphatischer Leukämie (CLL) als Monotherapie angewendet werden.
Anwendungsart
Zanubrutinib steht in Form von Hartkapseln zum Einnehmen zur Verfügung. Diese können mit oder ohne Nahrungsmittel eingenommen werden. Die Kapseln sollten im Ganzen mit Wasser geschluckt werden, ohne vorher geöffnet, zerbrochen oder zerkaut zu werden.
Wirkmechanismus
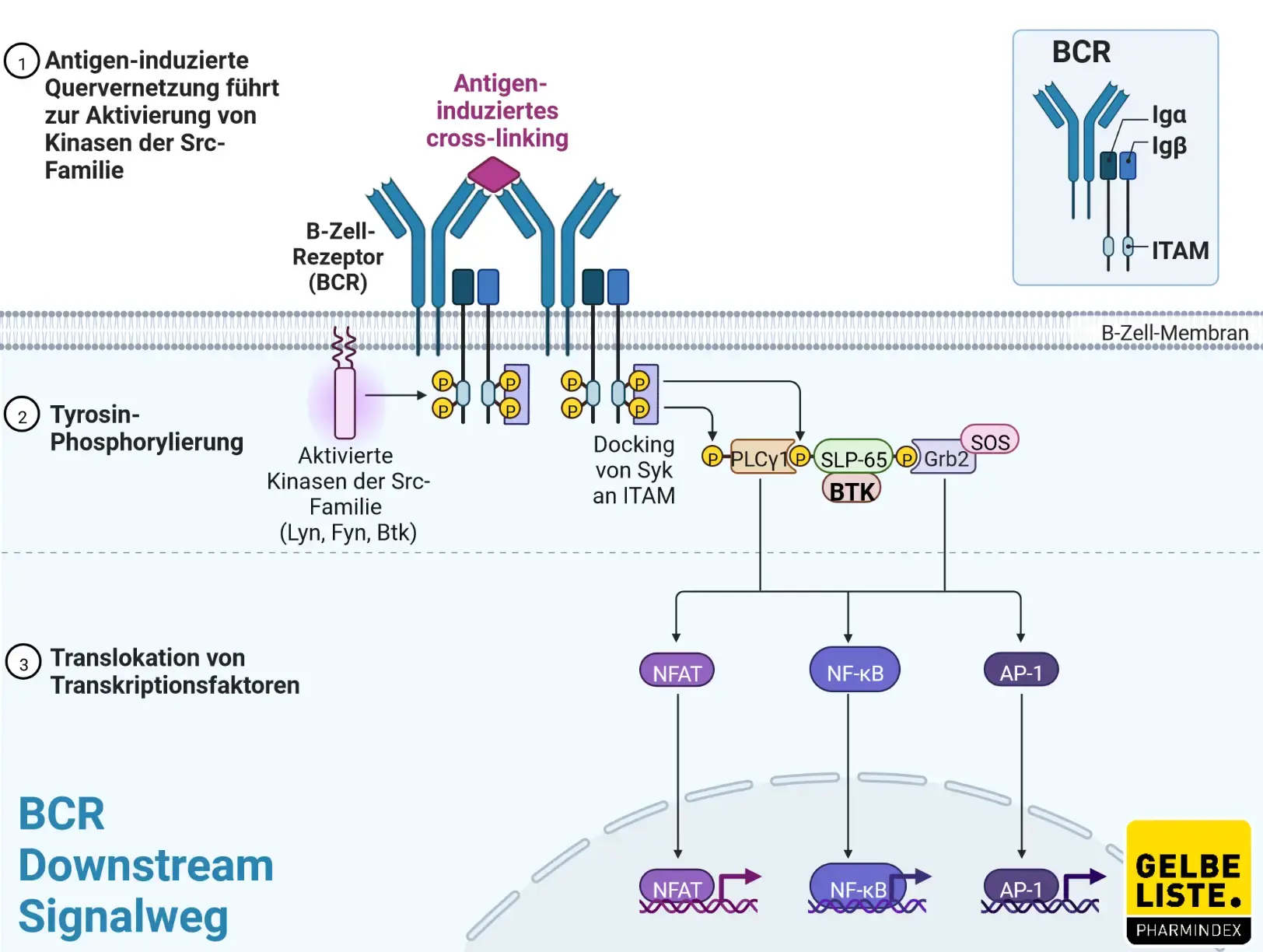
Der Wirkstoff Zanubrutinib, ist ein Bruton-Tyrosinkinase-Inhibitor. Er bindet kovalent an einen Cysteinrest im aktiven Zentrum der Bruton-Tyrosinkinase (BTK) und hemmt so die Aktivität des Enzyms. Da die BTK eine wichtige Rolle im Signalweg des B-Zell-Antigen-Rezeptors (BCR) und Zytokin-Rezeptors spielt, werden durch die Hemmung der BTK die Proliferation, Migration, Chemotaxis und Adhäsion von B-Zellen gestört.
Sowohl bei Marginalzonenlymphomen als auch CLL handelt es sich um B-Zell-Lymphome. Morbus Waldenström ist durch eine Infiltration des Knochenmarks mit monoklonalen Immunglobulin M (IgM)-sezernierenden lymphoplasmatischen Zellen gekennzeichnet, die eine konstitutive Aktivierung des B-Zell-Rezeptor-Signalwegs aufweisen. Die Aktivität des BCR-Signalwegs wird durch Zanubrutinib gehemmt.
Pharmakokinetik
Resorption
Maximale Plasmaspiegel von Zanubrutinib werden nach etwa zwei Stunden erreicht. Nach einer fettreichen Mahlzeit zeigten sich bei gesunden Probanden keine klinisch signifikanten Unterschiede in der AUC oder cmax von Zanubrutinib.
Verteilung (Distribution)
Zanubrutinib wird zu etwa 94% an Plasmaproteine gebunden, der Blut/Plasma-Quotient betrug 0,7-0,8. Das geometirsche Mittel (CV%) des scheinbaren Verteilungsvolumens des Wirkstoffs lag im Steady-State während der terminalen Phase bei 522 L (71%).
Metabolismus (Biotransformation)
Zanubrutinib wird hauptsächlich durch das Cytochrom-P450-Enzym CYP3A metabolisiert. Der Wirkstoff ist außerdem ein schwacher Induktor von CYP2B6 und CYP2C8. Zudem handelt es sich bei Zanubrutinib wahrscheinlich um ein Substrat des Effluxtransporters P-Glykoprotein (P-gp).
Elimination
Die mittlere Halbwertszeit (t½) von Zanubrutinib beträgt etwa zwei bis vier Stunden nach einer oralen Einzeldosis von 160 mg oder 320 mg. Das geometrische Mittel (CV%) der scheinbaren oralen Clearance von Zanubrutinib betrug während der terminalen Phase 128 L/h (61%).
Der BTK-Inhibitor wurde bei einer Dosis von 320 mg von gesunde Probanden zu etwa 87% über die Fäzes (38% unverändert) und zu 8% renal (<1% unverändert) eliminiert.
Dosierung
Die empfohlene Tagesdosis liegt bei 320 mg Zanubrutinib. Eine Hartkapsel enthält 80 mg des Wirkstoffs, sodass insgesamt vier Kapseln pro Tag eingenommen werden müssen. Dies kann entweder einmalig oder aufgeteilt in zwei Dosen von 160 mg zweimal täglich erfolgen.
Auftreten von Nebenwirkungen
Bei Nebenwirkungen vom Grad 3 oder höher kann eine Dosisanpassung notwendig sein. Nähere Informationen hierzu sind der Fachinformation zu entnehmen.
Begleittherapie mit Einfluss auf CYP-Enzymsystem
Die Zanubrutinib-Dosis sollte bei Kombination mit starken CYP3A4-Inhibitoren für den Zeitraum der Anwendung des Hemmers auf 80 mg reduziert werden. Bei gleichzeitiger Anwendung mäßiger CYP3A4-Inhibitoren sollte die Dosis auf 160 mg Zanubrutinib reduziert werden. Bei schwachen Inhibitoren ist keine Dosisanpassung erforderlich.
Leberfunktionsstörungen
Patienten mit starker Leberfunktionsstörung (Child-Pugh Klasse C) sollten eine reduzierte Dosis von 80 mg Zanubrutinib zweimal täglich erhalten.
Nebenwirkungen
Die folgenden Nebenwirkungen können bei der Behandlung mit Zanubrutinib sehr häufig (≥ 1/10) auftreten.
- Infektionen der oberen Atemwege
- Pneumonie
- Harnwegsinfektionen
- Neutropenie, Thrombozytopenie, Anämie
- Schwindel
- Blutergüsse, Prellungen
- Blutungen/Hämatome, Hämaturie
- Husten
- Durchfall, Verstopfung
- Schmerzen des Muskel- und Skelettsystems, Rückenschmerzen, Arthralgie
- Erschöpfung
Die am häufigsten (≥5%) auftretenden Nebenwirkungen vom Grad 3 oder höher waren Neutropenie, Pneumonie, Thrombozytopenie und Anämie.
Wechselwirkungen
Da Zanubrutinib hauptsächlich über das Enzym CYP3A4 metabolisiert wird, müssen bei der Anwendung einige Wechselwirkungen mit anderen Arzneimitteln beachtet werden.
CYP3A4-Hemmer
Bei gleichzeitiger Anwendung von Zanubrutinib und Arzneimitteln, die CYP3A4 hemmen, kann die Zanubrutinib-Exposition erhöht sein. Bei starken CYP3A4-Hemmern wie den folgenden sollte eine Dosisreduktion erfolgen:
- Itraconazol, Posaconazol, Voriconazol, Ketoconazol
- Clarithromycin
- Indinavir, Lopinavir, Ritonavir
- Telaprevier
Bei gleichzeitiger Anwendung mäßiger CYP3A4-Inhibitoren sollte die Dosis ebenfalls reduziert werden. Bei schwachen Inhibitoren ist keine Dosisanpassung erforderlich. Mäßige Hemmer sind beispielsweise:
- Erythromycin, Ciprofloxacin
- Verapamil, Diltiazem
- Dronedaron
- Fluconazol
- Aprepitant
- Imatinib
- Grapefruitsaft, Bitterorangen
CYP3A4-Induktoren
Schwache CYP3A4-Induktoren können bei gleichzeitiger Gabe von Zanubrutinib mit Vorsicht angewendet werden. Starke und mäßige CYP3A4-Induktoren können die Zanubrutinib-Exposition reduzieren und sollten vermieden werden. Dazu zählen:
CYP-Substrate
Der Wirkstoff Zanubrutinib ist ein schwacher Induktor der Enzyme CYP3A und CYP2C19. Die gleichzeitiger Anwendung mit den folgenden Substraten sollte unter Vorsicht erfolgen, da sie eine geringe therapeutische Breite aufweisen.
- Alfentanil, Fentanyl
- Ciclosporin
- Dihydroergotamin, Ergotamin
- Pimozid
- Chinidin
- Sirolimus, Tacrolimus
- S-Mephenytoin
Substrate von P-Glykoprotein
Die gleichzeitige Anwendung von Zanubrutinib mit oralen Substraten des Effluxtransporters P-Glykoprotein (P-gp), die eine geringer therapeutische Breite aufweisen (z.B. Digoxin), sollte mit Vorsicht erfolgen, da Zanubrutinib deren Konzentrationen erhöhen kann.
Kontraindikationen
Die Anwendung von Zanubritinib ist bei Überempfindlichkeit gegen den Wirkstoff kontraindiziert.
Schwangerschaft
Zanubrutinib darf in der Schwangerschaft nicht angewendet werden. Es liegen keine Erfahrungen zur Anwendung des Wirkstoffs bei Schwangeren vor. Tierexperimentelle Studien haben zudem eine Reproduktionstoxizität gezeigt.
Stillzeit
Es ist weder bekannt, ob Zanubrutinib oder seine Metaboliten in die Muttermilch übergehen, noch wurden präklinischen Studien durchgeführt. Aus diesem Grund kann ein Risiko für den Säugling nicht ausgeschlossen werden. Das Stillen sist während der Behandlung mit Zanubrutinib zu unterbrechen.
Verkehrstüchtigkeit
Zanubrutinib hat keinen oder einen zu vernachlässigenden Einfluss auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen. Bei einigen Patienten wurde unter der Therapie mit dem BTK-Inhibitor über Müdigkeit, Schwindel und Asthenie berichtet. Dies sollte berücksichtigt werden, wenn die Verkehrstüchtigkeit oder Fähigkeit zum Bedienen von Maschinen eines Patienten beurteilt wird.
Anwendungshinweise
Die Einleitung und Überwachung der Therapie mit Zanubrutinib ist durch einen Arzt mit Erfahrung in der Anwendung onkologischer Arzneimittel durchzuführen.
Blutungsrisiko & Blutbildkontrolle
Zanubrutinib kann das Risiko für Blutungen bei Patienten, die eine Therapie mit Thrombozytenaggregationshemmern oder Antikoagulanzien erhalten, erhöhen. Warfarin oder andere Vitamin-K-Antagonisten sollten nicht gleichzeitig mit Zanubrutinib angewendet werden.
Die Patienten sollten auf Anzeichen von Blutungen überwacht werden. Da während der Behandlung mit Zanubrutinib Zytopenien vom Grad 3 oder 4 auftreten können, sollte das große Blutbild während der Therapie monatlich überwacht werden.
Infektionsrisiko
Bei Patienten mit einem erhöhten Risiko für Infektionen ist eine Prophylaxe gemäß Behandlungsstandard in Betracht zu ziehen.
Vor Beginn der Behandlung mit Zanubrutinib sollte der Hepatitis B-Status des Patienten erhoben werden. Bei Patienten, die positiv auf Hepatitis-B-Virus (HBV) getestet werden oder eine positive Hepatitis-B-Serologie aufweisen, wird vor Beginn der Behandlung die Konsultation eines Spezialisten für Lebererkrankungen empfohlen.
Sonnenschutz
Die häufigsten sekundären Primärmalignome, die unter Zanubrutinib auftraten, waren Hautkrebs. Patienten sollten daher auf die Anwendung von Sonnenschutz hingewiesen werden.
Vorhofflimmern und -flattern
Patienten, insbesondere solche mit kardialen Risikofaktoren, Hypertonie und akuten Infektionen sollten auf Anzeichen und Symptome von Vorhofflimmern und Vorhofflattern überwacht und bei Bedarf entsprechend behandelt werden.
Weitere Informationen sind der jeweiligen Fachinformation zu entnehmen.
Alternativen
Die Therapie des Morbus Waldenström richtet sich nach dem Allgemeinzustand bzw. nach eventuell vorhandenen Komorbiditäten des Patienten. Für Betroffene, die mindesteins eine vorherige Therapie erhalten haben oder zur Erstlinientherapie bei Patienten, die nicht für eine Chemoimmuntherapie geeignet sind, stehen außerdem folgende Optionen zur Verfügung.
- Wiederholung der Standardtherapie (Rituximab + Chemotherapie bei Rezidiv)
- Ibrutinib (bei Rezidiv oder wenn Chemoimmuntherapie ungeeignet)
- Bortezomib + Rituximab (Off-Label-Use, nur bei Rezidiv)
- Myeloablative Hochdosistherapie mit nachfolgender autologer Stammzelltransplantation (klinisch aggressiver Verlauf bei jüngeren Patienten)
Die Behandlung der Marginalzonenlymphome richtet sich nach Lokalisation, Ausbreitung und Symptomatik. Es stehen klassische Zytostatika, zielgerichtete Tumortherapien (z. B. Rituximab) und/oder Antiinfektiva zur Verfügung.
Eine CLL kann ebenfalls mit konventioneller Chemotherapie, Antikörper-basierten Therapien (z. B. Anti-CD20-Antikörper) oder spezifischen Inhibitoren gegen bestimmte Enzyme oder Proteine (BTK, Pi3K, BCL2) behandelt werden.
Wirkstoff-Informationen
- BeiGene Ireland Limited: Fachinformation Brukinsa (Stand November 2022)
- EMA: EPAR Brukinsa (Zanubrutinib)
- DGHO: Leitlinie – Morbus Waldenström (Lymphoplasmozytisches Lymphom) (Stand: 12/2018)
- Onkopedia: Leitlinie - Chronische Lymphatische Leukämie (CLL) (Stand: 09/2020)
- Grunenberg, Buske (2016): Morbus Waldenström – Aktuelle Entwicklungen in Diagnostik und Therapie. Der Internist. DOI: 10.1007/s00108-015-0005-7
- Zucca et al. (2020): Marginal zone lymphomas: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Annals of Oncology. DOI: 10.1016/j.annonc.2019.10.01
Abbildung
Created with Biorender











