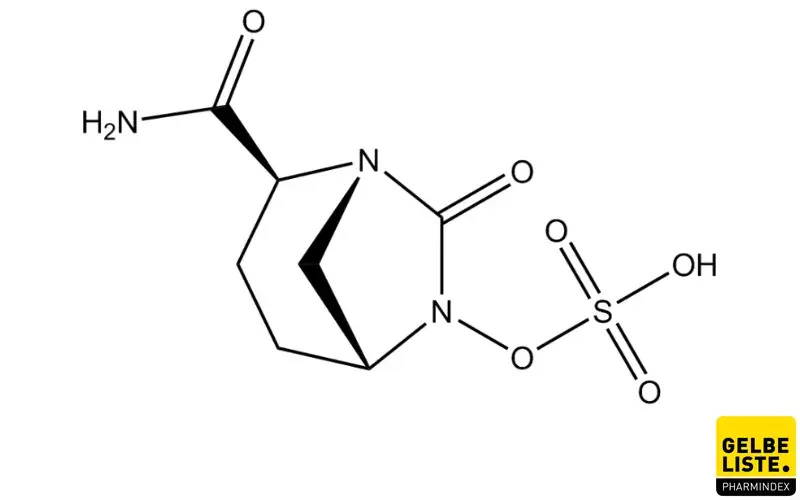
Avibactam
Avibactam wird als Wirkverstärker in Kombination mit einem Antibiotikum zur Behandlung von bakteriellen Infektionskrankheiten angewendet. Der Wirkstoff ist ein Inhibitor des Enzyms Beta-Laktamase, die für die Resistenz von Bakterien gegenüber bestimmten Antibiotika verantwortlich ist. Avibactam selbst hat keine antibakterielle Wirkung.
Avibactam : Übersicht
Anwendung
Avibactam ist in Deutschland in Kombination mit Ceftazidim unter dem Handelsnamen Zavicefta zugelassen.
Die Wirkstoffkombination wird angewendet bei Erwachsenen zur Behandlung folgender Infektionen:
- Komplizierte intraabdominelle Infektionen (cIAI)
- Komplizierte Harnwegsinfektionen (cUTI), einschließlich Pyelonephritis
- Nosokomiale Pneumonien (HAP), einschließlich beatmungsassoziierter Pneumonien (VAP)
- Bakteriämie im Zusammenhang oder bei vermutetem Zusammenhang mit einer der oben angeführten Infektionen
- Infektionen aufgrund aerober gramnegativer Erreger bei erwachsenen Patienten mit begrenzten Behandlungsoptionen
Anwendungsart
Das Arzneimittel wird als intravenöse Infusion verabreicht.
Wirkmechanismus
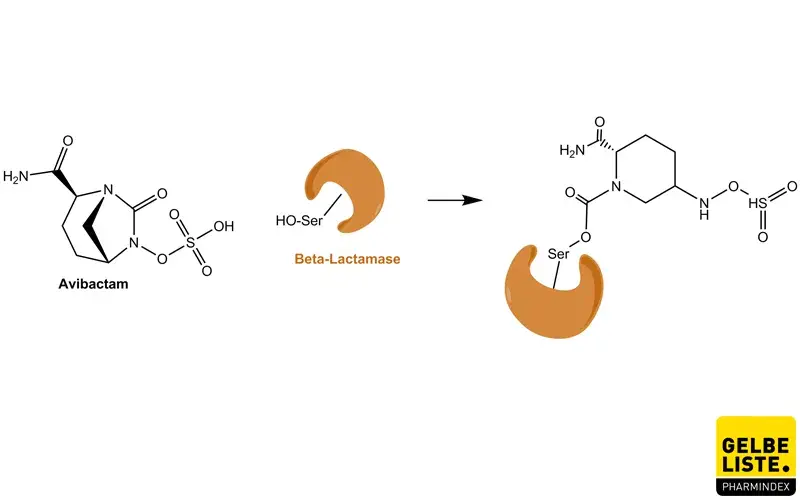
Avibactam ist ein Nicht-β-Lactam/β-Lactamase-Inhibitor, der durch die Bildung eines kovalenten Addukts mit dem Enzym agiert, das hydrolysestabil ist. Es inhibiert sowohl β-Lactamasen der Ambler-Klassifizierung A und C und einige Enzyme der Klasse D, einschließlich die Extended-Spectrum-β-lactamasen (ESBLs), KPC und OXA-48 Carbapenemasen als auch AmpC-Enzyme. Avibactam inhibiert keine Enzyme der Klasse B (Metallo-β-Lactamasen) und kann nicht viele Enzyme der Klasse D inhibieren.
Pharmakokinetik
Verteilung
Die humane Plasmaproteinbindung von Ceftazidim und Avibactam beträgt ca. 10% bzw. 8%. Die Verteilungsvolumina von Ceftazidim und Avibactam im steady state betrugen nach Mehrfachdosierung von 2000 mg / 500 mg Ceftazidim / Avibactam als Infusion über 2 Stunden alle 8 Stunden ca. 22 l bzw. 18 l bei gesunden Erwachsenen. Ceftazidim und Avibactam treten im gleichen Ausmaß in den humanen epithelialen Schleim der Lunge (epithelial lining fluid, ELF) über, wobei die Konzentrationen ca. 30% derer im Plasma betragen. Die Konzentrations-Zeit-Profile von ELF und Plasma sind ähnlich.
Biotransformation
Es wurde kein Metabolismus von Avibactam in humanen Leberpräparationen beobachtet (Mikrosome und Hepatozyten). Unverändertes Avibactam war die größte arzneimittelbezogene Komponente im humanen Plasma und Urin nach der Dosis von [14C]-Avibactam.
Elimination
Die terminale Halbwertszeit von Ceftazidim und Avibactam beträgt nach intravenöser Anwendung jeweils ca. 2 Stunden. Avibactam wird unverändert in den Urin ausgeschieden, mit einer renalen Clearance von ca. 158 ml/ min, was auf eine aktive tubuläre Sekretion zusätzlich zur glomerulären Filtration hindeutet. Ca. 97% der Avibactam-Dosis findet sich im Urin wieder, 95% innerhalb von 12 Stunden. Weniger als 0,25% Avibactam wird über den Stuhl ausgeschieden.
Linearität/ Nicht-Linearität
Die pharmakokinetischen Eigenschaften von Ceftazidim und Avibactam sind bei einer intravenösen Einzelgabe nahezu linear innerhalb des untersuchten Dosierungsbereichs (50 bis 2000 mg). Nach mehrfachen intravenösen Infusionen von 2000 mg/500 mg Ceftazidim / Avibactam, angewendet alle 8 Stunden über einen Zeitraum von bis zu 11 Tagen bei gesunden Erwachsenen mit normaler Nierenfunktion, wurde keine nennenswerte Akkumulation beobachtet.
Dosierung
Die Dosierung richtet sich nach der zu behandelnden Infektionskrankheit sowie der Kreatinin-Clearance des Patienten und kann der Fachinformation entnommen werden.
Nebenwirkungen
Zu den am häufigsten aufgetretenen unerwünschten Wirkungen der Kombinationstherapie gehören ein positiver direkter Coombs-Test, Übelkeit und Diarrhö.
Wechselwirkungen
Unter der Therapie mit Avibactam kann es bei gleichzeitiger Anwendung folgender Verbindungen zu Wechselwirkungen kommen:
- OAT-Inhibitoren: Avibactam ist in vitro ein Substrat von OAT-1 und OAT3-Transportern, was zur aktiven Aufnahme von Avibactam aus dem Blutkompartiment beitragen kann und daher seine Ausscheidung beeinflussen kann. Probenecid (ein potenter OAT-Inhibitor) inhibiert diese Aufnahme in vitro um 56% bis 70% und hat daher das Potenzial, die Eliminierung von Avibactam zu verändern.
- hochdosierte Cephalosporine und nephrotoxische Arzneimittel: Die begleitende Behandlung mit hochdosierten Cephalosporinen und nephrotoxischen Arzneimitteln wie Aminoglykosiden oder potenten Diuretika (z. B. Furosemid) kann die Nierenfunktion nachteilig beeinträchtigen.
Chloramphenicol wirkt in vitro antagonistisch gegenüber Ceftazidim und anderen Cephalosporinen. Die klinische Relevanz dieses Befundes ist unbekannt, jedoch sollte diese Arzneimittelkombination aufgrund der Möglichkeit eines Antagonismus in vivo vermieden werden.
Kontraindikation
Die Kombination aus Avibactam und Ceftazidim darf nicht angewendet werden bei:
- Überempfindlichkeit gegen die Wirkstoffe
- Überempfindlichkeit gegen jegliche Cephalosporin-Antibiotika
- Schwere Überempfindlichkeitsreaktion (z. B. anaphylaktische Reaktion, schwere Hautreaktion) gegen jegliche andere Art von Betalactam-Antibiotika (z. B. Penicilline, Monobactame oder Carbapeneme)
Schwangerschaft
Tierexperimentelle Studien mit Avibactam haben eine Reproduktionstoxizität ohne den Nachweis teratogener Auswirkungen gezeigt. Ceftazidim/Avibactam sollte während der Schwangerschaft nur angewendet werden, wenn der potenzielle Nutzen das mögliche Risiko überwiegt.
Stillzeit
Es ist nicht bekannt, ob Avibactam in die menschliche Muttermilch ausgeschieden wird. Ein Risiko für Neugeborene/Säuglinge kann nicht ausgeschlossen werden. Unter Berücksichtigung des Nutzens für das Kind, gestillt zu werden, und des Nutzens einer Therapie für die Mutter muss eine Entscheidung getroffen werden, ob abgestillt oder die Behandlung unterbrochen bzw. von einer Behandlung mit Ceftazidim/Avibactam abgesehen wird.
Verkehrstüchtigkeit
Es können nach der Anwendung von Zavicefta Nebenwirkungen auftreten (z. B. Schwindel), die sich auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen auswirken.
Anwendungshinweise
Niereninsuffizienz
Die Elimination von Ceftazidim und Avibactam ist bei Patienten mit einer mittleren bis schweren Niereninsuffizienz, herabgesetzt. Die Avibactam AUC ist bei Probanden mit einer mittleren bis schweren Niereninsuffizienz im Durchschnitt 3,8-fach bzw. 7-fach erhöht. Neurologische Folgeerkrankungen, einschließlich Tremor, Myoklonie, nicht-konvulsiver Status Epilepticus, Konvulsion, Enzephalopathie und Koma, wurden gelegentlich im Zusammenhang mit der Anwendung von Ceftazidim berichtet, wenn die Dosis bei Patienten mit Niereninsuffizienz nicht reduziert wurde.
Bei Patienten mit Niereninsuffizienz wird eine engmaschige Überwachung der geschätzten Kreatinin-Clearance empfohlen. Bei einigen Patienten kann sich insbesondere zu Beginn der Infektionsbehandlung die Kreatinin-Clearance, die aus dem Serum-Kreatinin bestimmt wird, rasch ändern.











