Bortezomib
Bortezomib ist ein Proteasom-Inhibitor, der zur Behandlung des Multiplen Myeloms und Mantelzell-Lymphoms angewendet wird. Der Wirkstoff wird als Mono- oder Kombinationstherapie nach speziellen Behandlungszyklen subkutan oder intravenös injiziert.
Bortezomib : Übersicht

Anwendung
Bortezomib ist der erste zugelassene Proteasom-Inhibitor, der als Mono- oder Kombinationstherapie in folgenden Indikationsgebieten angewendet wird.
- Progressives Multiples Myelom als Monotherapie oder in Kombination mit Doxorubicin oder Dexamethason bei Erwachsenen, die mindestens eine vorangegangene Therapie durchlaufen und sich bereits einer hämatopoetischen Stammzelltransplantation unterzogen haben oder für diese nicht geeignet sind
- Bisher unbehandeltes Multiples Myelom in Kombination mit Melphalan und Prednison bei Erwachsenen, die für eine Hochdosis-Chemotherapie mit hämatopoetischer Stammzelltransplantation ungeeignet sind
- Induktionsbehandlung bei bisher unbehandeltem Multiplen Myelom in Kombination mit Dexamethason oder Dexamethason und Thalidomid bei Erwachsenen, die für eine Hochdosis-Chemotherapie mit hämatopoetischer Stammzelltransplantation ungeeignet sind
- Bisher unbehandeltes Mantelzell-Lymphom in Kombination mit Rituximab, Cyclophosphamid, Doxorubicin und Prednison bei Erwachsenen, die für eine hämatopoetische Stammzelltransplantation ungeeignet sind
Anwendungsart
Die Behandlung darf nur unter Aufsicht eines in der Krebstherapie erfahrenen Arztes initiiert werden. Bortezomib ist in Form eines Mannitol-Boronsäureesters als Pulver zur Herstellung einer Injektionslösung oder als fertige Injektionslösung im Handel. Die Applikation erfolgt nach Zubereitung abhängig von der Konzentration der Lösung als subkutane oder intravenöse Injektion.
Wirkmechanismus
Bortezomib ist ein reversibler und hoch selektiver Inhibitor der Chymotrypsin-ähnlichen Aktivität der 26S-Proteasome.
Proteasome sind intrazelluläre Multiproteasekomplexe, die am Abbau zahlreicher Proteine beteiligt sind. Dieser Mechanismus ist essenziell für den Zyklus und das Überleben der Zellen. Die Hemmung der Proteasome führt demnach zu einer Vielzahl von Effekten.
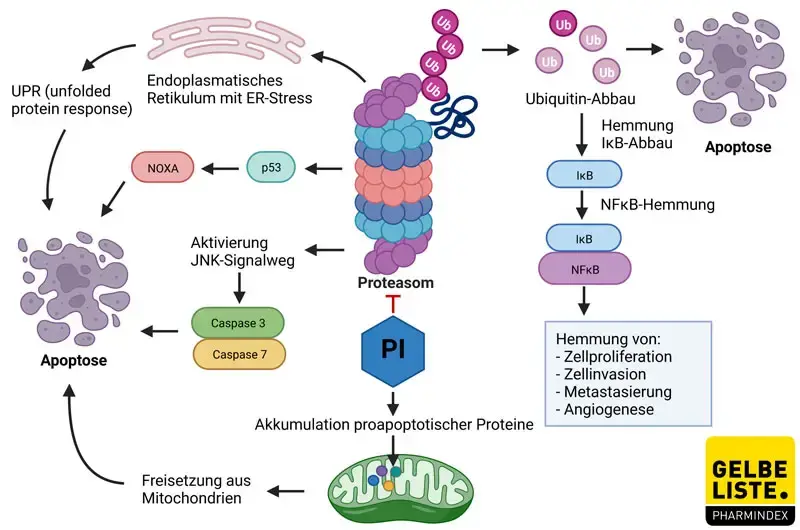
Hemmung des NFκB-Signalwegs
Ein wichtiger Mechanismus ist die Inhibition des NFκB-Signalwegs. Durch einen erhöhten Ubiquitin-Abbau bleibt das Protein IκB intakt, das NFκB bindet und dadurch hemmt. Auf diese Weise kommt es zur Downregulation verschiedener NFκB-vermittelter Mechanismen, wie der Zellproliferation, Invasion, Metastasierung und Angiogenese.
Signalwege des programmierten Zelltods
Die Proteasom-Hemmung führt außerdem zur Aktivierung der c-Jun NH2-terminalen Kinase (JNK), die über verschiedene Caspasen zum programmierten Zelltod führt. Auch das Tumorsuppressorprotein p53 wird durch Proteasom-Inhibitoren (PI) aktiviert und führt über das proapoptotische NOXA sowie Caspasen letztendlich zur Apoptose. Das gilt auch bei Anwesenheit von p53-Mutanten. NOXA kann zudem unabhängig von p53 induziert werden. Auch weitere proapoptotische Proteine (z.B. Bim, Bid, Bik), die im Normalfall durch die Proteasomen reguliert werden, akkumulieren und induzieren den Zelltod.
ER-Stress
Die Hemmung der Multiproteasekomplexe führt zu einer gesteigerten Ansammlung defekter Proteine in der Zelle. Auch die Krebserkrankung selbst kann eine erhöhte Produktion von Proteinen verursachen. Proteine werden in der Regel im Endoplasmatischen Retikulum (ER) zusammengebaut und einer Qualitätskontrolle unterzogen, falsch gefaltete Proteine werden den Proteasomen zugeführt. Bei einer zu großen Proteinmenge gerät das ER unter Stress, der bei Proteasom-Hemmung durch die Ansammlung falsch gefalteter Proteine verstärkt wird. Dies löst die sogenannte UPR (Unfolded Protein Response) aus, die einerseits die Proteinsynthese reduziert und bei starkem ER-Stress auch Apoptose auslösen kann.
Tumorzellen empfindlicher
Es konnte gezeigt werden, dass Tumorzellen empfindlicher gegenüber Proteasom-Inhibitoren sind, oft ist eine partielle Hemmung der Proteasomenfunktion für die antiturmorale Aktivität ausreichend. Myelomzellen haben beispielsweise einen gesteigerten Proteinumsatz und daher eine höhere Apoptose-Wahrscheinlichkeit bei Proteasom-Hemmung.
Weitere Mechanismen
Weiterhin beeinflusst Bortezomib die Fähigkeit der Myelomzellen, mit dem Knochenmarkmikromilieu in Wechselwirkung zu treten. Daten aus in-vitro-, ex-vivo- und Tier-Modellen mit Bortezomib deuten zudem darauf hin, dass der Wirkstoff die Differenzierung und Aktivität von Osteoblasten erhöht und die Funktion von Osteoklasten inhibiert. Diese Effekte wurden auch bei Patienten mit multiplem Myelom, die unter einer fortgeschrittenen osteolytischen Erkrankung leiden und die mit Bortezomib behandelt wurden, beobachtet.
Pharmakokinetik
Resorption
Bortezomib wird als Peptid intravenös oder subkutan verabreicht. Nach intravenöser Bolusgabe oder subkutaner Injektion bei Patienten mit Multiplem Myelom konnte eine äquivalente systemische Gesamtexposition nach wiederholter Dosisgabe beobachtet werden. Die maximale Plasmakonzentration war bei subkutaner Applikation geringer als bei intravenöser Gabe.
Verteilung (Distribution)
Nach intravenöser Gabe verteilt sich Bortezomib breit im peripheren Gewebe, das mittlere Verteilungsvolumen liegt zwischen 1.659 L und 3.294 L. Etwa 82,9% des Wirkstoffs sind konzentrationsunabhängig an Plasmaproteine gebunden.
Metabolismus (Biotransformation)
Bortezomib wird insbesondere über die Cytochrom-P450-Enzyme CYP3A4, CYP2C19 und CYP1A2 oxidativ metabolisiert. Hauptweg der Biotransformation ist die Deboronierung zu zwei Metaboliten, die anschließend weiter verstoffwechselt werden. Die deboronierten Metaboliten zeigen keine pharmakologische Aktivität.
Elimination
Nach Mehrfachdosierung reichte die mittlere Eliminationshalbwertszeit von Bortezomib von 40 bis 193 Stunden. Der Wirkstoff wird nach der ersten Dosis im Vergleich zu wiederholten Dosen schneller eliminiert.
Dosierung
Die fertige intravenöse Injektionslösung enthält 1 mg/ml Bortezomib, die subkutane Injektionslösung nach Zubereitung 2,5 mg/ml des Wirkstoffs.
Bortezomib wird je nach Indikationsgebiet und Kombinationspartnern in drei- bis sechswöchigen Behandlungszyklen angewendet. Es wird eine Dosis von 1,3 mg/m2 Körperoberfläche empfohlen. Der Wirkstoff wird in der Regel ein- bis zweimal wöchentlich über zwei Wochen verabreicht, wobei zwischen den Bortezomib-Dosen mindestens 72 Stunden liegen sollten. In der sogenannten Ruhephase der dritten bzw. sechsten Woche erfolgt eine Behandlungspause. Die Anzahl der Behandlungszyklen richtet sich nach der Indikation und dem Ansprechen der Patienten.
Dosisanpassung
Bei Patienten mit mäßiger oder schwerer Leberfunktionsstörung wird eine reduzierte Anfangsdosis empfohlen. Diese Patienten sollen engmaschig überwacht werden.
Die Behandlung mit Bortezomib muss bei Auftreten jeglicher nicht-hämatologischer Toxizitäten des Schweregrades 3 oder jeglicher hämatologischer Toxizitäten des Schweregrades 4 mit Ausnahme einer Neuropathie ausgesetzt werden. Nach Abklingen der Toxizitätssymptome kann die Behandlung mit einer um 25% reduzierten Dosis erneut aufgenommen werden (1,0 mg/m2 bzw. 0,7 mg/m2). Wenn die Toxizitätsreaktion nicht abklingt oder auch bei der niedrigsten Dosierung erneut auftritt, muss ein Abbruch der Therapie in Betracht gezogen werden, außer der Nutzen der Behandlung übersteigt eindeutig das Risiko.
Bei neuropathischen Schmerzen und/oder peripheren Neuropathien muss die Dosis reduziert oder die Behandlung unterbrochen bzw. abgebrochen werden.
Wenn Bortezomib in Kombination mit anderen chemotherapeutischen Arzneimitteln gegeben wird, sollen zudem im Falle von Toxizitäten geeignete Dosisreduktionen für diese Wirkstoffe, gemäß den Empfehlungen in den Fachinformationen, in Betracht gezogen werden.
Nebenwirkungen
Zu den bei einer Bortezomib-Behandlung am häufigsten auftretenden Nebenwirkungen zählen:
- Übelkeit, Erbrechen
- Diarrhoe, Obstipation
- Müdigkeit, Fieber
- Thrombozytopenie, Anämie, Neutropenie, periphere Neuropathie (einschließlich sensorischer Neuropathie)
- Kopfschmerz
- Parästhesie
- Verminderter Appetit
- Dyspnoe
- Hautausschlag
- Herpes zoster
- Myalgie
Gelegentlich (≥ 1/1.000 bis < 1/100) kann es unter der Therapie mit Bortezomib zu den folgenden schwerwiegenden Nebenwirkungen kommen.
- Herzversagen
- Tumor-Lyse-Syndrom
- Pulmonale Hypertonie
- Posteriores reversibles Enzephalopathiesyndrom
- Akute diffus infiltrative Lungenerkrankungen
- Selten (≥ 1/10.000 bis < 1/1.000) autonome Neuropathie
Bei der Kombinationstherapie des Mantelzell-Lymphoms mit Bortezomib und weiteren Wirkstoffen traten folgende zusätzliche Nebenwirkungen auf.
- Hepatitis-B-Infektion (< 1%)
- Myokardischämie (1,3%)
- Erhöhte Inzidenz für hämatologische Nebenwirkungen, periphere sensorische Neuropathie, Hypertonie, Pyrexie, Pneumonie, Stomatitis und Haarwuchsstörungen
Wechselwirkungen
Bortezomib selbst ist ein schwacher Inhibitor der Cytochrom-P40-Enzyme CYP1A2, CYP2C9, CYP2C19, CYP2D6, CYP3A4 und wird über CYP3A4, CYP2C19 sowie CYP1A2 metabolisiert. Daher sind die folgenden Interaktionen zu beachten.
- CYP3A4-Inhibitoren (z.B. Ketoconazol, Ritonavir): erhöhte Wirkspiegel von Bortezomib möglich, daher engmaschige Überwachung empfohlen
- CYP3A4-Induktoren (z.B. Rifampicin, Johanniskraut, Phenytoin): verringerte Wirksamkeit möglich, Anwendung wird nicht empfohlen
Diabetiker, die orale Antidiabetika einnehmen, haben unter der Therapie mit Bortezomib ein erhöhtes Risiko für Hypo- und Hyperglykämien. Daher sollten bei diesen Patienten die Blutzuckerwerte engmaschig überwacht und ggf. die Dosierungen der Antidiabetika angepasst werden.
Kontraindikationen
Bei der Behandlung mit Bortezomib sind die folgenden Kontraindikationen zu beachten.
- Überempfindlichkeit gegen den Wirkstoff oder Bor
- Akute diffus infiltrative pulmonale und perikardiale Erkrankung
- Zusätzliche Kontraindikationen der Wirkstoffe bei einer Kombinationstherapie
Schwangerschaft
Das teratogene Potential von Bortezomib wurde noch nicht abschließend untersucht, daher liegen bisher keine klinischen Daten zur Anwendung des Wirkstoffs in der Schwangerschaft vor. In Tierstudien zeigte Bortezomib keine Wirkung auf die embryonale Entwicklung.
Der Wirkstoff darf in der Schwangerschaft nicht angewendet werden, es sei denn eine Behandlung ist aufgrund des klinischen Zustandes der Frau erforderlich.
Zu beachten ist bei einer Kombinationsbehandlung insbesondere die Kontraindikation in der Schwangerschaft von Thalidomid.
Stillzeit
Es ist nicht bekannt, ob Bortezomib in die Muttermilch übergeht, allerdings besteht prinzipiell die Möglichkeit, dass schwerwiegende Nebenwirkungen bei gestillten Kindern auftreten. Aus diesem Grund soll während der Behandlung mit Bortezomib abgestillt werden.
Verkehrstüchtigkeit
Die Behandlung mit Bortezomib kann aufgrund von Nebenwirkungen wie Ermüdung, Schwindel, Ohnmachtsanfällen, orthostatischer posturaler Hypotonie oder verschwommenem Sehen die Verkehrstüchtigkeit sowie die Fähigkeit zum Bedienen von Maschinen beeinträchtigen. Daher müssen die Patienten darauf hingewiesen werden, beim Auftreten solcher Symptome kein Fahrzeug zu führen oder Maschinen zu bedienen.
Anwendungshinweise
Da es sich bei Bortezomib um eine zytotoxische Substanz handelt, sollte die Herstellung der Injektionslösung unter aseptischen Bedingungen durch pharmazeutisches oder medizinisches Fachpersonal erfolgen. Das Pulver wird je nach Applikationsart in unterschiedlichen Mengen 0,9%iger Kochsalzlösung für Injektionszwecke gelöst. Präparate mit einer gebrauchsfertigen Injektionslösung können zur subkutanen und nach Verdünnen auch zur intravenösen Injektion angewendet werden.
Die gebrauchsfertige Lösung soll sofort verwendet werden und ist über maximal 8 Stunden bei 25 °C stabil.
Bortezomib darf nicht intrathekal angewendet werden, da bereits Fälle mit letalem Ausgang nach unbeabsichtigter intrathekaler Applikation auftraten.
Prophylaxe
Bei der Anwendung von Bortezomib wird eine antivirale Prophylaxe empfohlen, um das Risiko einer Herpes-zoster-Reaktivierung zu verringern.
Unter der Therapie mit Bortezomib wurde selten über akute infiltrative Lungenerkrankungen unbekannter Ätiologie wie Pneumonitis, interstitielle Pneumonie, Lungeninfiltration und Acute Respiratory Distress Syndrom (ARDS) berichtet. Einige dieser Ereignisse verliefen letal. Vor Behandlungsbeginn wird daher ein Röntgenthorax empfohlen, um als Ausgangsbefund für mögliche pulmonale Veränderungen nach der Behandlung zu dienen.
Überwachung
Patienten, bei denen Obstipation auftritt, sollten sorgfältig überwacht werden, da gelegentlich ein Ileus auftreten kann.
Blutbild
Während der gesamten Behandlung mit Bortezomib sollte das Differentialblutbild engmaschig kontrolliert werden. Falls klinisch angemessen, soll eine Thrombozytentransfusion in Betracht gezogen werden.
In Verbindung mit der Behandlung mit Bortezomib wurde über gastrointestinale und intrazerebrale Blutungen berichtet. Daher soll die Thrombozytenzahl vor jeder Gabe des Wirkstoffs kontrolliert werden. Wenn die Thrombozytenzahl <25.000/μl oder im Fall der Kombination mit Melphalan und Prednison ≤30.000/μl ist, sollte die Therapie ausgesetzt werden. Der Behandlungsnutzen sollte sorgfältig gegen die Risiken abgewogen werden, besonders in Fällen moderater bis schwerer Thrombozytopenie und Blutungsrisiken.
Bei Patienten mit Mantelzell-Lymphom wurde eine vorübergehende Neutropenie beobachtet, die zwischen den Behandlungszyklen reversibel war und keine Anzeichen einer kumulativen Neutropenie zeigte. Da Patienten mit Neutropenie ein erhöhtes Infektionsrisiko haben, sollen sie auf Anzeichen und Symptome einer Infektion überwacht und gegebenenfalls unverzüglich behandelt werden. Bei hämatologischer Toxizität können Granulozyten-Kolonie stimulierende Faktoren gemäß dem lokalen Standard angewendet werden. Im Falle wiederholter Verzögerungen bei der Anwendung der Zyklen soll eine prophylaktische Anwendung von Granulozyten-Kolonie stimulierenden Faktoren in Betracht gezogen werden.
Neuropathie-Symptome
Bei Patienten, die Bortezomib in Kombination mit Arzneimitteln erhalten, die bekanntermaßen mit Neuropathien verbunden sind (z. B. Thalidomid), sollte eine frühe und regelmäßige Überwachung von Symptomen einer behandlungsbedingten Neuropathie (Gefühl von Brennen, Hyperästhesie, Hypoästhesie, Parästhesie, Unwohlsein, neuropathischer Schmerz oder Schwäche) mit neurologischer Untersuchung in Betracht gezogen werden. Patienten mit neu auftretender oder sich verschlechternder peripherer Neuropathie benötigen möglicherweise eine Anpassung der Dosis oder Änderung des Anwendungsschemas oder Umstellung auf die subkutane Anwendung.
Alternativen
Neben Bortezomib sind die Proteasom-Inhibitoren Carflizomib und Ixazomib zur Therapie des Multiplen Myeloms zugelassen. Während Carflizomib ebenfalls intravenös verabreicht wird, kann Ixazomib oral eingenommen werden.
Weitere Informationen sind der jeweiligen Fachinformation zu entnehmen.
Wirkstoff-Informationen
- Geisslinger, Menzel, Gundermann, Hinz, Ruth (2020) Mutschler Arzneimittelwirkungen, 11. Auflage, Wissenschaftliche Verlagsgesellschaft Stuttgart
- Steinhilber, Schubert-Zsilavecz, Roth (2010) Medizinische Chemie, 2. Auflage, Deutscher Apotheker Verlag Stuttgart
- Janssen-Cilag GmbH: Fachinformation VELCADE® 3,5 mg Pulver zur Herstellung einer Injektionslösung (02/2019)
- STADAPHARM GmbH: Fachinformation Bortezomib STADA® 2,5 mg/ml Injektionslösung (02/2020)
- Nunes AT, Annunziata CM. Proteasome inhibitors: structure and function. Semin Oncol. 2017 Dec;44(6):377-380. DOI: 10.1053/j.seminoncol.2018.01.004
Abbildung
Created with BioRender.com
-
Bortezomib Accord 3,5 mg BB Farma Pulver zur Herstellung einer Injektionslösung
BB Farma S.R.L.
-
Bortezomib Accord 3,5 mg Orifarm Pulver zur Herstellung einer Injektionslösung
Orifarm GmbH
-
Bortezomib beta 3,5 mg Pulver zur Herstellung einer Injektionslösung
betapharm Arzneimittel GmbH
-
Bortezomib Cipla 3,5 mg Pulver zur Herstellung einer Injektionslösung
Cipla Europe NV
-
Bortezomib Denk 3,5 mg Pulver zur Herstellung einer Injektionslösung
Denk Pharma GmbH & Co. KG
-
Bortezomib HEXAL 2,5 mg BB Farma Pulver zur Herstellung einer Injektionslösung
BB Farma S.R.L.
-
Bortezomib HEXAL® 2,5 mg Pulver zur Herstellung einer Injektionslösung
Hexal AG
-
Bortezomib HEXAL® 3,5 mg Pulver zur Herstellung einer Injektionslösung
Hexal AG
-
Bortezomib Hikma 3,5 mg Pulver zur Herstellung einer Injektionslösung
Hikma Pharma GmbH
-
Bortezomib Hospira 3,5 mg Pulver zur Herstellung einer Injektionslösung
Pfizer Pharma GmbH
-
Bortezomib medac 2,5 mg Pulver zur Herstellung einer Injektionslösung
medac Gesellschaft für klinische Spezialpräparate mbH
-
Bortezomib medac 3,5 mg Pulver zur Herstellung einer Injektionslösung
medac Gesellschaft für klinische Spezialpräparate mbH
-
Bortezomib Mylan 3,5 mg Pulver zur Herstellung einer Injektionslösung
Viatris Healthcare GmbH
-
Bortezomib onkovis 3,5 mg Pulver zur Herstellung einer Injektionslösung
Onkovis GmbH
-
Bortezomib PUREN 3,5 mg Pulver zur Herstellung einer Injektionslösung
PUREN Pharma GmbH & Co. KG
-
Bortezomib-ratiopharm® 3,5 mg Pulver zur Herstellung einer Injektionslösung
ratiopharm GmbH
-
Bortezomib STADA 2,5 mg/ml BB Farma Injektionslösung, 1,4 ml
BB Farma S.R.L.
-
Bortezomib STADA 2,5 mg/ml CC Pharma Injektionslösung
CC Pharma GmbH
-
Bortezomib STADA 2,5 mg/ml Eurim Injektionslösung
Eurim-Pharm Arzneimittel GmbH
-
Bortezomib STADA® 2,5 mg/ml Injektionslösung, 1,4 ml
STADAPHARM GmbH
-
Bortezomib STADA® 2,5 mg/ml Injektionslösung, 2,8 ml
STADAPHARM GmbH
-
Bortezomib SUN 3,5 mg Pulver zur Herstellung einer Injektionslösung
Sun Pharmaceuticals Germany GmbH
-
Bortezomib Zentiva 2,5 mg Pulver zur Herstellung einer Injektionslösung
Zentiva Pharma GmbH
-
Bortezomib Zentiva 3,5 mg Pulver zur Herstellung einer Injektionslösung
Zentiva Pharma GmbH
-
Velcade 3,5 mg Aaston Pulver zur Herstellung einer Injektionslösung
Aaston Healthcare GmbH
-
Velcade 3,5 mg Canoma Pulver zur Herstellung einer Injektionslösung
Canoma Pharma GmbH
-
Velcade 3,5 mg hvd Pulver zur Herstellung einer Injektionslösung
hvd medical GmbH
-
VELCADE® 3,5 mg Pulver zur Herstellung einer Injektionslösung
Janssen-Cilag GmbH














