Carfilzomib
Carfilzomib ist ein Proteasom-Inhibitor, der als Kombinationstherapie zur Behandlung des Multiplen Myeloms indiziert ist. Der Wirkstoff hemmt den Abbau verschiedenster Proteine und führt so über zahlreiche Effekte zur Apoptose der Myelomzellen.
Carfilzomib: Übersicht

Anwendung
Carfilzomib ist in Kombination mit folgenden Arzneistoffen indiziert zur Behandlung des Multiplen Myeloms bei erwachsenen Patienten, die zuvor mindestens eine andere Therapie erhalten haben.
- Dexamethason
- Dexamethason + Daratumumab
- Dexamethason + Lenalidomid
Anwendungsart
Carfilzomib steht als Pulver (Lyophilisat) zur Herstellung einer Infusionslösung zur Verfügung. Die fertige Lösung wird je nach Dosis über 10 Minuten (20/27 mg/m2) oder 30 Minuten (20/56 mg/m2) intravenös infundiert. Die Infusionsleitung muss unmittelbar vor und nach der Infusion mit isotonischer Natriumchloridlösung oder 5%iger Glucoselösung zur Injektion gespült werden.
Carfilzomib darf nicht als intravenöse Injektion oder Bolus angewendet und nicht mit anderen Arzneimitteln gemischt werden.
Wirkmechanismus
Carfilzomib ist ein selektiver und irreversibler Proteasom-Inhibitor, der an die N-terminalen, Threonin-enthaltenden aktiven Zentren des 20S-Proteasoms bindet. Bei diesem handelt es sich um den proteolytischen Kernpartikel des 26S-Proteasoms. Carfilzomib zeigt geringe bis keine Aktivität gegenüber anderen Protease-Klassen.
Proteasome sind intrazelluläre Multiproteasekomplexe, die am Abbau zahlreicher Proteine beteiligt sind. Dieser Mechanismus ist essenziell für den Zyklus und das Überleben der Zellen. Die Hemmung der Proteasome führt demnach zu einer Vielzahl von Effekten.
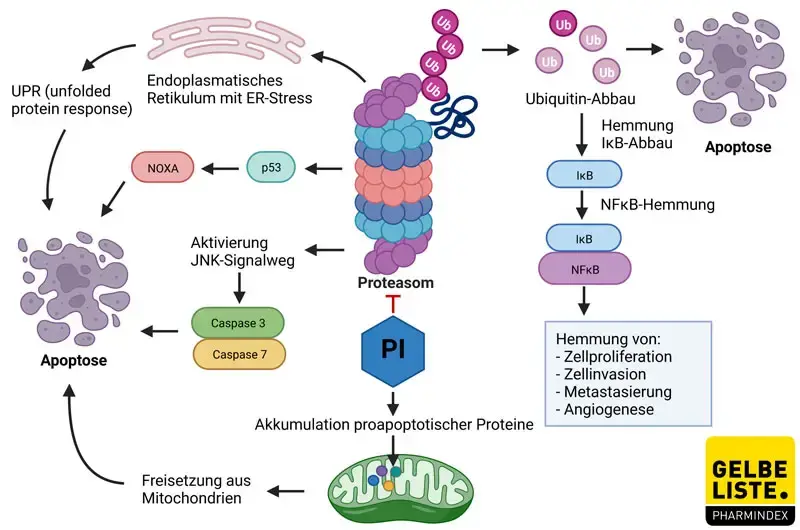
Hemmung des NFκB-Signalwegs
Ein wichtiger Mechanismus ist die Inhibition des NFκB-Signalwegs. Durch einen erhöhten Ubiquitin-Abbau bleibt das Protein IκB intakt, das NFκB bindet und dadurch hemmt. Auf diese Weise kommt es zur Downregulation verschiedener NFκB-vermittelter Mechanismen, wie der Zellproliferation, Invasion, Metastasierung und Angiogenese.
Signalwege des programmierten Zelltods
Die Proteasom-Hemmung führt außerdem zur Aktivierung der c-Jun NH2-terminalen Kinase (JNK), die über verschiedene Caspasen zum programmierten Zelltod führt. Auch das Tumorsuppressorprotein p53 wird durch Proteasom-Inhibitoren (PI) aktiviert und führt über das proapoptotische NOXA sowie Caspasen letztendlich zur Apoptose. Das gilt auch bei Anwesenheit von p53-Mutanten. NOXA kann zudem unabhängig von p53 induziert werden. Auch weitere proapoptotische Proteine (z.B. Bim, Bid, Bik), die im Normalfall durch die Proteasomen reguliert werden, akkumulieren und induzieren den Zelltod.
ER-Stress
Die Hemmung der Multiproteasekomplexe führt zu einer gesteigerten Ansammlung defekter Proteine in der Zelle. Auch die Krebserkrankung selbst kann eine erhöhte Produktion von Proteinen verursachen. Proteine werden in der Regel im Endoplasmatischen Retikulum (ER) zusammengebaut und einer Qualitätskontrolle unterzogen, falsch gefaltete Proteine werden den Proteasomen zugeführt. Bei einer zu großen Proteinmenge gerät das ER unter Stress, der bei Proteasom-Hemmung durch die Ansammlung falsch gefalteter Proteine verstärkt wird. Dies löst die sogenannte UPR (Unfolded Protein Response) aus, die einerseits die Proteinsynthese reduziert und bei starkem ER-Stress auch Apoptose auslösen kann.
Pharmakokinetik
Resorption
In einem Dosisbereich von 15 bis 27 mg/m2 bei einer Infusionsdauer von 2 bis 10 Minuten blieben die maximale Plasmakonzentration sowie die AUC über den ersten Behanldungszyklus ähnlich, was darauf hindeutet, das Carfilzomib nicht systemisch akkumuliert. Bei höheren Dosierungen (bis 56 mg/m2) kam es zu einer dosisabhängigen Expositionssteigerung.
Eine 30-minütige Infusion einer Dosis von 27 mg/m2 führte zu einer vergleichbaren Halbwertszeit und AUC. Eine Dosierung von 56 mg/m2 führte zu einer etwa 2,5-fach erhöhten AUC und niedrigeren maximalen Plasmakonzentration als eine 2- bis 10-minütigen Infusion einer Dosierung von 27 mg/m2.
Verteilung (Distribution)
Carfilzomib bindet zu etwa 97% an Plasmaproteine. Das mittlere Verteilungsvolumen im Steady-State bei einer Dosis von 20 mg/m2 beträgt 28 L.
Metabolismus (Biotransformation)
Die Metabolisierung von Carfilzomib erfolgt schnell und umfangreich. Aufgrund der Spaltung durch Peptidasen und die Hydrolyse der Epoxide entstehen insbesondere Peptidfragmente und das Diol von Carfilzomib. Das Cytochrom-P450-Enzymsystem spielt eine untergeordnete Rolle in der Biotransformation des Protease-Inhibitors. Die Metaboliten weisen keine biologische Aktivität auf.
Elimination
Die Halbwertszeit von Dosierungen ≥15 mg/m2 liegt bei maximal einer Stunde am ersten Tag des ersten Zyklus. Die systemische Elimination beträgt 151 bis 263 L/Stunde und erfolgt überwiegend extrahepatisch. Carfilzomib wird in Form der Metaboliten vorwiegend über den Urin ausgeschieden.
Dosierung
Die Dosis wird zu Therapiebeginn anhand der Körperoberfläche (KOF) des Patienten berechnet. Patienten, die eine KOF >2,2 m2 haben, sollten eine Dosierung erhalten, die einer KOF von 2,2 m2 entspricht.
In Kombination mit Dexamethason und Lenalidomid wird Carfilzomib als 10-minütige Infusion verabreicht. Die initiale Dosis an den ersten beiden Tagen des Behandlungszyklus sollte bei 20 mg/m2 liegen (maximal Dosis von 44 mg). Wird diese toleriert, kann eine Erhöhung der Dosis auf 27 mg/m2 erfolgen (maximale Dosis von 60 mg).
In Kombination mit Dexamethason sowie Dexamethason und Daratumumab wird Carfilzomib als 30-minütige Infusion appliziert. Die Anfangsdosis an den ersten beiden Tagen des Behandlungszyklus beträgt ebenfalls 20 mg/m2, während die Dosis später auf 56 mg/m2 (maximale Dosis von 123 mg) erhöht wird.
Ein Behandlungszyklus entspricht in der Regel einer Dauer von 28 Tagen. Die Häufigkeit der Gabe von Carfilzomib ist abhängig von der jeweiligen Kombinationstherapie sowie der Anzahl vorangegangener Zyklen. Die genauen Dosierungen der jeweiligen Therapieschemata können der Fachinformation entnommen werden.
Dosisanpassung
Ab einer Gewichtsänderung von mehr als 20% ist eine Dosisanpassung erforderlich.
Auch beim Auftreten entsprechender Carfilzomib-Toxizitäten kann eine Dosisanpassung erforderlich sein. Zunächst sollte die Behandlung jedoch gestoppt werden. Nach Erholung kann die Therapie erneut begonnen werden, hierbei kann eine Dosisreduktion erwogen werden.
Nebenwirkungen
Die folgenden Nebenwirkungen könnten bei der Behandlung mit Carfilzomib sehr häufig (≥ 1/10) auftreten.
- Pneumonie, Infektion der Atemwege
- Thrombozytopenie, Neutropenie, Anämie, Lymphopenie, Leukopenie
- Hypokaliämie
- Verminderter Appetit
- Schlaflosigkeit
- Schwindel, periphere Neuropathie, Kopfschmerzen
- Hypertonie
- Dyspnoe, Husten
- Diarrhoe, Konstipation, abdominale Schmerzen, Übelkeit, Erbrechen
- Rückenschmerzen, Arthralgie, Schmerzen in den Extremitäten, Muskelkrämpfe
- Erhöhtes Kreatinin im Blut
- Pyrexie, periphere Ödeme, Asthenie, Fatigue, Schüttelfrost
Zudem wurden die folgenden schwerwiegenden Nebenwirkungen berichtet.
- Herzinsuffizienz, Myokardinfarkt, Herzstillstand, myokardiale Ischämie
- Interstitielle Lungenerkrankung, Pneumonitis, akutes Atemnotsyndrom, akutes Lungenversagen
- Pulmonale Hypertonie
- Dyspnoe
- Hypertonie einschließlich hypertensiver Krisen
- Akute Nierenschädigung
- Tumorlyse-Syndrom
- Infusionsbedingte Reaktionen
- Gastrointestinale Hämorrhagie, intrakranielle Hämorrhagie, pulmonale Hämorrhagie
- Thrombozytopenie
- Leberversagen
- Reaktivierung des Hepatitis-B-Virus
- Posteriores reversibles Enzephalopathie-Syndrom (PRES)
- Thrombotische Mikroangiopathie und TTP/HUS
Wechselwirkungen
Es ist nicht bekannt, ob Carfilzomib in therapeutischen Konzentrationen ein Induktor von CYP1A2, CYP2C8, CYP2C9, CYP2C19 und CYP2B6 ist. Daher ist bei der gleichzeitigen Anwendung von Substraten dieser Enzyme, wie oralen Kontrazeptiva, Vorsicht geboten.
Carfilzomib ist außerdem ein Substrat und Inhibitor des P-Glykoproteins (P-gp), weshalb bei der Anwendung mit anderen P-gp-Substraten, wie Digoxin und Colchicin, Vorsicht geboten ist. Allerdings ist es aufgrund der intravenösen Anwendung und des starken Metabolismus unwahrscheinlich, dass Carfilzomib durch P-gp-Inhibitoren oder -Induktoren beeinflusst wird.
Daneben inhibiert Carfilzomi die Transporter OATP1B1 und UGT1A1. Aufgrund der raschen Elinimation wird das Risiko klinisch relevanter Wechselwirkungen Substraten der Transporter jedoch als gering eingeschätzt.
Kontraindikationen
Carfilzomib darf in den folgenden Fällen nicht angewendet werden.
- Überempfindlichkeit gegen den Wirkstoff
- Stillende Frauen
Schwangerschaft
Bisher liegen keine Daten zur Anwendung von Carfilzomib in der Schwangerschaft vor. In tierexperimentellen Studien wurde jedoch eine Reproduktionstoxizität nachgewiesen. Der Proteasom-Inhibitor sollte daher während der Schwangerschaft nicht angewendet werden.
Zu beachten ist außerdem, dass es sich bei Lenalidomid, das in Kombination mit Carfilzomib angewendet werden kann, um eine teratogene Substanz handelt, die schwere, lebensbedrohliche Missbildungen verursachen kann.
Stillzeit
Es ist nicht bekannt, ob Carfilzomib oder seine Metaboliten in die Muttermilch übergehen, allerdings kann ein Risiko für den Säugling aufgrund der pharmakologischen Eigenschaften nicht ausgeschlossen werden. Daher ist das Stillen während und für mindestens 2 Tage nach der Behandlung mit Carfilzomib kontraindiziert.
Verkehrstüchtigkeit
Treten unter Carfilzomib Nebenwirkungen wie Fatigue, Schwindel, Ohnmacht, verschwommenes Sehen, Schläfrigkeit und/oder ein Abfall des Blutdrucks auf, sollten die betroffenen Patienten kein Fahrzeug führen und keine Maschinen bedienen.
Anwendungshinweise
Da Carfilzomib in Kombination mit anderen Arzneimitteln angewendet wird, sind auch die Fachinformationen dieser Substanzen vor Beginn der Therapie zu beachten.
Behandlungsdauer
Die Behandlung mit Carfilzomib kann bis zur Krankheitsprogression oder bis zum Auftreten von unzumutbaren Toxizitäten fortgeführt werden.
Prophylaxe
Um das Risiko einer Herpes-Zoster-Reaktivierung zu verringern, wird eine entsprechende virustatische Prophylaxe empfohlen.
Alle Patienten sollten vor Behandlungsbeginn auf das Hepatitis-B-Virus untersucht werden, um nötigenfalls eine virustatische Prophylaxe einzuleiten.
Außerdem sollten Patienten, die mit den Carfilzomib-Kombinationstherapien behandelt werden, basierend auf den Risikofaktoren und des klinischen Status des Patienten, eine Thromboseprophylaxe erhalten.
Wird Carfilzomib in Kombination mit Daratumumab und Dexamethason angewendet, sollten die Patienten vor der Infusion eine entsprechende Prämedikation erhalten, um infusionsbedingte Reaktionen zu vermeiden.
Bei Patienten mit hohem Risiko für ein Tumorlyse-Syndrom sollten Arzneimittel zur Senkung der Harnsäure in Betracht gezogen werden.
Ausreichende Hydratation
Insbesondere bei Patienten mit einem hohen Risiko für ein Tumorlyse-Syndrom oder renale Toxizität, wie Patienten mit einem Risiko für eine Herzinsuffizienz, ist auf eine ausreichende Hydratation zu achten. Alle Patienten müssen auf Anzeichen einer Volumenüberlastung überwacht werden und der Flüssigkeitsbedarf ist nötigenfalls individuell anzupassen. Die empfohlene Hydratation kann sowohl oral als ach intravenös erfolgen.
Überwachung
Die folgenden Parameter sollten vor und/oder während der Behandlung mit Carfilzomib sorgfältig überwacht werden.
- Thrombozytenwerte
- Serum-Kaliumspiegel, monatlich oder häufiger
- Nierenfunktion, zu Therapiebeginn und mindestens monatlich
- Leberenzyme und Bilirubin, zu Therapiebeginn und mindestens monatlich
- Anzeichen auf thromboembolische Ereignisse
- Anzeichen für ein Tumorlyse-Syndrom, regelmäßige Bestimmung der Serumelektrolyte
Empfängnisverhütung
Carfilzomib kann die Wirkung von oralen Verhütungsmitteln vermindern und das Risiko für venöse thromboembolische Ereignisse erhöhen. Zudem ist eine Kombination mit dem teratogenen Wirkstoff Lenalidomid möglich.
Aus diesen Gründen sollten weibliche Patienten im gebärfähigen Alter während und für einen Monat nach der Therapie eine zuverlässige Verhütungsmethode anwenden. Von einer hormonellen Kontrazeption mit Substanzen, die mit einem Thromboserisiko in Zusammenhang stehen, wird abgeraten.
Männliche Patienten müssen während und für 3 Monate nach der Therapie eine zuverlässige Verhütungsmethode anwenden, falls deren Partnerin schwanger oder im gebärfähigen Alter ist und keine zuverlässige Verhütungsmethode anwendet.
Alternativen
Neben Carfilzomib sind die Proteasom-Inhibitoren Bortezomib und Ixazomib zur Therapie des Multiplen Myeloms zugelassen. Während Bortezomib ebenfalls intravenös verabreicht wird, kann Ixazomib oral eingenommen werden.
Weitere Informationen sind der jeweiligen Fachinformation zu entnehmen.
Wirkstoff-Informationen
- AWMF: S3-Leitlinie Multiples Myelom (2021)
- EMA: Fachinformation Kyprolis (zuletzt aufgerufen am 12.08.2022)
- Nunes AT, Annunziata CM. Proteasome inhibitors: structure and function. Semin Oncol. 2017 Dec;44(6):377-380. DOI: 10.1053/j.seminoncol.2018.01.004
- Geisslinger, Menzel, Gundermann, Hinz, Ruth (2020) Mutschler Arzneimittelwirkungen, 11. Auflage, Wissenschaftliche Verlagsgesellschaft Stuttgart
- Steinhilber, Schubert-Zsilavecz, Roth (2010) Medizinische Chemie, 2. Auflage, Deutscher Apotheker Verlag Stuttgart
Abbildung
Created with BioRender.com











