Fingolimod
Der Wirkstoff Fingolimod wird angewendet zur Behandlung der hochaktiven schubförmig-remittierend verlaufenden Multiplen Sklerose. Das Immunsuppressivum wirkt als Sphingosin-1-Phosphat-Rezeptor-Modulator und unterdrückt Entzündungsprozesse im ZNS, die die Myelinscheiden weiter zerstören würden.
Fingolimod: Übersicht
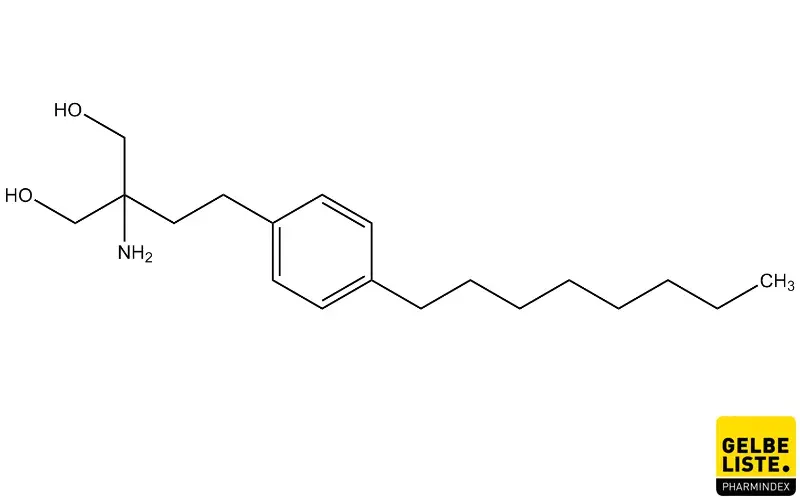
Anwendung
Fingolimod wird angewendet zur Behandlung von hochaktiver schubförmig-remittierend verlaufender Multipler Sklerose bei Patienten ab einem Alter von 10 Jahren.
Anwendungsart
Der Wirkstoff Fingolimod ist in Form von Hartkapseln in den Stärken 0,25 und 0,5 mg auf dem deutschen Markt zugelassen.
Wirkmechanismus
Fingolimod ist ein Sphingosin-1-Phosphat-Rezeptor-Modulator, der im Körper zunächst zu seinem aktiven Metaboliten Fingolimod-Phosphat durch die Sphingosin-Kinase metabolisiert wird. Fingolimod-Phosphat bindet bereits in geringen nanomolaren Konzentrationen an den Sphingosin-1-Phosphat (S1P)-Rezeptor 1 auf Lymphozyten und überwindet die Blut-Hirn-Schranke, wo es an den S1P-Rezeptor 1 auf den Nervenzellen im ZNS bindet. Durch die Bindung blockiert der Wirkstoff die Lymphozytenmigration aus den Lymphknoten und reduziert so die Infiltration pathogener Lymphozyten, einschließlich pro-inflammatorischer Th17-Zellen, in das ZNS.
Pharmakokinetik
Resorption
Fingolimod wird langsam (tmax: 12 –bis 16 Stunden) und umfassend (≥ 85 Prozent) resorbiert. Die absolute orale Bioverfügbarkeit beträgt 93 Prozent. Steady-State-Blutkonzentrationen werden bei einmal täglicher Gabe innerhalb von ein bis zwei Monaten erreicht und sind etwa 10-mal so hoch wie die Werte nach der Initialdosis. Nahrungsaufnahme veränderte die Cmax bzw. Exposition (AUC) von Fingolimod nicht. Die Cmax von Fingolimod-Phosphat war mit 34 Prozent leicht erniedrigt, während die AUC unverändert war.
Verteilung
Fingolimod reichert sich mit einem Anteil von 86 Prozent in den Erythrozyten an. Fingolimod-Phosphat wird in geringerem Maße (< 17 Prozent) von den Blutzellen aufgenommen. Fingolimod und Fingolimod-Phosphat sind zu einem sehr großen Anteil proteingebunden (> 99 Prozent). Fingolimod verteilt sich extensiv im Körpergewebe, wobei das Verteilungsvolumen ca. 1.200 ± 260 Liter beträgt.
Biotransformation
Fingolimod wird beim Menschen durch reversible, stereoselektive Phosphorylierung in das pharmakologisch aktive (S)-Enantiomer Fingolimod-Phosphat transformiert.. Das Hauptenzym, welches an der Metabolisierung von Fingolimod beteiligt ist, ist CYP4F2 oder CYP3A4. Nach oraler Einzelgabe von [14C]-Fingolimod waren die wichtigsten Fingolimod-Komponenten im Blut (eingestuft anhand ihres Anteils an der AUC aller radioaktiv markierten Komponenten bis zu 34 Tage nach Anwendung):
- Fingolimod selbst (23 Prozent)
- Fingolimod-Phosphat (10 Prozent)
- inaktive Metaboliten: M3 Carboxylsäuremetabolit (8 Prozent), M29 Ceramidmetabolit (9 Prozent) und M30 Ceramidmetabolit (7 Prozent)
Elimination
Die Fingolimod-Clearance aus dem Blut beträgt 6,3 ± 2,3 l/h, die durchschnittliche scheinbare terminale Halbwertszeit liegt bei 6 bis 9 Tagen. Die Blutspiegel von Fingolimod und Fingolimod-Phosphat sinken in der terminalen Phase parallel ab, wodurch sich für beide eine ähnliche Halbwertszeit ergibt. Nach oraler Gabe werden ungefähr 81 Prozent der verabreichten Dosis als inaktive Metaboliten langsam renal eliminiert. Fingolimod und Fingolimod-Phosphat werden nicht unverändert in den Urin ausgeschieden, sind jedoch die Hauptkomponenten in Fäzes, mit einem Anteil von jeweils weniger als 2,5 Prozent der Dosis. Nach 34 Tagen werden 89 Prozent der verabreichten Dosis wiedergefunden.
Linearität
Nach mehrfacher einmal täglicher Anwendung von 0,5 mg oder 1,25 mg steigen die Konzentrationen von Fingolimod und Fingolimod-Phosphat dosisproportional an.
Dosierung
Die empfohlene Dosierung von Fingolimod beträgt 0,5 mg einmal täglich.
Bei Kindern ab einem Alter von 10 Jahren mit einem Körpergewicht ≤ 40 kg wird eine einmal tägliche Gabe von 0,25 mg Fingolimod empfohlen.
Nebenwirkungen
Sehr häufig (≥ 1/10) kommt es unter der Behandlung mit Fingolimod zu folgenden Nebenwirkungen:
- Influenza
- Sinusitis
- Husten
- Diarrhö
- Rückenschmerzen
- Erhöhte Leberenzyme (Erhöhte ALT, Gammaglutamyltransferase, Aspartattransaminase).
Wechselwirkungen
Für die Therapie mit Fingolimod bestehen folgende Wechselwirkungen:
- Antineoplastische, immunmodulatorische oder immunsuppressive Therapien: gleichzeitige Anwendung sollte nicht erfolgen, da ein Risiko von additiven Effekten auf das Immunsystem besteht. Vorsicht ist auch geboten, wenn Patienten von lang wirksamen Substanzen umgestellt werden, die das Immunsystem beeinflussen, wie z. B. Natalizumab, Teriflunomid oder Mitoxantron
- Impfungen: Während und bis zu zwei Monate nach einer Behandlung mit Fingolimod kann die Wirksamkeit von Impfungen beeinträchtigt sein. Attenuierte Lebendimpfstoffe sollten aufgrund des Infektionsrisikos nicht gegeben werden.
- Bradykardie-induzierende Substanzen (z. B. Atenolol und Diltiazem): zusätzlichen Reduktion der Herzfrequenz möglich. Die Behandlung mit Fingolimod sollte nicht bei Patienten initiiert werden, die mit Beta-Blockern oder anderen Substanzen, die die Herzfrequenz verringern können, wie Antiarrhythmika der Klassen Ia und III, Calciumkanal-Blockern (wie z. B. Verapamil oder Diltiazem), Ivabradin, Digoxin, Cholinesterasehemmern oder Pilocarpin, behandelt werden.
- Ketoconazol: 1,7-fachen Erhöhung der Exposition (AUC) von Fingolimod und Fingolimod-Phosphat durch die Inhibition von CYP4F2.
- CYP3A4-Inhibitoren: Besondere Vorsicht ist angebracht bei Wirkstoffen, die CYP3A4 hemmen können (Proteaseinhibitoren, Azol-Antimykotika, einige Makrolide wie Clarithromycin oder Telithromycin).
- CYP3A4-Induktoren (z. B. Carbamazepin, Rifampicin, Phenobarbital, Phenytoin, Efavirenz und echtes Johanniskraut): Reduktion der AUC. Aufgrund der potenziellen Beeinträchtigung der Wirksamkeit sollte ihre gleichzeitige Anwendung mit Vorsicht erfolgen. Die gleichzeitige Gabe von echtem Johanniskraut wird jedoch nicht empfohlen.
Kontraindikationen
Für die Anwendung von Fingolimod bestehen folgende Gegenanzeigen:
- Immundefizienzsyndrom
- Patienten mit einem erhöhten Risiko für opportunistische Infektionen, einschließlich immungeschwächte Patienten (einschließlich derer, die derzeit eine immunsuppressive Therapie erhalten oder durch eine vorhergehende Therapie immungeschwächt sind)
- Schwere aktive Infektionen, aktive chronische Infektionen (Hepatitis, Tuberkulose)
- Aktive maligne Erkrankungen
- Schwere Leberfunktionsstörungen (Child-Pugh-Klasse C)
- Patienten, die in den letzten 6 Monaten einen Myokardinfarkt (MI), instabile Angina pectoris, einen Schlaganfall oder eine transitorische ischämische Attacke (TIA), eine dekompensierte Herzinsuffizienz (stationäre Behandlung erforderlich) oder eine Herzinsuffizienz (NYHA Klasse III/IV) hatten
- Patienten mit schweren Herzrhythmusstörungen, die eine anti-arrhythmische Behandlung mit Antiarrhythmika der Klasse Ia oder Klasse III erfordern
- Patienten mit einem AV-Block 2. Grades Mobitz Typ II oder einem AV-Block 3. Grades, oder Sick-Sinus-Syndrom, wenn sie keinen Herzschrittmacher tragen
- Patienten mit einem bestehenden QTc-Intervall ≥ 500 ms
- Überempfindlichkeit gegen den Wirkstoff.
Schwangerschaft
Frauen sollten während der Behandlung nicht schwanger werden und die Anwendung einer aktiven Verhütungsmethode wird empfohlen. Tritt unter der Therapie mit Fingolimod eine Schwangerschaft auf, wird ein Absetzen von Fingolimod empfohlen. Tierexperimentelle Studien haben Reproduktionstoxizität gezeigt, darunter Fehlgeburten und Organdefekte, insbesondere persistierender Truncus arteriosus und ventrikulärer Septumdefekt. Darüber hinaus ist bekannt, dass der durch Fingolimod modulierte Rezeptor (Sphingosin-1-Phosphat-Rezeptor) während der Embryogenese an der Gefäßbildung beteiligt ist.
Stillzeit
Fingolimod geht bei Tieren in die Muttermilch über. Aufgrund des potenziellen Risikos von schwerwiegenden Nebenwirkungen bei Säuglingen durch Fingolimod sollten Frauen unter der Behandlung nicht stillen.
Verkehrstüchtigkeit
Fingolimod hat keinen oder einen zu vernachlässigenden Einfluss auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen.
Nach Einleitung der Behandlung können jedoch Schwindel oder Müdigkeit auftreten. Es wird daher empfohlen bei Einleitung der Therapie die Patienten für einen Zeitraum von 6 Stunden zu beobachten.
Anwendungshinweise
▼ Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung
Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung zu melden. Dies ermöglicht eine schnelle Identifizierung neuer Erkenntnisse über die Sicherheit.
Bradyarrhythmie
Bei Therapiebeginn mit Fingolimod kann es zu einer vorübergehenden Abnahme der Herzfrequenz und zudem zu einer Verzögerung der atrioventrikulären Überleitung kommen (einschließlich vorübergehender, sich spontan zurückbildender kompletter AV-Block).
Leberfunktion
Unter der Anwendung von Fingolimod wurde über eine Erhöhung der Leberenzyme, insbesondere Alanin-Aminotransaminase (ALT) aber auch Gamma-Glutamyltransferase (GGT) und Aspartat-Transaminase (AST) berichtet.
Makulaödem
Vor allem in den ersten 3 bis 4 Behandlungsmonaten können bei 0,5 Prozent der mit 0,5 mg Fingolimod behandelten Patienten Makulaödeme mit oder ohne visuellen Symptome auftreten.
Infektionen
Fingolimod reduziert dosisabhängig die periphere Lymphozytenzahl bis auf 20 – 30 Prozent vom Ausgangswert durch reversibles Zurückhalten (Sequestrierung) von Lymphozyten im Lymphgewebe. Folgendes ist deshalb zu beachten:
- vor Therapiebeginn sollte ein aktuelles (d. h. nicht älter als 6 Monate) großes Blutbild (CBC) vorliegen
- Untersuchungen des CBC sollten regelmäßig während der Behandlung, bei Monat 3 und danach mindestens jährlich, und bei Anzeichen einer Infektion durchgeführt werden
- bei einer bestätigten Gesamtlymphozytenzahl von < 0,2 × 109/l sollte die Behandlung bis zur Besserung pausiert werden
- vor Therapiebeginn müssen Patienten auf ihre Immunität gegen Varizellen (Windpocken) überprüft werden
- die Wirkung von Gilenya auf das Immunsystem kann das Risiko von Infektionen, einschließlich opportunistischer Infektionen, erhöhen
- Patienten sollten angewiesen werden, ihrem Arzt während der Behandlung und bis zu 2 Monate nach Absetzen von Fingolimod Symptome einer Infektion sofort zu melden
- falls bei einem Patienten eine schwere Infektion auftritt, sollte ein Absetzen in Betracht gezogen werden
- Fälle von Kryptokokkenmeningitis (eine Pilzinfektion), manche mit tödlichem Ausgang, wurden in der Postmarketing-Phase nach etwa 2 – 3 Jahren Behandlung berichtet, obwohl ein genauer Zusammenhang mit der Behandlungsdauer nicht bekannt ist
- nach Markteinführung wurde unter Fingolimod-Therapie Progressive Multifokale Leukenzephalopathie (PML) berichtet
- ein negativer anti-JCV-Antikörper-Test schließt die Möglichkeit einer anschließenden JCV-Infektion nicht aus
- vor Beginn einer Fingolimod-Behandlung sollte eine MRT-Aufnahme (in der Regel innerhalb von 3 Monaten vor Behandlungsbeginn) als Referenz vorliegen
- Infektionen mit humanem Papillomavirus (HPV), einschließlich Papillom, Dysplasie, Warzen und HPV-bedingte Krebserkrankungen, wurden unter der Behandlung mit Fingolimod nach der Markteinführung berichtet
- das Auswaschen von Fingolimod kann nach Beendigung der Therapie bis zu zwei Monate dauern und die Überwachung auf Infektionen sollte demzufolge über diesen Zeitraum fortgesetzt werden
Posteriores reversibles Enzephalopathiesyndrom
Es wurde in klinischen Studien und nach Markteinführung über seltene Fälle eines posterioren reversiblen Enzephalopathiesyndroms (PRES) bei einer Dosis von 0,5 mg berichtet. PRES ist gekennzeichnet durch plötzliches Auftreten von starken Kopfschmerzen, Übelkeit, Erbrechen, veränderter mentaler Status, Sehstörungen und Anfälle.
Kutane Neoplasien
Unter Fingolimod-Therapie wurden Basalzellkarzinome (BCC) und andere kutane Neoplasien berichtet, einschließlich malignem Melanom, Plattenepithelkarzinom, Kaposi-Sarkom und Merkelzellkarzinom. Eine Überwachung von Hautläsionen muss deshalb gewährleistet sein und eine medizinische Beurteilung der Haut wird bei Behandlungsbeginn und danach alle 6 bis 12 Monate empfohlen.
Alternativen
Fingolimod ist aufgrund seiner möglichen schweren Nebenwirkungen in Europa nur zur Zweitlinientherapie der Multiplen Sklerose zugelassen, wenn Beta-Interferone nicht ausreichend wirken oder die Erkrankung sehr aktiv ist und rasch fortschreitet.
Weitere Informationen sind der jeweiligen Fachinformation zu entnehmen.
Wirkstoff-Informationen
-
Fingod 0,5 mg Hartkapseln
TAD Pharma GmbH
-
Fingolimod AbZ 0,5 mg Hartkapseln
AbZ-Pharma GmbH
-
Fingolimod Accord 0,5 mg Hartkapseln
Accord Healthcare GmbH
-
Fingolimod AL 0,5 mg Hartkapseln
ALIUD PHARMA® GmbH
-
Fingolimod Amarox 0,25 mg Hartkapseln
Amarox Pharma GmbH
-
Fingolimod Amarox 0,5 mg Hartkapseln
Amarox Pharma GmbH
-
Fingolimod Ascend 0,5 mg Hartkapseln
Ascend GmbH
-
FINGOLIMOD BASICS 0,5 mg Hartkapseln
Basics GmbH
-
Fingolimod beta 0,5 mg Hartkapseln
betapharm Arzneimittel GmbH
-
Fingolimod Denk 0,5 mg Hartkapseln
Denk Pharma GmbH & Co. KG
-
Fingolimod Devatis 0,5 mg Hartkapseln
Devatis GmbH
-
Fingolimod Glenmark 0,5 mg Hartkapseln
Glenmark Arzneimittel GmbH
-
Fingolimod Heumann 0,5 mg Hartkapseln
Heumann Pharma GmbH & Co. Generica KG
-
Fingolimod Holsten 0,5 mg Hartkapseln
Holsten Pharma GmbH
-
Fingolimod Mylan 0,5 mg Hartkapseln
Viatris Healthcare GmbH
-
Fingolimod neuraxpharm 0,5 mg Hartkapseln
neuraxpharm Arzneimittel GmbH
-
Fingolimod PUREN 0,5 mg Hartkapseln
PUREN Pharma GmbH & Co. KG
-
Fingolimod-ratiopharm 0,25 mg Hartkapseln
ratiopharm GmbH
-
Fingolimod-ratiopharm 0,5 mg Hartkapseln
ratiopharm GmbH
-
Fingolimod STADA® 0,5 mg Hartkapseln
STADAPHARM GmbH
-
Fingolimod Vivanta 0,5 mg Hartkapseln
Vivanta Generics s.r.o
-
Fingolimod Zentiva 0,5 mg Hartkapseln
Zentiva Pharma GmbH
-
Gilenya® 0,25 mg Hartkapseln
Novartis Pharma GmbH
-
Gilenya 0,5 mg Abacus Hartkapseln
Abacus Medicine A/S
-
Gilenya 0,5 mg axicorp Hartkapseln
axicorp Pharma B.V.
-
Gilenya 0,5 mg CC-Pharma Hartkapseln
CC Pharma GmbH
-
Gilenya® 0,5 mg Hartkapseln
Novartis Pharma GmbH
-
Gilenya 0,5 mg kohlpharma Hartkapseln
kohlpharma GmbH
-
Gilenya 0,5 mg Orifarm Hartkapseln
Orifarm GmbH
-
Gilenya 0,5 mg Paranova Hartkapseln
Paranova Pack A/S
-
Gilenya 0,5 mg SynCo pharma Hartkapseln
SynCo pharma B.V.














