Nivolumab
Nivolumab ist ein humaner Immunglobulin G4 (IgG4) monoklonaler Antikörper, der zur Therapie von fortgeschrittenen Melanomen, nicht-kleinzelligem Lungenkarzinom, Nierenzellkarzinom, klassischem Hodgkin-Lymphom, Plattenepithelkarzinom des Kopf-Hals-Bereiches sowie des Urothelkarzinoms zugelassen ist.
Nivolumab: Übersicht
Anwendung
Nivolumab ist bei erwachsenen Patienten zur Behandlung folgender Tumorarten indiziert:
-
Melanom: Als Monotherapie oder in Kombination mit Ipilimumab zur Behandlung des fortgeschrittenen (nicht resezierbaren oder metastasierten) Melanoms. Die Kombination mit Ipilimumab führt nur bei Patienten mit niedriger Tumor-PD-L1-Expression zu einem Anstieg des progressionsfreien Überlebens und des Gesamtüberlebens.
-
Nicht-kleinzelliges Lungenkarzinom: Als Monotherapie zur Behandlung des lokal fortgeschrittenen oder metastasierten nicht-kleinzelligen Lungenkarzinoms nach vorhergehender Chemotherapie.
-
Nierenzellkarzinom: Als Monotherapie zur Behandlung des fortgeschrittenen Nierenzellkarzinoms nach Vortherapie.
-
Klassisches Hodgkin-Lymphom: Als Monotherapie zur Behandlung des rezidivierenden oder refraktären klassischen Hodgkin-Lymphoms nach autologer Stammzelltransplantation und Behandlung mit Brentuximab Vedotin.
-
Plattenepithelkarzinom des Kopf-Hals-Bereichs: Als Monotherapie zur Behandlung des Plattenepithelkarzinoms des Kopf-Hals-Bereichs bei Patienten mit einer Progression während oder nach einer platinbasierten Therapie.
- Urothelkarzinom: Als Monotherapie zur Behandlung des lokal fortgeschrittenen nicht resezierbaren oder metastasierten Urothelkarzinoms nach Versagen einer vorherigen platin-haltigen Therapie.
Wirkmechanismus
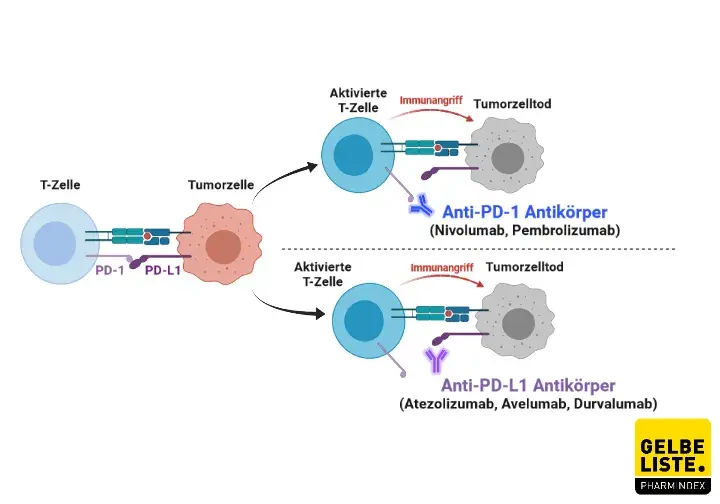
Nivolumab ist ein humaner Immunoglobulin-G4-(IgG4) monoklonaler Antikörper, der an den Programmierten Zelltod 1-(PD-1)-Rezeptor bindet und die Interaktion des Rezeptors mit seinen Liganden PD-L1 und PD-L2 verhindert. Der PD1-Rezeptor ist als negativer Regulator der T-Zellaktivität an der Kontrolle der T-Zellreaktionen beteiligt. Die Bindung des PD1-Rezeptors an PD-L1 und PD-L2, die von Antigen-präsentierenden Zellen an deren Oberfläche exprimiert werden sowie von Tumoren oder anderen Zellen aus dem Tumormilieu, führt zur Hemmung der T-Zellproliferation und Zytokinausschüttung. Durch die von Nivolumab induzierte Blockade der Bindung zwischen PD-1 und PD-L1 bzw. PD-L2 werden T-Zellreaktionen einschließlich Tumorabwehrreaktionen potenziert.
Duale Blockade von PD-1 und CTLA-4-vermittelten Signalwegen führte in genidentischen Mausmodellen zu synergistischer Tumoraktivität. Beim metastasierten Melanom kann die Kombination einer Nivolumab (anti-PD-1) und Ipilimumab (anti-CTLA-4) – vermittelten Hemmung eine verbesserte Anti-Tumor-Aktivität bewirken.
Pharmakokinetik
Im Dosisbereich von 0,1 bis 10 mg/kg ist die Pharmakokinetik von Nivolumab linear. In einer Populationsanalyse betrug die mittlere geometrische Clearance (CL) 7,9 ml/h, die terminale Halbwertzeit 25 Tage und die durchschnittliche Exposition im Steady-State von Nivolumab (3 mg/kg Körpergewicht alle 2 Wochen) 86,6 µg/ml. CL stieg mit höherem Körpergewicht an. Ungefähr einheitliche Talspiegel im Steady-State wurden bei einer an das Körpergewicht angepassten Dosierung erzielt. In Kombinationstherapie (Nivolumab 1 mg/kg mit Ipilimumab 3 mg/kg) stieg die CL von Nivolumab um 29 % an. Nivolumab hatte jedoch keinen Effekt auf die CL von Ipilimumab. Alter, Geschlecht, Rasse, Art des soliden Tumors, Tumorgröße und eingeschränkte Leberfunktion hatten keinen Einfluss auf die CL.
Es existieren nur begrenzt Daten hinsichtlich schwer eingeschränkter Nierenfunktion, als dass sich daraus Schlüsse für diese Population ableiten lassen.
Stoffwechselwege wurden nicht charakterisiert, da zu erwarten ist, das Nivolumab, wie endogenes IgG, über katabole Stoffwechselvorgänge in kleine Peptide und Aminosäuren aufgespalten wird.
Nebenwirkungen
Nivolumab alleine oder in Kombination mit Ipilimumab ist mit immunvermittelten Nebenwirkungen assoziiert. Diese traten bei Kombination mit Ipilimumab in höheren Häufigkeiten auf als bei einer Nivolumab-Monotherapie und waren mit einer adäquaten medizinischen Behandlung meist reversibel. Schwerwiegende bis lebensbedrohliche immunvermittelte Nebenwirkungen können Verdauungstrakt, Leber, Haut, Nervensystem, endokrines System oder andere Organsysteme betreffen.
Monotherapie
Die am häufigsten aufgetretenen Nebenwirkungen waren Fatigue, Hautausschlag, Pruritus, Diarrhö und Übelkeit. Die Mehrheit der Nebenwirkungen war leicht bis mäßig.
Nachfolgend sind die Nebenwirkungen bei einer Monotherapie entsprechend ihrer Häufigkeit gelistet:
-
Sehr häufig (≥ 1/10): Müdigkeit, Hautausschlag, Juckreiz, Diarrhö, Übelkeit, Neutropenie, erhöhte AST, erhöhte ALT, Anstieg der alkalischen Phosphatase, Lipase-Anstieg, Amylase-Anstieg, Hypokalziämie, Kreatinin-Anstieg, Hyperglykämie, Lymphopenie, Leukopenie, Thrombozytopenie, Anämie, Hyperkalziämie, Hyperkaliämie, Hypokaliämie, Hypomagnesiämie und Hyponatriämie
-
Häufig (≥ 1/100, < 1/10): Infektionen der oberen Atemwege, infusionsbedingte Reaktionen, Hypersensibilität, Hypothyreose, Hyperthyreose, verminderter Appetit, periphere Neuropathie, Kopfschmerzen, Schwindelgefühl, Hypertonie, Pneumonitis, Dyspnoe, Husten, Kolitis, Stomatitis, Erbrechen, Bauchschmerzen, Obstipation, trockener Mund, Vitiligo, trockene Haut, Erythem, Alopezie, Muskel- und Skelettschmerzen, Arthralgie, Pyrexie, Ödeme (einschließlich peripheres Ödem), Anstieg des Gesamt-Bilirubins, Hypoglykämie, Hypermagnesiämie, Hypernatriämie und Gewichtsverlust
- Gelegentlich (≥ 1/1.000, < 1/100): Pneumonie, Bronchitis, Nebenniereninsuffizienz, Hypophyseninsuffizienz, Hypophysitis, Thyroiditis, Diabetes mellitus, Dehydrierung, metabolische Azidose, Hepatitis, Polyneuropathie, autoimmune Neuropathie (einschließlich Gesichtsnerv- und Abduzensparese), Uveitis, verschwommenes Sehen, trockene Augen, Tachykardie, Pleuraerguss, Pankreatitis, Gastritis, Erythema multiforme, Psoriasis, Rosazea, Urtikaria, rheumatische Polymyalgie, Arthritis, tubulointerstitielle Nephritis, Nierenversagen (einschließlich akutem Nierenversagen), Schmerzen und Schmerzen in der Brust.
Weitere, teils schwerwiegende, selten und sehr selten auftretende Nebenwirkungen sind hier nicht im Einzelnen aufgeführt.
Kombinationstherapie mit Ipilimumab
Die am häufigsten aufgetretenen Nebenwirkungen bei der Kombinationstherapie mit Ipilimumab waren: Hautausschlag, Fatigue, Diarrhöe, Pruritus, Übelkeit, Pyrexie, verminderter Appetit, Hypothyreose, Kolitis, Erbrechen, Arthralgie, Bauchschmerzen, Kopfschmerzen und Dyspnoe.
Im Folgenden sind die Nebenwirkungen bei einer Kombinationstherapie entsprechend ihrer Häufigkeit gelistet:
-
Sehr häufig (≥ 1/10): Müdigkeit, Pyrexie, Arthralgie, Hautausschlag, Juckreiz, Kolitis, Diarrhö, Erbrechen, Übelkeit, Bauchschmerzen, Dyspnoe, Kopfschmerzen, verminderter Appetit, Hypothyreose, erhöhte AST, erhöhte ALT, Anstieg des Gesamt-Bilirubins, Anstieg der alkalischen Phosphatase, Lipase-Anstieg, Amylase-Anstieg, Kreatinin-Anstieg, Hyperglykämie, Hypoglykämie, Lymphopenie, Leukopenie, Neutropenie, Thrombozytopenie, Anämie, Hypokalziämie, Hyperkaliämie, Hypokaliämie, Hypomagnesiämie und Hyponatriämie
-
Häufig (≥ 1/100, < 1/10): Ödeme (einschließlich peripheres Ödem), Schmerzen, Nierenversagen (einschließlich akutem Nierenversagen), Muskel- und Skelettschmerzen, Vitiligo, trockene Haut Erythem, Alopezie, Urtikaria, Stomatitis, Pankreatitis, Obstipation, trockener Mund, Pneumonitis, Lungenembolie, Husten, Hypertonie, Tachykardie, Uveitis, verschwommenes Sehen, periphere Neuropathie, Schwindelgefühl, Hepatitis, Dehydrierung, Nebenniereninsuffizienz, Hypophyseninsuffizienz, Hypophysitis, Hyperthyreose, Thyroiditis, infusionsbedingte Reaktionen , Hypersensibilität, Eosinophilie, Pneumonie, Infektionen der oberen Atemwege, Hyperkalziämie, Hypermagnesiämie, Hypernatriämie und Gewichtsverlust
- Gelegentlich (≥ 1/1.000, < 1/100): Schmerzen in der Brust, tubulointerstitielle Nephritis, Spondyloarthropathie, Sjögren-Syndrom, Arthritis, Myopathie, Myositis (einschließlich Polymyositis), Rhabdomyolyse, Psoriasis, Darmperforation, Gastritis, Duodenitis, Pleuraerguss, Arrhythmie (einschließlich ventrikulärer Arrhythmie), Vorhofflimmern, Myokarditis, Guillain-Barré-Syndrom, Polyneuropathie, Neuritis, Peroneuslähmung, autoimmune Neuropathie (einschließlich Gesichtsnerv- und Abduzensparese), Enzephalitis, diabetische Ketoazidose, Diabetes mellitus, Sarkoidose und Bronchitis.
Weitere, teils schwerwiegende, selten und sehr selten auftretende Nebenwirkungen sind hier nicht im Einzelnen aufgeführt.
Wechselwirkungen
Als monoklonaler Antikörper wird Nivolumab nicht von Cytochrom-P450-Enzymen (CYPs) oder anderen Enzymen des Arzneimittelmetabolismus abgebaut. Deshalb ist nicht zu erwarten, dass gleichzeitig verabreichte Arzneimittel die Pharmakokinetik von Nivolumab durch Hemmung oder Induktion dieser Enzyme verändert.
Kortikosteroide und Immunsuppressiva
Systemische Kortikoide können die pharmakodynamische Aktivität und Wirksamkeit von Nivolumab beeinträchtigen. Aus diesem Grunde sollte die Anwendung systemischer Kortikosteroide und anderer Immunsuppressiva vor Beginn der Behandlung mit Nivolumab vermieden werden.
Nach Beginn der Nivolumab-Therapie können systemische Kortikosteroide oder andere Immunsuppressiva jedoch eingesetzt werden, um immunvermittelte Nebenwirkungen zu behandeln.
Kontraindikation
Gegenanzeigen sind Überempfindlichkeit gegen den Wirkstoff Nivolumab oder einen der sonstigen Bestandteile der Arzneizubereitung.
Schwangerschaft/Stillzeit
Zur Anwendung von Nivolumab bei Schwangeren liegen keine Daten vor und das potentielle Risiko für den sich entwickelnden Fötus ist nicht bekannt. In tierexperimentellen Studien wurde embryofötale Toxizität nachgewiesen. Die Anwendung von Nivolumab in der Schwangerschaft wird nicht empfohlen, es sei denn, der klinische Nutzen überwiegt das potentielle Risiko. Gebärfähige Frauen sollten während der Behandlung und bis mindestens 5 Monate nach der letzten Gabe von Nivolumab wirksame Verhütungsmethoden anwenden.
Es ist nicht bekannt, ob der Wirkstoff in die Muttermilch übergeht. Ein Risiko für das Neugeborene/ den Säugling kann nicht ausgeschlossen werden. Daher muss unter Abwägung des Nutzens des Stillens für das Kind und des Nutzens der Behandlung für die Mutter eine Entscheidung darüber getroffen werden, ob das Stillen oder die Behandlung mit Nivolumab unterbrochen werden soll.
Die Auswirkung von Nivolumab auf die männliche oder weibliche Fertilität ist unbekannt. Studien zur Untersuchung der Fertilität wurden nicht durchgeführt.
Hinweise
Nebenwirkungen können unter Nivolumab oder Nivolumab in Kombination mit Ipilimumab jederzeit während oder nach der Behandlung auftreten. Deshalb sollten Patienten mindestens bis 5 Monate nach der letzten Dosis engmaschig überwacht werden.
Wirkstoff-Informationen
Bristol-Myers Squibb, Fachinformation; EMA
-
OPDIVO® 10 mg/ml Konzentrat zur Herstellung einer Infusionslösung, 4 ml
Bristol-Myers Squibb GmbH & Co. KGaA
-
OPDIVO® 10 mg/ml Konzentrat zur Herstellung einer Infusionslösung, 10 ml
Bristol-Myers Squibb GmbH & Co. KGaA
-
OPDIVO® 10 mg/ml Konzentrat zur Herstellung einer Infusionslösung, 12 ml
Bristol-Myers Squibb GmbH & Co. KGaA
-
OPDIVO® 600 mg Injektionslösung
Bristol-Myers Squibb GmbH & Co. KGaA