Secukinumab
Secukinumab ist ein humaner monoklonaler Antikörper, der sich gegen das Zytokin Interleukin-17A (IL-17A) richtet und zur Behandlung von Plaque-Psoriasis, Psoriasis-Arthritis (PsA) und axialer Spondyloarthritis (axSpA) zugelassen ist. IL-17A spielt in der Pathogenese dieser Erkrankungen eine Schlüsselrolle.
Secukinumab : Übersicht
Anwendung
Der humane monoklonale Antikörper Secukinumab ist für folgende Indikationsgebiete zugelassen:
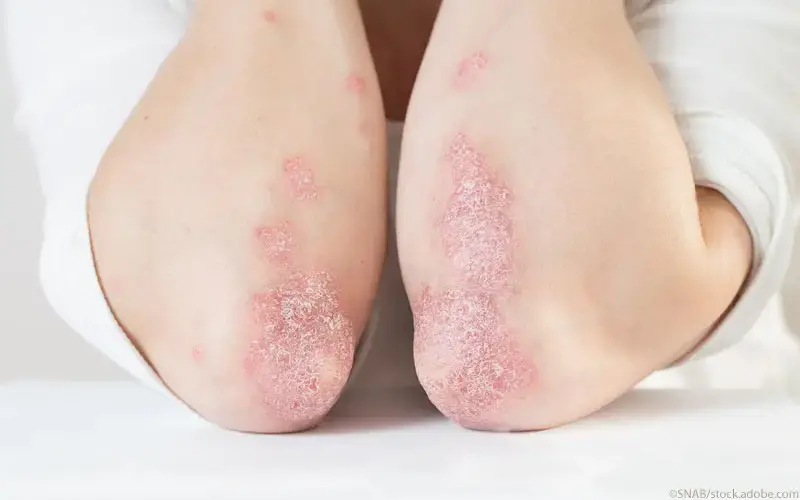
- Plaque-Psoriasis: Erwachsene sowie Kinder und Jugendliche ab 6 Jahren mit mittelschwerer bis schwerer Plaque-Psoriasis, die für eine systemische Therapie in Frage kommen.
- Psoriasis-Arthritis (PsA): Als Monotherapie oder in Kombination mit Methotrexat (MTX) bei erwachsenen Patienten mit aktiver Psoriasis-Arthritis, wenn das Ansprechen auf eine vorhergehende Therapie mit krankheitsmodifizierenden Antirheumatika (DMARD) unzureichend war.
- Axiale Spondyloarthritis (axSpA): Erwachsene Patienten mit aktiver ankylosierender Spondylitis, die auf eine konventionelle Therapie unzureichend angesprochen haben sowie Erwachsene mit aktiver nicht-röntgenologischer axialer Spondyloarthritis mit objektiven Anzeichen der Entzündung, angezeigt durch erhöhtes C-reaktives Protein (CRP) und/oder Nachweis durch Magnetresonanztomographie (MRT), die unzureichend auf nichtsteroidale Antirheumatika (NSAR) angesprochen haben.
Anwendungsart
Secukinumab ist in folgenden Darreichungsformen erhältlich:
- Injektionslösung in einer Fertigspritze (75 mg, 150 mg, 300 mg)
- Injektionslösung in einem Fertigpen (150 mg, 300 mg)
- Pulver zur Herstellung einer Injektionslösung (150 mg)
Secukinumab ist als subkutane (s.c.) Injektion vorgesehen. Eine Injektion in Hautbereiche, die von Psoriasis betroffen sind, sollte wenn möglich vermieden werden. Die Fertigspritze oder der Fertigpen darf nicht geschüttelt werden.
Secukinumab kann darüber hinaus eigenständig von den Patienten oder von einer Betreuungsperson injiziert werden, sofern sie zuvor in der Technik der subkutanen Injektion ausreichend geschult wurden und der Arzt eine Selbstinjektion für angebracht hält. Eine weitere Beobachtung durch den Arzt ist obligatorisch, denn Secukinumab muss unter der Anleitung und Aufsicht eines Arztes angewendet werden, der in der Diagnose und Behandlung der Erkrankungen, für die Secukinumab zugelassen ist, erfahren ist.
Wirkmechanismus
Secukinumab ist ein vollständig humaner monoklonaler IgG1/κ-Antikörper, was die Endung „umab“ symbolisiert. Secukinumab bindet spezifisch an das proinflammatorische Zytokin Interleukin-17A (IL-17A) aus der Interleukin-17-Familie und neutralisiert dieses. Infolgedessen wird eine Interaktion zwischen IL-17A und dem IL-17-Rezeptor unterbunden. Der IL-17-Rezeptor wird auf verschiedenen Zelltypen einschließlich Keratinozyten exprimiert. Eine epidermale Hyperproliferation von Keratinozyten in psoriatischen Arealen, die mit einer gestörten Keratinozytendifferenzierung einhergeht, ist maßgeblich beteiligt am Krankheitsbild der Plaque-Psoriasis. Durch Bindung an IL-17A verhindert Secukinumab den inflammatorischen Beitrag dieses Zytokins zum Krankheitsgeschehen. Essenziell für die Wirksamkeit ist dabei das Erreichen klinisch relevanter Secukinumab-Konzentrationen in den betroffenen Hautarealen, um die bei Plaque-Psoriasis-Herden vorliegenden Erytheme, Verhärtungen und Schuppungen zu reduzieren.
IL-17A spielt nicht nur bei der Pathogenese der Plaque-Psoriasis, sondern auch bei der Pathogenese der Psoriasis-Arthritis und axialen Spondyloarthritis (ankylosierende Spondylitis und nicht-röntgenologische axiale Spondyloarthritis) eine Schlüsselrolle. Es ist beispielsweise bei Patienten mit Plaque-Psoriasis in von Läsionen betroffenen Hautarealen im Gegensatz zu Hautarealen ohne Läsionen sowie im synovialen Gewebe von Patienten mit Psoriasis-Arthritis hochreguliert.
Pharmakokinetik
Die pharmakokinetischen Daten von Secukinumab wurden hauptsächlich mit Hilfe von populationspharmakokinetischen Analysen erhoben.
Resorption
- Secukinumab wurde bei Patienten mit Plaque-Psoriasis mit einer mittleren absoluten Bioverfügbarkeit von 73% resorbiert (über alle Studien hinweg wurden für die absolute Bioverfügbarkeit Werte im Bereich von 60 bis 77% berechnet).
- Die Bioverfügbarkeit von Secukinumab bei PsA-Patienten belief sich auf Grundlage des populationspharmakokinetischen Modells auf 85%.
- Nach einer subkutanen Einzeldosis von entweder 150 mg oder 300 mg bei Patienten mit Plaque-Psoriasis wurden 5 bis 6 Tage nach Gabe Spitzenkonzentrationen von Secukinumab im Serum von 13,7 ± 4,8 μg/ml bzw. 27,3 ± 9,5 μg/ml erreicht.
- Bei anfänglich wöchentlicher Anwendung im ersten Monat betrug die Zeit bis zum Erreichen der Spitzenkonzentration 31 bis 34 Tage.
- Verglichen mit der Exposition nach einer Einzeldosis wiesen Patienten nach wiederholten monatlichen Erhaltungsdosen einen 2-fachen Anstieg der Spitzenkonzentrationen im Serum und der Fläche unter der Konzentrations-Zeit-Kurve (AUC) auf.
- Der Steady-State wird unter einem monatlichen Dosierungsregime wahrscheinlich nach etwa 20 Wochen erreicht.
Verteilung
- Das mittlere Verteilungsvolumen während der terminalen Phase (Vz) nach Gabe einer intravenösen Einzeldosis bei Patienten mit Plaque-Psoriasis lag im Bereich von 7,10 bis 8,60 Liter, was auf eine begrenzte Verteilung von Secukinumab in periphere Kompartimente hindeutet.
Metabolismus (Biotransformation)
- Die IgG-Elimination erfolgt größtenteils über intrazellulären Katabolismus nach einer Flüssigphasen- oder rezeptorvermittelten Endozytose.
Elimination
- Die mittlere systemische Clearance (CL) nach Gabe einer intravenösen Einzeldosis bei Patienten mit Plaque-Psoriasis lag im Bereich von 0,13 bis 0,36 l/Tag.
- In einer Analyse der Populationspharmakokinetik betrug die mittlere systemische Clearance (CL) bei Patienten mit Plaque-Psoriasis 0,19 l/Tag und war geschlechts-, dosis- und zeitunabhängig.
- Clearance und Verteilungsvolumen sind gewichtsabhängig und nehmen mit steigendem Körpergewicht zu.
- Die mittlere Eliminationshalbwertszeit bei Patienten mit Plaque-Psoriasis wird auf 27 Tage geschätzt und lag über alle Psoriasis-Studien mit intravenöser Gabe hinweg in einem Bereich von 18 bis 46 Tagen.
Linearität/Nicht-Linearität
- Die Secukinumab-Exposition verhält sich über verschiedene Dosisregime hinweg sowohl nach intravenöser als auch subkutaner Applikation dosisproportional.
Dosierung
Die Dosierung von Secukinumab orientiert sich an der Erkrankung, dem Gewicht und dem Alter des Patienten.
Plaque-Psoriasis
Erwachsene:
- 300 mg subkutan (1x 300 mg oder 2x 150 mg) mit Startdosen in den Wochen 0, 1, 2, 3, 4 gefolgt von monatlichen Erhaltungsdosen.
Kinder und Jugendliche ab 6 Jahren:
- Die Dosierungsempfehlung richtet sich nach dem Körpergewicht zum Zeitpunkt der Dosierung.
- 75 mg subkutan (Körpergewicht < 50 kg) mit Startdosen in den Wochen 0, 1, 2, 3, 4 gefolgt von monatlichen Erhaltungsdosen.
- 150 mg subkutan (Körpergewicht ≥ 50 kg) mit Startdosen in den Wochen 0, 1, 2, 3, 4 gefolgt von monatlichen Erhaltungsdosen.
- Eine Dosiserhöhung auf 300 mg (Körpergewicht ≥ 50 kg) kann bei manchen Patienten einen Zusatznutzen erzielen.
Psoriasis-Arthritis
Patienten mit gleichzeitiger mittelschwerer bis schwerer Plaque-Psoriasis oder Patienten, die unzureichend auf TNFα-Inhibitoren ansprechen:
- 300 mg subkutan (1x 300 mg oder 2x 150 mg) mit Startdosen in den Wochen 0, 1, 2, 3, 4 gefolgt von monatlichen Erhaltungsdosen.
Andere Patienten (Erwachsene):
- 150 mg subkutan mit Startdosen in den Wochen 0, 1, 2, 3, 4 gefolgt von monatlichen Erhaltungsdosen.
- Eine Dosiserhöhung auf 300 mg kann basierend auf dem klinischen Ansprechen durchgeführt werden.
Axiale Spondyloarthritis (axSpA)
Ankylosierende Spondylitis (AS; Morbus Bechterew, röntgenologische axiale Spondyloarthritis):
- 150 mg subkutan mit Startdosen in den Wochen 0, 1, 2, 3, 4 gefolgt von monatlichen Erhaltungsdosen.
- Eine Dosiserhöhung auf 300 mg kann basierend auf dem klinischen Ansprechen durchgeführt werden.
Nicht-röntgenologische axiale Spondyloarthritis (nr-axSpA):
- 150 mg subkutan mit Startdosen in den Wochen 0, 1, 2, 3, 4 gefolgt von monatlichen Erhaltungsdosen.
Die vorliegenden Daten zu allen oben genannten Anwendungsgebieten deuten darauf hin, dass ein klinisches Ansprechen in der Regel innerhalb von 16 Behandlungswochen erzielt wird.
Bei Patienten, die nach 16 Behandlungswochen nicht auf die Therapie angesprochen haben, sollte erwogen werden, die Behandlung abzusetzen.
Bei manchen Patienten mit zunächst unvollständigem Ansprechen kommt es im Verlauf bei Fortführung der Behandlung über 16 Wochen hinaus zu Verbesserungen.
Nebenwirkungen
Die häufigsten Nebenwirkungen unter einer Therapie mit dem monoklonalen Antikörper Secukinumab sind Infektionen der oberen Atemwege (17,7%), insbesondere Nasopharyngitis und Rhinitis.
Außerdem treten häufig folgende Nebenwirkungen auftreten:
- Orale Herpesinfektion
- Tinea pedis
- Kopfschmerzen
- Rhinorrhö
- Diarrhö
- Übelkeit
- Ermüdung
Anaphylaktische Reaktionen gegen Secukinumab treten selten auf.
In klinischen Studien ist es bei weniger als 1% der mit Secukinumab behandelten Patienten über einen Behandlungszeitraum von bis zu 52 Wochen zur Entwicklung von Antikörpern gegen Secukinumab gekommen.
Bei etwa der Hälfte der unter Behandlung aufgetretenen Antikörper gegen den Wirkstoff handelte es sich um neutralisierende Antikörper, wobei diese jedoch keinen Einfluss auf die Wirkung oder die Pharmakokinetik hatten.
Wechselwirkungen
In Arthritis-Studien wurden keine Wechselwirkungen mit Methotrexat (MTX) und/oder Kortikosteroiden beobachtet.
Secukinumab sollte allerdings nicht gleichzeitig mit Lebendimpfstoffen angewendet werden.
Kontraindikationen
Secukinumab ist kontraindiziert bei Überempfindlichkeit gegen den Wirkstoff oder sonstige Bestandteile des Arzneimittels sowie bei klinisch relevanten, aktiven Infektionen wie z.B. aktiver Tuberkulose.
Schwangerschaft
Die Datenlage zur Anwendung von Secukinumab bei Schwangeren ist begrenzt. Tierexperimentelle Studien ergaben keine Hinweise auf direkte oder indirekte gesundheitsschädliche Wirkungen in Bezug auf Reproduktionstoxizität.
Als Vorsichtsmaßnahmen soll eine Anwendung von Secukinumab in der Schwangerschaft vermieden werden.
Stillzeit
Immunglobuline gehen in die Muttermilch über. Allerdings ist nicht bekannt, ob Secukinumab in die Muttermilch übergeht. Es können potenziell unerwünschte Wirkungen bei gestillten Kindern auftreten, weshalb der Nutzen des Stillens für das Kind im Vergleich zum Nutzen der Therapie für die Mutter abgewogen werden sollte.
Verkehrstüchtigkeit
Secukinumab hat keinen oder einen zu vernachlässigenden Einfluss auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen.
Anwendungshinweise
Infektionen
- Secukinumab kann das Infektionsrisiko erhöhen (es wurden nach Markteinführung schwere Infektionen bei Patienten unter Behandlung mit Secukinumab beobachtet).
- Bei Patienten mit einer chronischen Infektion oder einer rezidivierenden Infektion in der Vorgeschichte sollte Secukinumab mit Vorsicht angewendet werden.
- Symptome einer möglichen Infektion sollten ärztlich abgeklärt werden.
- Entwickelt sich unter Secukinumab eine schwerwiegende Infektion, ist der Patient engmaschig zu beobachten und die Behandlung mit Secukinumab sollte bis zum Abklingen der Infektion unterbrochen werden.
- In klinischen Studien wurde keine erhöhte Anfälligkeit für Tuberkulose festgestellt (Secukinumab sollte bei Patienten mit aktiver Tuberkulose jedoch nicht angewendet werden).
- Bei Patienten mit latenter Tuberkulose ist vor Beginn einer Behandlung mit Secukinumab eine Anti-Tuberkulose-Therapie in Betracht zu ziehen.
Chronisch-entzündliche Darmerkrankung (einschließlich Morbus Crohn und Colitis ulcerosa)
- Secukinumab kann zu Exazerbationen oder zum Neuauftreten von chronisch-entzündlichen Darmerkrankungen (CED) führen, weshalb der Antikörper bei Patienten mit CED nicht empfohlen wird.
- Bei Symptomen einer chronisch-entzündlichen Darmerkrankung oder einer Exazerbation einer bestehenden chronisch-entzündlichen Darmerkrankung sollte die Behandlung mit Secukinumab beendet und geeignete medizinische Therapiemaßnahmen eingeleitet werden.
Überempfindlichkeitsreaktionen
- In seltenen Fällen wurden unter Behandlung mit Secukinumab anaphylaktische Reaktionen beobachtet.
- Falls es zu anaphylaktischen oder sonstigen schwerwiegenden allergischen Reaktionen kommt, sollte die Behandlung mit Secukinumab sofort beendet und geeignete Therapiemaßnahmen eingeleitet werden.
Impfungen
- Die gleichzeitige Anwendung von Lebendimpfstoffen sollte vermieden werden.
- Eine Impfung mit inaktivierten Impfstoffen oder Totimpfstoffen ist möglich.
- Pädiatrische Patienten sollten vor Beginn der Therapie mit Secukinumab alle altersgemäßen Impfungen nach aktuellen Impfrichtlinien erhalten.
Gleichzeitige immunsuppressive Therapie
- Die Daten zur gleichzeitigen Therapie mit Immunsuppressiva sind bisher unzureichend.
- In Arthritis-Studien (einschließlich bei Patienten mit Psoriasis-Arthritis und ankylosierender Spondylitis) wurde Secukinumab gleichzeitig mit Methotrexat (MTX), Sulfasalazin und/oder Kortikosteroiden verabreicht.
- Die Sicherheit und Wirksamkeit von Secukinumab in Kombination mit Immunsuppressiva (einschließlich Biologika) oder einer Phototherapie wurden in Psoriasis-Studien nicht untersucht.
Alternativen
Die Therapiealternativen richten sich nach dem jeweiligen Indikationsgebiet und sind darüber hinaus abhängig von patientenindividuellen Gegebenheiten wie dem Alter des Patienten, Begleitmedikationen bzw. Begleiterkrankungen oder dem Schweregrad der Erkrankung (z.B. Psoriasis Area and Severity Index (PASI) bei Plaque-Psoriasis).
Plaque-Psoriasis
Topische Therapie:
- Calcineurin-Inhibitoren wie Ciclosporin
- Dithranol
- Kortikosteroide
- Retinoide wie Tazaroten
- Teer
- Vitamin D3 Analoga
Phototherapie:
- Laser
- UV-B
- Photochemotherapie (PUVA)
Systemische Therapie:
- Retinoide wie Acitretin
- Calcineurin-Inhibitoren wie Ciclosporin
- Fumarate
- Methotrexat
- Small Molecules wie Apremilast
- TNF-Inhibitoren wie Etanercept, Infliximab, Adalimumab, Certolizumab
- Anti-IL-12/23-Antikörper wie Ustekinumab
- Anti-IL-23-Antikörper wie Guselkumab, Tildrakizumab, Risankizumab
- Anti-IL-17-Rezeptor-Antikörper wie Brodalumab
- Andere Anti-IL-17-Antikörper wie Secukinumab, Bimekizumab
Psoriasis-Arthritis (PsA) und axiale Spondyloarthritis (axSpA)
Einige der Wirkstoffe (vor allem DMARD), die zur systemischen Therapie bei Plaque-Psoriasis angewendet werden, sind auch bei PsA und axSpA indiziert. Zusätzlich können zur symptomatischen Behandlung von Gelenkbeschwerden NSAR wie Ibuprofen eingenommen werden. Eine patientenindividuelle Bewegungstherapie kann ebenfalls hilfreich sein.
Weitere Informationen sind der jeweiligen Fachinformation zu entnehmen.
- EMA: Fachinformation Secukinumab
- AWMF: S3-Leitlinie Therapie der Psoriasis vulgaris (2021)
- AWMF: Kurzfassung zur S3-Leitlinie Axiale Spondyloarthritis inklusive Morbus Bechterew und Frühformen (2019)
- Freissmuth et al., Pharmakologie und Toxikologie, 2020, Springer
- Mutschler et al., Mutschler Arzneimittelwirkungen, 2019, Wissenschaftliche Verlagsgesellschaft Stuttgart
- McGonagle, Dennis G et al., The role of IL-17A in axial spondyloarthritis and psoriatic arthritis: recent advances and controversies, Annals of the rheumatic diseases, vol. 78, 1167-1178, 2019
-
Cosentyx® 75 mg Injektionslösung in einer Fertigspritze
Novartis Pharma GmbH
-
Cosentyx 150 mg Abacus Injektionslösung in einem Fertigpen
Abacus Medicine A/S
-
Cosentyx 150 mg Abacus Injektionslösung in einer Fertigspritze
Abacus Medicine A/S
-
Cosentyx 150 mg ACA Injektionslösung in einem Fertigpen
A.C.A. Müller ADAG Pharma AG
-
Cosentyx 150 mg axicorp Injektionslösung in einem Fertigpen
axicorp Pharma B.V.
-
Cosentyx 150 mg BB Farma Injektionslösung in einem Fertigpen
BB Farma S.R.L.
-
Cosentyx 150 mg Canoma Injektionslösung in einem Fertigpen
Canoma Pharma GmbH
-
Cosentyx 150 mg Canoma Injektionslösung in einer Fertigspritze
Canoma Pharma GmbH
-
Cosentyx 150 mg CC Pharma Injektionslösung in einem Fertigpen
CC Pharma GmbH
-
Cosentyx 150 mg CC Pharma Injektionslösung in einer Fertigspritze
CC Pharma GmbH
-
Cosentyx 150 mg Eurim Injektionslösung in einem Fertigpen
Eurim-Pharm Arzneimittel GmbH
-
Cosentyx 150 mg European Injektionslösung in einem Fertigpen
European Pharma B.V.
-
Cosentyx 150 mg Fd Pharma Injektionslösung in einem Fertigpen
FD Pharma GmbH
-
Cosentyx 150 mg Haemato Pharm Injektionslösung in einem Fertigpen
HAEMATO PHARM GmbH
-
Cosentyx 150 mg Haemato Pharm Injektionslösung in einer Fertigspritze
HAEMATO PHARM GmbH
-
Cosentyx® 150 mg Injektionslösung in einem Fertigpen
Novartis Pharma GmbH
-
Cosentyx® 150 mg Injektionslösung in einer Fertigspritze
Novartis Pharma GmbH
-
Cosentyx 150 mg kohlpharma Injektionslösung in einem Fertigpen
kohlpharma GmbH
-
Cosentyx 150 mg kohlpharma Injektionslösung in einer Fertigspritze
kohlpharma GmbH
-
Cosentyx 150 mg Medicopharm Injektionslösung in einem Fertigpen
Medicopharm AG
-
Cosentyx 150 mg Orifarm Injektionslösung in einem Fertigpen
Orifarm GmbH
-
Cosentyx 150 mg Orifarm Injektionslösung in einer Fertigspritze
Orifarm GmbH
-
Cosentyx 150 mg Originalis Injektionslösung in einem Fertigpen
Originalis B.V.
-
Cosentyx 150 mg Paranova Injektionslösung in einem Fertigpen
Paranova Pack A/S
-
Cosentyx 150 mg Paranova Injektionslösung in einer Fertigspritze
Paranova Pack A/S
-
Cosentyx 150 mg SynCo pharma Injektionslösung in einem Fertigpen
SynCo pharma B.V.
-
Cosentyx 300 mg Abacus Injektionslösung in einem Fertigpen
Abacus Medicine A/S
-
Cosentyx 300 mg Abacus Injektionslösung in einer Fertigspritze
Abacus Medicine A/S
-
Cosentyx 300 mg ACA Injektionslösung in einem Fertigpen
A.C.A. Müller ADAG Pharma AG
-
Cosentyx 300 mg axicorp Injektionslösung in einem Fertigpen
axicorp Pharma B.V.
-
Cosentyx 300 mg axicorp Injektionslösung in einer Fertigspritze
axicorp Pharma B.V.
-
Cosentyx 300 mg Canoma Injektionslösung in einem Fertigpen
Canoma Pharma GmbH
-
Cosentyx 300 mg CC Pharma Injektionslösung in einem Fertigpen
CC Pharma GmbH
-
Cosentyx 300 mg CC Pharma Injektionslösung in einer Fertigspritze
CC Pharma GmbH
-
Cosentyx 300 mg Eurim Injektionslösung in einem Fertigpen
Eurim-Pharm Arzneimittel GmbH
-
Cosentyx 300 mg Eurim Injektionslösung in einer Fertigspritze
Eurim-Pharm Arzneimittel GmbH
-
Cosentyx 300 mg Haemato Pharm Injektionslösung in einem Fertigpen
HAEMATO PHARM GmbH
-
Cosentyx® 300 mg Injektionslösung in einem Fertigpen
Novartis Pharma GmbH
-
Cosentyx® 300 mg Injektionslösung in einer Fertigspritze
Novartis Pharma GmbH
-
Cosentyx 300 mg kohlpharma Injektionslösung in einem Fertigpen
kohlpharma GmbH
-
Cosentyx 300 mg kohlpharma Injektionslösung in einer Fertigspritze
kohlpharma GmbH
-
Cosentyx 300 mg Medicopharm Injektionslösung in einem Fertigpen
Medicopharm AG
-
Cosentyx 300 mg Orifarm Injektionslösung in einem Fertigpen
Orifarm GmbH
-
Cosentyx 300 mg Orifarm Injektionslösung in einer Fertigspritze
Orifarm GmbH
-
Cosentyx 300 mg Paranova Injektionslösung in einem Fertigpen
Paranova Pack A/S
-
Cosentyx 300 mg Paranova Injektionslösung in einer Fertigspritze
Paranova Pack A/S
-
Cosentyx 300 mg SynCo pharma Injektionslösung in einem Fertigpen
SynCo pharma B.V.