Bevacizumab
Bevacizumab ist ein humanisierter monoklonaler Antikörper der sich gegen den Gefäßwachstumsfaktor VEGF (Vascular Endothelial Growth Factor) richtet. Der Angiogenese-Hemmer wird zur Behandlung verschiedener fortgeschrittener Krebserkrankungen angewendet.
Bevacizumab: Übersicht
Anwendung
Bevacizumab ist ein monoklonalen Antikörper, der an den Gefäßwachstumsfaktor VEGF (Vascular Endothelial Growth Factor) bindet und diesen hemmt. Das Arzneimittel ist somit ein Angiogenese-Hemmer, der die Neubildung von Blutgefäßen inhibiert, die Tumore für ihr Wachstum benötigen. Bevacizumab ist in Kombination mit anderen Arzneimitteln für die Behandlung verschiedener Tumorerkrankungen zugelassen, wie z. B.:
- metastasiertes Kolon- oder Rektumkarzinom
- metastasiertes Mammakarzinom
- inoperables fortgeschrittenes, metastasiertes oder rezidivierendes nicht-kleinzellige Bronchialkarzinom
- fortgeschrittenem und/oder metastasiertem Nierenzellkarzinom
- fortgeschrittenem epithelialem Ovarialkarzinom, Eileiterkarzinom oder primärem Peritonealkarzinom
- rezidivierendem oder metastasiertem Zervixkarzinom
Off-label wird das Präparat u.a. zur Behandlung von altersbedingter Makuladegeneration (AMD) angewendet.
Anwendungsart
Bevacizumab sollte über einen Zeitraum von 90 Minuten über eine i.v.-Infusion appliziert werden. Wenn die erste Infusion gut vertragen wird, kann die zweite Infusion über 60 Minuten erfolgen. Wenn auch diese gut vertragen wurde, können alle folgenden Infusionen über 30 Minuten erfolgen.
Wirkmechanismus
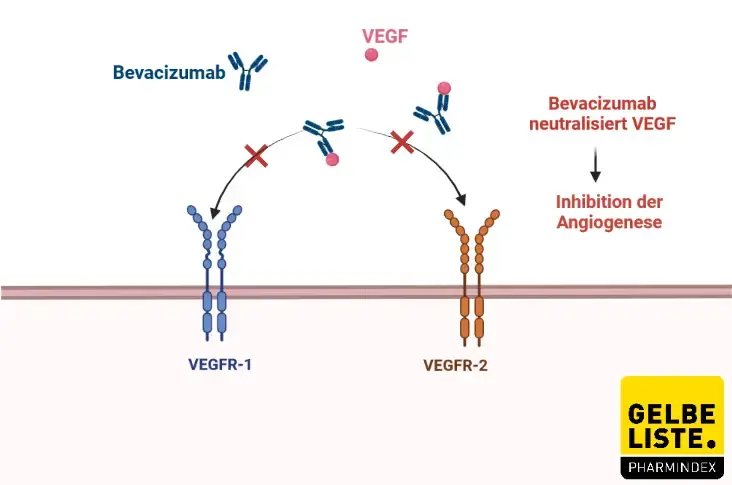
Der monoklonale Antikörper Bevacizumab richtet sich gezielt gegen den Wachstumsfaktor VEGF, der von Tumoren exprimiert wird und für die Bildung neuer Blutgefäße (Angiogenese) sorgt. Durch die Neutralisierung der biologischen Aktivität von VEGF reduziert Bevacizumab die Vaskularisierung von Tumoren, normalisiert das vorhandene Tumorgefäßsystem und hemmt die Bildung neuer Tumorgefäßsysteme, wodurch das Tumorwachstum gehemmt wird.
Pharmakokinetik
Verteilung
Das Volumen des zentralen Kompartiments (Vc) betrug üblicherweise bei weiblichen Patienten 2,73 Liter und bei männlichen Patienten 3,28 Liter. Diese Werte befinden sich in dem Bereich, der für Immunglobuline G (IgG) und andere monoklonale Antikörper beschrieben wurde. Das Volumen des peripheren Kompartiments (Vp) betrug bei Anwendung von Bevacizumab in Kombination mit zytostatischen Wirkstoffen üblicherweise bei weiblichen Patienten 1,69 Liter und bei männlichen Patienten 2,35 Liter. Nach der Korrektur entsprechend dem Körpergewicht hatten männliche Patienten einen höheren Vc-Wert (+ 20%) als Frauen.
Biotransformation
Studien an Kaninchen deuten darauf hin, dass das Stoffwechselprofil von Bevacizumab nach einer i.v. Einmaldosis dem eines nativen, nicht VEGF-bindenden IgG-Moleküls entspricht. Bevacizumab wird ähnlich wie endogenes IgG metabolisiert und eliminiert, d.h. der Abbau erfolgt hauptsächlich proteolytisch überall im Körper, einschließlich der Endothelzellen und die Elimination beruht nicht primär auf den Nieren und der Leber. Die Bindung des IgG an den FcRn-Rezeptor führt zu einem Schutz vor zellulärer Metabolisierung und zu einer langen terminalen Halbwertszeit.
Elimination
Die Clearance beträgt bei weiblichen Patienten durchschnittlich 0,188 Liter/Tag und bei männlichen Patienten durchschnittlich 0,220 Liter/Tag. Nach Korrektur entsprechend dem Körpergewicht hatten die männlichen Patienten eine höhere Bevacizumab-Clearance (+17%) als Frauen. Nach dem Zwei-Kompartiment-Modell beträgt die Eliminationshalbwertszeit für weibliche Patienten üblicherweise 18 Tage und für männliche Patienten 20 Tage.
Dosierung
Die Dosierungsempfehlungen unterscheiden sich je nach Anwendungsgebiet und können der jeweiligen Fachinformation entnommen werden.
Nebenwirkungen
Die am häufigsten in klinischen Studien mit Bevacizumab beobachteten Nebenwirkungen waren:
- Hypertonie
- Fatigue oder Asthenie
- Diarrhö
- Bauchschmerzen
Die schwerwiegendsten Nebenwirkungen waren:
- Magen-Darm-Perforationen
- Blutungen, einschließlich Lungeneinblutung/Bluthusten, die bei Patienten mit nicht-kleinzelligem Bronchialkarzinom häufiger auftreten
- arterielle Thromboembolie
Wechselwirkungen
Kombinationsbehandlung mit Bevacizumab und Sunitinibmaleat
In zwei klinischen Studien zum metastasierten Nierenzellkarzinom wurde bei 7 von 19 Patienten, die gleichzeitig mit Bevacizumab (10 mg/kg alle zwei Wochen) und Sunitinibmaleat (50 mg täglich) behandelt wurden, über das Auftreten einer mikroangiopathischen hämolytischen Anämie berichtet.
Darüber hinaus wurden bei einigen dieser Patienten eine Hypertonie (einschließlich einer hypertensiven Krise), erhöhte Kreatininwerte und neurologische Symptome beobachtet. Alle diese Befunde waren nach Absetzen von Bevacizumab und Sunitinibmaleat reversibel.
Kombinationsbehandlung mit platin- oder taxanhaltigen Therapien
Unter der Kombinationsbehandlung mit platin- oder taxanhaltigen Therapien wurden erhöhte Raten schwerer Neutropenien, febriler Neutropenien oder Infektionen mit oder ohne schwerer Neutropenie (einschließlich einiger Todesfälle) bei NSCLC- oder metastasierten Mammakarzinom- Patienten beobachtet.
Monoklonale EGFR-Antikörper in Kombination mit Bevacizumab und Chemotherapie
Monoklonale EGFR-Antikörper dürfen zur Behandlung des metastasierten Kolorektalkarzinoms nicht zusammen mit Bevacizumab-haltigen Chemotherapie-Schemata angewendet werden. Ergebnisse der randomisierten Phase-III-Studien PACCE und CAIRO-2 bei Patienten mit metastasiertem Kolorektalkarzinom lassen im Vergleich zur alleinigen Anwendung von Bevacizumab plus Chemotherapie auf eine Abnahme des progressionsfreien Überlebens und/oder des Gesamtüberlebens sowie auf eine Zunahme der Nebenwirkungen schließen, wenn die monoklonalen EGFR-Antikörper Panitumumab oder Cetuximab in Kombination mit Bevacizumab plus Chemotherapie gegeben werden.
Kontraindikation
Bevacizumab darf nicht angewendet werden bei:
- Überempfindlichkeit gegen den Wirkstoff oder einen der genannten sonstigen Bestandteile des jeweiligen Arzneimittels
- Überempfindlichkeit gegen CHO-Zellprodukte oder andere rekombinante humane oder humanisierte Antikörper
- Schwangerschaft
Schwangerschaft
Bevacizumab ist während der Schwangerschaft kontraindiziert. Es liegen keine klinischen Studiendaten über die Anwendung bei Schwangeren vor. In tierexperimentellen Studien wurde eine Reproduktionstoxizität einschließlich Missbildungen beobachtet. Da IgGs bekanntermaßen die Plazentaschranke überwinden können; ist zu erwarten, dass Bevacizumab die Angiogenese beim Fetus hemmt, weshalb der Antikörper in Verdacht steht, bei einer Anwendung während der Schwangerschaft schwerwiegende Geburtsfehler zu verursachen
Stillzeit
Es ist nicht bekannt, ob Bevacizumab in die Muttermilch übergeht. Da allerdings humanes IgG in die Muttermilch ausgeschieden wird und Bevacizumab Wachstum und Entwicklung des Säuglings beeinträchtigen könnte, müssen Frauen während der Therapie das Stillen absetzen und dürfen auch bis mindestens sechs Monate nach der letzten Bevacizumab-Anwendung nicht stillen.
Verkehrstüchtigkeit
Bevacizumab hat keinen oder einen zu vernachlässigenden Einfluss auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen. Jedoch wurde über Schläfrigkeit und Synkopen bei der Verwendung von Bevacizumab berichtet. Wenn Patienten Symptome wahrnehmen, die das Sehvermögen, die Konzentration oder die Reaktionsfähigkeit beeinträchtigen, sollte ihnen geraten werden, nicht selbst zu fahren und keine Maschinen zu bedienen, bis die Symptome abgeklungen sind.
Alternativen
Für das Originalpräparat Avastin gibt es seit 1. Juli 2020 zwei zugelassene Biosimilars: Mvasi und Zirabev
Weitere antineovaskuläre Arzneimittel sind:
Wirkstoff-Informationen
- Amgen: Mvasi bevacizumab-awwb
- Fachinformation Avastin
- Fachinformation Zirabev
- Pfizer Zirabev
Abbildung
Created with Biorender.com
-
Abevmy 25 mg/ml Konzentrat zur Herstellung einer Infusionslösung, 4 ml
Biocon Biologics Germany GmbH
-
Abevmy 25 mg/ml Konzentrat zur Herstellung einer Infusionslösung, 16 ml
Biocon Biologics Germany GmbH
-
Alymsys 25 mg/ml CC Pharma Konzentrat zur Herstellung einer Infusionslösung, 16 ml
CC Pharma GmbH
-
Alymsys® 25 mg/ml Konzentrat zur Herstellung einer Infusionslösung, 4 ml
Zentiva Pharma GmbH
-
Alymsys® 25 mg/ml Konzentrat zur Herstellung einer Infusionslösung, 16 ml
Zentiva Pharma GmbH
-
Avastin 25 mg/ml Abacus Konzentrat zur Herstellung einer Infusionslösung, 4 ml
Abacus Medicine A/S
-
Avastin 25 mg/ml Abacus Konzentrat zur Herstellung einer Infusionslösung, 16ml
Abacus Medicine A/S
-
Avastin 25 mg/ml Canoma Konzentrat zur Herstellung einer Infusionslösung, 16 ml
Canoma Pharma GmbH
-
Avastin 25 mg/ml CC Pharma Konzentrat zur Herstellung einer Infusionslösung, 4 ml
CC Pharma GmbH
-
Avastin 25 mg/ml CC Pharma Konzentrat zur Herstellung einer Infusionslösung, 16 ml
CC Pharma GmbH
-
Avastin 25 mg/ml Emra Konzentrat zur Herstellung einer Infusionslösung, 16 ml
Emra-Med Arzneimittel GmbH
-
Avastin 25 mg/ml Eurim Konzentrat zur Herstellung einer Infusionslösung, 4 ml
Eurim-Pharm Arzneimittel GmbH
-
Avastin 25 mg/ml Eurim Konzentrat zur Herstellung einer Infusionslösung, 16 ml
Eurim-Pharm Arzneimittel GmbH
-
Avastin 25 mg/ml Haemato Konzentrat zur Herstellung einer Infusionslösung, 4 ml
HAEMATO PHARM GmbH
-
Avastin 25 mg/ml Haemato Konzentrat zur Herstellung einer Infusionslösung, 16 ml
HAEMATO PHARM GmbH
-
Avastin 25 mg/ml hvd Konzentrat zur Herstellung einer Infusionslösung, 4 ml
hvd medical GmbH
-
Avastin 25 mg/ml hvd Konzentrat zur Herstellung einer Infusionslösung, 16 ml
hvd medical GmbH
-
Avastin 25 mg/ml kohlpharma Konzentrat zur Herstellung einer Infusionslösung, 4 ml
kohlpharma GmbH
-
Avastin 25 mg/ml kohlpharma Konzentrat zur Herstellung einer Infusionslösung, 16 ml
kohlpharma GmbH
-
Avastin® 25 mg/ml Konzentrat zur Herstellung einer Infusionslösung, 4 ml
Roche Pharma AG
-
Avastin® 25 mg/ml Konzentrat zur Herstellung einer Infusionslösung, 16 ml
Roche Pharma AG
-
Avastin 25 mg/ml NMG Pharma Konzentrat zur Herstellung einer Infusionslösung, 4 ml
NMG Pharma GmbH
-
Avastin 25 mg/ml NMG Pharma Konzentrat zur Herstellung einer Infusionslösung, 16 ml
NMG Pharma GmbH
-
Avastin 25 mg/ml Orifarm Konzentrat zur Herstellung einer Infusionslösung, 4 ml
Orifarm GmbH
-
Avastin 25 mg/ml Orifarm Konzentrat zur Herstellung einer Infusionslösung, 16 ml
Orifarm GmbH
-
Avastin 25 mg/ml SynCo pharma Konzentrat zur Herstellung einer Infusionslösung, 4 ml
SynCo pharma B.V.
-
Avastin 25 mg/ml SynCo pharma Konzentrat zur Herstellung einer Infusionslösung, 16 ml
SynCo pharma B.V.
-
Aybintio® 25 mg/ml Konzentrat zur Herstellung einer Infusionslösung, 4 ml
Organon Healthcare GmbH
-
Aybintio® 25 mg/ml Konzentrat zur Herstellung einer Infusionslösung, 16 ml
Organon Healthcare GmbH
-
MVASI 25 mg/ml Eurim Konzentrat zur Herstellung einer Infusionslösung, 4 ml
Eurim-Pharm Arzneimittel GmbH
-
MVASI 25 mg/ml Eurim Konzentrat zur Herstellung einer Infusionslösung, 16 ml
Eurim-Pharm Arzneimittel GmbH
-
MVASI® 25 mg/ml Konzentrat zur Herstellung einer Infusionslösung, 4 ml
Amgen GmbH
-
MVASI® 25 mg/ml Konzentrat zur Herstellung einer Infusionslösung, 16 ml
Amgen GmbH
-
Oyavas® 25 mg/ml Konzentrat zur Herstellung einer Infusionslösung, 4 ml
STADAPHARM GmbH
-
Oyavas® 25 mg/ml Konzentrat zur Herstellung einer Infusionslösung, 16 ml
STADAPHARM GmbH
-
Oyavas 25 mg/ml Konzentrat zur Herstellung einer Infusionslösung, 16 ml HU
STADAPHARM GmbH
-
Oyavas 25 mg/ml Konzentrat zur Herstellung einer Infusionslösung, 16 ml IE
STADAPHARM GmbH
-
Vegzelma 25 mg/ml 1 4U Pharma Konzentrat zur Herstellung zur einer Infusionslösung, 16 ml
1 4 U Pharma GmbH
-
Vegzelma 25 mg/ml Abacus Konzentrat zur Herstellung einer Infusionslösung, 16 ml
Abacus Medicine A/S
-
Vegzelma 25 mg/ml ACA Konzentrat zur Herstellung zur einer Infusionslösung, 16 ml
A.C.A. Müller ADAG Pharma AG
-
Vegzelma 25 mg/ml axicorp Konzentrat zur Herstellung zur einer Infusionslösung, 16 ml
axicorp Pharma B.V.
-
Vegzelma 25 mg/ml Eurim Konzentrat zur Herstellung einer Infusionslösung, 16 ml
Eurim-Pharm Arzneimittel GmbH
-
Vegzelma 25 mg/ml kohlpharma Konzentrat zur Herstellung einer Infusionslösung, 16 ml
kohlpharma GmbH
-
VEGZELMA 25 mg/ml Konzentrat zur Herstellung einer Infusionslösung, 4 ml
Celltrion Healthcare Deutschland GmbH
-
VEGZELMA 25 mg/ml Konzentrat zur Herstellung einer Infusionslösung, 16 ml
Celltrion Healthcare Deutschland GmbH
-
Vegzelma 25 mg/ml SynCo pharma Konzentrat zur Herstellung einer Infusionslösung, 4 ml
SynCo pharma B.V.
-
Vegzelma 25 mg/ml SynCo pharma Konzentrat zur Herstellung einer Infusionslösung, 16 ml
SynCo pharma B.V.
-
Zirabev 25 mg/ml Abacus Konzentrat zur Herstellung einer Infusionslösung, 16 ml
Abacus Medicine A/S
-
Zirabev 25 mg/ml axicorp Konzentrat zur Herstellung einer Infusionslösung, 16 ml
axicorp Pharma B.V.
-
Zirabev® 25 mg/ml Konzentrat zur Herstellung einer Infusionslösung, 4 ml
Pfizer Pharma GmbH














