Emtricitabin
Emtricitabin ist ein Cytidin-Analogon und nukleosidischer Reverse-Transkriptase-Inhibitor (NRTI), der in Kombination mit anderen antiretroviralen Wirkstoffen, insbesondere Tenofovir, zur Behandlung einer Infektion mit dem humanen Immundefizienzvirus 1 (HIV-1) indiziert ist.
Emtricitabin: Übersicht
Anwendung
Emtricitabin wird in Kombination mit anderen antiretroviralen Wirkstoffen angewendet zur Behandlung von Erwachsenen und Kindern ab 4 Monaten, die mit dem humanen Immundefizienzvirus 1 (HIV-1) infiziert sind.
Diese Indikation beruht auf Studien an nicht vorbehandelten Patienten und an vorbehandelten Patienten mit stabiler virologischer Kontrolle. Es liegen keine Erfahrungswerte über die Anwendung von Emtricitabin bei Patienten vor, deren gegenwärtige Therapie versagt oder die ein mehrfaches Therapieversagen aufweisen.
In Kombination mit Tenofovirdisoproxil (Truvada) wird Emtricitabin angewendet zur:
- Behandlung einer HIV-1-Infektion zusammen mit weiteren antiretroviralen Arzneimitteln bei Erwachsenen und bei Jugendlichen, bei denen der Einsatz von First-Line-Arzneimitteln aufgrund einer Resistenz gegenüber NRTI oder aufgrund von Unverträglichkeiten ausgeschlossen ist.
- Präexpositions-Prophylaxe (PrEP) in Kombination mit Safer-Sex-Praktiken zur Reduktion des Risikos einer sexuell erworbenen HIV-1-Infektion bei Erwachsenen und Jugendlichen mit hohem HIV-Risiko.
Anwendungsart
Emtricitabin ist als Hartkapsel (200 mg), als Lösung zum Einnehmen (10 mg/ml) oder in Kombination mit Tenofovirdisoproxil als Filmtablette (200 mg) erhältlich.
Die Therapie sollte nur durch einen Arzt eingeleitet werden, der in der Behandlung der HIV-Infektion erfahren ist.
Bei der Entscheidung über ein neues Behandlungsschema für Patienten, bei denen eine antiretrovirale Therapie versagt hat, müssen die Mutationsmuster der verschiedenen Arzneimittel und vorangegangene Therapien beim einzelnen Patienten sorgfältig berücksichtigt werden. Ein Resistenztest könnte angebracht sein.
Wirkmechanismus
Emtricitabin ist ein synthetisches Analogon des Nukleosids Cytidin, das spezifisch gegen HIV-1, HIV-2 und das Hepatitis-B-Virus (HBV) wirkt. Nach der Phosphorylierung zur Wirkform Emtricitabin-5‘-Triphosphat durch zelluläre Enzyme inhibiert dieses die Reverse Transkriptase (RT) von HIV-1 kompetitiv, was zu einem DNA-Kettenabbruch führt. Aufgrund der chemischen Struktur und des pharmakologischen Wirkprinzips wird Emtricitabin als nukleosidischer Reverse-Transkriptase-Inhibitor (NRTI) bezeichnet. Die DNA-Polymerasen α, β und ε und die mitochondriale DNA-Polymerase γ von Säugetieren wird von Emtricitabin nur geringfügig gehemmt.
Der IC50-Wert von Emtricitabin für Laborstämme und klinische HIV-1-Isolate liegt im Bereich zwischen 0,0013 und 0,5 μmol/l.
Die HIV-1-Resistenz gegen Emtricitabin entwickelt sich durch Veränderungen am Codon 184 der HIV-eigenen Reversen Transkriptase (statt Methionin wird Valin kodiert, auch eine Isoleucin-Zwischenstufe wurde beobachtet). Diese HIV-1-Mutation wurde sowohl in vitro als auch bei HIV-1- infizierten Patienten beobachtet.
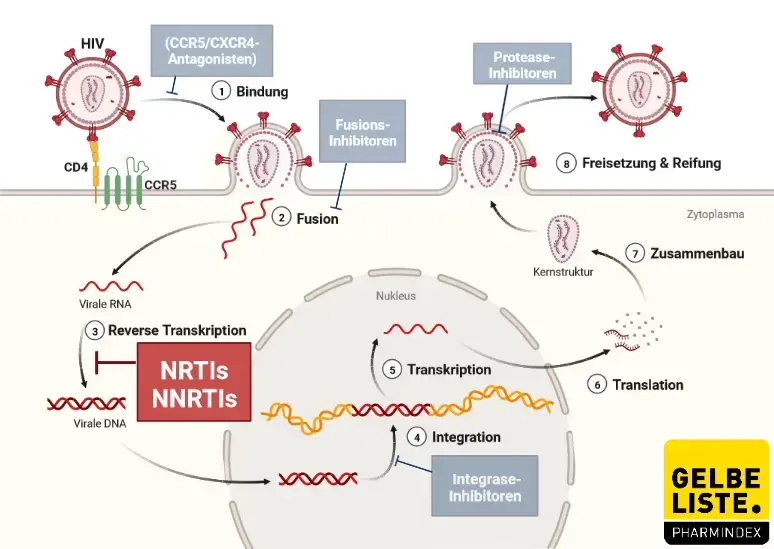
Nukleosidanaloga sind erst wirksam nachdem sie in der Zelle phosphoriliert wurden: Dabei werden schrittweise drei Phosphatreste übertragen. Der Einbau der Nukleosidanaloga als falschen DNA-Baustein während der reversen Transkription bewirkt dann eine Unterbrechung in der neu gebildeten DNA-Kette und führt zum Abbruch der Polymerisation und damit der reversen Transkription.
Pharmakokinetik
Resorption
- Nach oraler Einnahme wird Emtricitabin schnell und extensiv resorbiert.
- Maximale Plasmakonzentrationen werden nach 1-2 Stunden erreicht.
- Die absolute Bioverfügbarkeit von Emtricitabin als 200 mg Hartkapsel bzw. als 10 mg/ml Lösung zum Einnehmen wird auf 93 % bzw. 75 % geschätzt.
- Die systemische Exposition wird bei gleichzeitiger Einnahme mit einer stark fetthaltigen Mahlzeit nicht beeinträchtigt (unabhängig von der Darreichungsform).
Verteilung
- Im Konzentrationsbereich von 0,02-200 μg/ml liegt die Proteinbindung von Emtricitabin an humane Plasmaproteine in vitro bei < 4 % (konzentrationsunabhängig).
- Das mittlere Plasma-Blut-Konzentrationsverhältnis liegt bei etwa 1,0.
- Emtricitabin wird vermutlich stark im gesamten Körper verteilt, sowohl in intrazelluläre als auch extrazelluläre Flüssigkeitsräume.
Metabolismus (Biotransformation)
- Emtricitabin wird nur in geringem Umfang metabolisiert.
- Die Biotransformation umfasst die Oxidation des Thiol-Anteils zu 3’-Sulfoxid-Diastereomeren (ca. 9 % der Dosis) sowie die Konjugation mit Glucuronsäure zu 2’-O-Glucuronid (ca. 4 % der Dosis).
Elimination
- Emtricitabin wird primär renal eliminiert, wobei die Dosis vollständig über Urin (ca. 86 %) und Fäzes (ca. 14 %) ausgeschieden wird.
- 13 % der Emtricitabin-Dosis liegen im Urin in Form von drei Metaboliten vor.
- Die systemische Clearance von Emtricitabin beträgt im Durchschnitt 307 ml/min (4,03 ml/min/kg).
- Nach oraler Anwendung liegt die Eliminationshalbwertszeit von Emtricitabin bei ca. 10 Stunden.
Linearität
Die Pharmakokinetik von Emtricitabin ist in einem Dosisbereich von 25-200 mg nach einmaliger oder wiederholter Anwendung proportional zur Dosis.
Unterschiedliche Patientenpopulationen
- Nierenfunktionsstörung: Die systemische Exposition gegenüber Emtricitabin (Mittel ± Standardabweichung) liegt bei Probanden mit normaler Nierenfunktion bei 11,8 ± 2,9 μg·h/ml und steigt bei Patienten mit leichter Nierenfunktionsstörung auf 19,9 ± 1,1, bei Patienten mit mittelgradiger Nierenfunktionsstörung auf 25,0 ± 5,7 und bei Patienten mit schwerwiegender Nierenfunktionsstörung auf 34,0 ± 2,1 μg·h/ml. Bei Patienten mit einer Kreatinin-Clearance < 30 ml/min muss die Dosis bzw. das Dosisintervall angepasst werden
- Leberfunktionsstörung: Die Pharmakokinetik von Emtricitabin wurde bei Patienten ohne HBV-Infektion, die unterschiedlich stark ausgeprägte Leberinsuffizienzen aufwiesen, nicht untersucht. Im Allgemeinen ähnelte die Pharmakokinetik von Emtricitabin bei HBV-infizierten Patienten der von gesunden und HIV-infizierten Probanden. Auf Grund der minimalen Metabolisierung von Emtricitabin und der renalen Eliminationsroute ist es jedoch unwahrscheinlich, dass bei Patienten mit Leberinsuffizienz eine Dosisanpassung erforderlich wird.
Dosierung
Auf Grund einer unterschiedlichen Bioverfügbarkeit von Emtricitabin in den Darreichungsformen Hartkapsel und Lösung zum Einnehmen sollten 240 mg Emtricitabin in Form der Lösung zum Einnehmen (24 ml) zu ähnlichen Plasmakonzentrationen wie die Einnahme einer 200 mg Hartkapsel Emtricitabin führen.
Hartkapsel:
- 200 mg oral 1x täglich (nahrungsunabhängig)
Lösung zum Einnehmen:
- 240 mg (24 ml) 1x täglich (nahrungsunabhängig)
Wenn ein Patient die Einnahme um bis zu 12 Stunden gegenüber der gewohnten Einnahmezeit versäumt, sollte er die Einnahme so bald wie möglich nachholen und das gewohnte Einnahmeschema fortsetzen.
Wenn die Einnahme um mehr als 12 Stunden versäumt wird und es fast Zeit für die nächste Dosis ist, sollte die versäumte Dosis nicht nachgeholt und einfach das gewohnte Einnahmeschema fortgesetzt werden.
Wenn der Patient innerhalb von einer Stunde nach der Einnahme erbricht, sollte eine weitere Dosis eingenommen werden. Erfolgt das Erbrechenspäter als eine Stunde nach der Einnahme, ist keine weitere Dosis erforderlich.
Nebenwirkungen
Die häufigsten Nebenwirkungen, die im Zusammenhang mit Emtricitabin auftreten können, sind:
- Diarrhö
- Kopfschmerzen
- Erhöhung der Kreatininkinase
- Übelkeit
- Anämie
- Verfärbung der Haut (häufiger bei pädiatrischen Patienten)
Zu den schwerwiegendsten Nebenwirkungen zählen:
- Angioödem
- Immun-Reaktivierungs-Syndrom (entzündliche Reaktion auf asymptomatische oder residuale opportunistische Infektionen zum Zeitpunkt der Therapieeinleitung bei schwerem Immundefekt)
- Osteonekrose (bei Patienten mit Risikofaktoren, fortgeschrittener HIV-Erkrankung oder Langzeitanwendung einer antiretroviralen Therapie)
- Akute Exazerbationen einer Hepatitis (bei Absetzen der Therapie und HBV-Koinfektion)
Wechselwirkungen
Bei der Anwendung von Emtricitabin sind folgende Wechselwirkungen zu beachten:
- Emtricitabin wird primär durch glomeruläre Filtration und aktive tubuläre Sekretion ausgeschieden, sodass sich bei der gleichzeitigen Anwendung von Emtricitabin und Arzneimitteln, die durch aktive tubuläre Sekretion ausgeschieden werden, die Serumkonzentration von Emtricitabin oder dem gleichzeitig angewendeten Arzneimittel erhöhen kann (wegen der Konkurrenz um diesen Eliminationsweg).
Emtricitabin hemmt in vitro keine der Stoffwechselreaktionen, die von den humanen CYP450-Isoformen 1A2, 2A6, 2B6, 2C9, 2C19, 2D6 und 3A4 vermittelt werden. CYP450-vermittelte Wechselwirkungen sind deshalb unwahrscheinlich.
Auch die für die Glucuronidierung verantwortlichen Enzymsysteme werden durch Emtricitabin nicht gehemmt.
Kontraindikationen
Emtricitabin ist kontraindiziert bei Überempfindlichkeit gegen den Wirkstoff oder sonstige Bestandteile des Arzneimittels.
Schwangerschaft
Weitergehende Erfahrungen an schwangeren Frauen (zwischen 300 und 1.000 Schwangerschaftsausgänge) deuten nicht auf ein Fehlbildungsrisiko oder eine fetale/neonatale Toxizität in Verbindung mit Emtricitabin hin. Tierexperimentelle Studien ergaben keine Hinweise auf eine Reproduktionstoxizität.
Falls notwendig kann eine Anwendung von Emtricitabin während der Schwangerschaft in Betracht gezogen werden.
Stillzeit
Emtricitabin geht in die Muttermilch über. Es gibt allerdings nur ungenügende Informationen darüber, ob Emtricitabin Auswirkungen auf Neugeborene/Kinder hat. Daher soll Emtriva während der Stillzeit nicht angewendet werden.
Generell wird empfohlen, dass HIV-infizierte Frauen ihre Kleinkinder auf keinen Fall stillen, um eine Übertragung von HIV auf das Kind zu vermeiden.
Verkehrstüchtigkeit
Es wurden keine Studien zu den Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen durchgeführt. Die Patienten sollten allerdings darüber informiert werden, dass im Zusammenhang mit der Anwendung von Emtricitabin über Schwindelgefühle berichtet wurde.
Anwendungshinweise
Emtricitabin wird nicht als Monotherapeutikum zur Behandlung einer HIV-Infektion empfohlen, sondern muss in Kombination mit anderen antiretroviralen Arzneimitteln angewendet werden. Der Wirkstoff darf jedoch nicht mit anderen Arzneimitteln angewendet werden, die Emtricitabin oder Lamivudin enthalten.
Opportunistische Infektionen
- Patienten, die Emtricitabin oder eine andere antiretrovirale Therapie erhalten, können dennoch opportunistische Infektionen und sonstige Komplikationen einer HIV-Infektion entwickeln.
- Deshalb ist auch weiterhin eine engmaschige klinische Überwachung durch Ärzte erforderlich, die in der Behandlung von Patienten mit Begleiterkrankungen einer HIV-Infektion erfahren sind.
HIV-Übertragung
- Obwohl gezeigt wurde, dass die erfolgreiche Virussuppression durch eine antiretrovirale Therapie das Risiko einer sexuellen Übertragung erheblich reduziert, kann ein Restrisiko nicht ausgeschlossen werden.
- Demnach sollten Vorsichtsmaßnahmen zur Vermeidung der Übertragung gemäß nationaler Leitlinien getroffen werden.
Nierenfunktion
- Emtricitabin wird hauptsächlich renal durch glomeruläre Filtration und aktive tubuläre Sekretion ausgeschieden, weshalb die Exposition gegenüber Emtricitabin bei Patienten mit einer schweren Niereninsuffizienz (Kreatinin-Clearance < 30 ml/min), die täglich 200 mg Emtricitabin als Hartkapseln oder 240 mg als Lösung zum Einnehmen anwenden, deutlich erhöht sein kann (Tagesdosisreduktion oder Dosisintervallanpassung).
- Vorsicht ist geboten, wenn Emtricitabin gleichzeitig mit Arzneimitteln angewendet wird, die durch aktive tubuläre Sekretion ausgeschieden werden, da sich in diesem Fall wegen der Konkurrenz um diesen Eliminationsweg die Serumkonzentration von Emtricitabin oder dem gleichzeitig angewendeten Arzneimittel erhöhen kann.
Gewicht und metabolische Parameter
- Während einer antiretroviralen Therapie können eine Gewichtszunahme und ein Anstieg der Blutlipid-und Blutglukosewerte auftreten (diese Veränderungen können teilweise mit dem verbesserten Gesundheitszustand und dem Lebensstil zusammenhängen).
- In einigen Fällen ist ein Einfluss der Behandlung auf die Blutlipidwerte erwiesen, während es für die Gewichtszunahme keinen klaren Nachweis eines Zusammenhangs mit einer bestimmten Behandlung gibt.
- Für die Überwachung der Blutlipid- und Blutglukosewerte wird auf die anerkannten HIV-Therapieleitlinien verwiesen (die Behandlung von Lipidstörungen sollte nach klinischem Ermessen erfolgen).
Leberfunktion
- Patienten mit bestehender Leberfunktionsstörung einschließlich einer chronischen aktiven Hepatitis weisen häufiger Leberfunktionsstörungen während einer antiretroviralen Kombinationstherapie auf und müssen gemäß der üblichen Praxis überwacht werden.
- Patienten mit chronischer HBV oder -HCV-Infektion, die eine ART erhalten, weisen ein erhöhtes Risiko für schwerwiegende und potenziell tödliche hepatische Nebenwirkungen auf (zeigen diese Patienten Anzeichen von Exazerbationen der Lebererkrankung, muss erwogen werden, die Behandlung zu unterbrechen oder abzusetzen).
Patienten mit HBV-Koinfektion
- Emtricitabin ist in vitro gegen HBV wirksam, wobei nur begrenzte Daten zur Sicherheit und Wirksamkeit von Emtricitabin (als 200 mg Hartkapsel 1x täglich) bei Patienten mit HIV/HBV-Koinfektion vorliegen.
- Die Anwendung von Emtricitabin bei Patienten mit chronischer HBV führt zu den gleichen Mutationsmustern im YMDD-Motiv wie eine Therapie mit Lamivudin (die YMDD-Mutation führt zu einer Resistenz gegen Emtricitabin und Lamivudin).
- Patienten mit HIV- und HBV-Koinfektion müssen wegen möglicher Hepatitis-Exazerbationen noch mindestens mehrere Monate nach Beendigung der Emtricitabin-Behandlung sorgfältig klinisch und anhand von Laboruntersuchungen überwacht werden (hauptsächlich durch eine Erhöhung der Serum-Alaninaminotransferase-Werte (ALT) sowie das erneute Auftreten von HBV-DNA nachweisbar).
- Bei einigen dieser Patienten war die Reaktivierung des HBV-Virus mit schweren Lebererkrankungen einschließlich Dekompensation und Leberversagen assoziiert.
Immun-Reaktivierungs-Syndrom
- Bei HIV-infizierten Patienten mit schwerem Immundefekt kann sich zum Zeitpunkt der Einleitung einer ART eine entzündliche Reaktion auf asymptomatische oder residuale opportunistische Infektionen entwickeln, die zu schweren klinischen Verläufen oder Verschlechterung von Symptomen führt (typischerweise wurden solche Reaktionen innerhalb der ersten Wochen oder Monate nach Beginn der ART beobachtet).
- Entsprechende Beispiele sind unter anderem CMV-Retinitis, disseminierte und/oder lokalisierte mykobakterielle Infektionen und Pneumocystis-jirovecii-Pneumonie (jedes Entzündungssymptom ist zu bewerten, falls notwendig ist eine Behandlung einzuleiten).
- Es liegen auch Berichte über Autoimmunerkrankungen (wie z. B. Morbus Basedow und Autoimmunhepatitis) vor, die im Rahmen einer Immun-Reaktivierung auftraten (der Zeitpunkt des Auftretens ist allerdings sehr variabel, weshalb diese Ereignisse viele Monate nach Beginn der Behandlung auftreten können).
Osteonekrose
- Obwohl eine multifaktorielle Ätiologie angenommen wird (darunter Anwendung von Kortikosteroiden, Alkoholkonsum, schwere Immunsuppression, höherer Body-Mass-Index), wurden Fälle von Osteonekrose insbesondere bei Patienten mit fortgeschrittener HIV-Erkrankung und/oder Langzeitanwendung einer ART berichtet.
- Die Patienten sind darauf hinzuweisen, bei Auftreten von Gelenkbeschwerden und -schmerzen, Gelenksteife oder Bewegungsschwierigkeiten den Arzt aufzusuchen.
Alternativen
Zur antiretroviralen Therapie (ART) können alternativ bzw. ergänzend folgende Wirkstoffe eingesetzt werden:
- Entry-Inhibitoren: CCR5-Antagonisten wie Maraviroc und Fusionshemmer wie Enfurvitid
- Nukleosidische Reverse-Transkriptase-Inhibitoren (NRTI) wie Lamivudin und Abacavir
- Nicht-nukleosidische Reverse-Transkriptase-Inhibitoren (NNRTI) wie Efavirenz, Nevirapin und Rilpivirin
- Nukleotidische Reverse-Transkriptase-Inhibitoren (NtRTI) wie Tenofovir
- Integrase-Inhibitoren (INI) wie Dolutegravir, Elvitegravir und Raltegravir
- HIV-Protease-Inhibitoren (PI) wie Darunavir, Lopinavir und Ritonavir (meist als „Booster“, Kennzeichnung /r)
Weitere Informationen sind der jeweiligen Fachinformation zu entnehmen.
Wirkstoff-Informationen
- EMA: Emtriva
- EMA: Truvada
- Freissmuth et al., Pharmakologie und Toxikologie, 2020, Springer
- Mutschler et al., Mutschler Arzneimittelwirkungen, 2019, Wissenschaftliche Verlagsgesellschaft Stuttgart
- AWMF: Deutsch-Österreichische Leitlinien zur antiretroviralen Therapie der HIV-1-Infektion
Abbildung:
Adapted from „HIV Sites for Therapeutic Intervention”, by BioRender.com
-
Atripla 600 mg/200 mg/245 mg Canoma Filmtabletten
Canoma Pharma GmbH
-
Atripla 600 mg/200 mg/245 mg Haemato-Pharm Filmtabletten
HAEMATO PHARM GmbH
-
Biktarvy® 30 mg/120 mg/15 mg Filmtabletten, Kind
GILEAD Sciences GmbH
-
Biktarvy 50 mg/200 mg/25 mg CC Pharma Filmtabletten
CC Pharma GmbH
-
Biktarvy® 50 mg/200 mg/25 mg Filmtabletten
GILEAD Sciences GmbH
-
Biktarvy 50 mg/200 mg/25 mg Paranova Filmtabletten
Paranova Pack A/S
-
Descovy® 200 mg/10 mg Filmtabletten
GILEAD Sciences GmbH
-
Descovy® 200 mg/25 mg Filmtabletten
GILEAD Sciences GmbH
-
Efavemten® 600 mg/200 mg/245 mg Filmtabletten
TAD Pharma GmbH
-
Efavirenz/Emtricitabin/Tenofovirdisoproxil Glenmark 600 mg/200 mg/245 mg Filmtabletten
Glenmark Arzneimittel GmbH
-
Efavirenz/Emtricitabin/Tenofovirdisoproxil Heumann 600 mg/200 mg/245 mg Filmtabletten
Heumann Pharma GmbH & Co. Generica KG
-
Efavirenz/Emtricitabin/Tenofovirdisoproxil Mylan 600 mg/200 mg/245 mg Abacus Filmtabletten
Abacus Medicine A/S
-
Efavirenz/Emtricitabin/Tenofovirdisoproxil Mylan 600 mg/200 mg/245 mg BB Farma Filmtabletten
BB Farma S.R.L.
-
Efavirenz/Emtricitabin/Tenofovirdisoproxil Mylan 600 mg/200 mg/245 mg Filmtabletten
Viatris Healthcare GmbH
-
Efavirenz/Emtricitabin/Tenofovirdisoproxil PUREN 600 mg/200 mg/245 mg Filmtabletten
PUREN Pharma GmbH & Co. KG
-
Efavirenz/Emtricitabin/Tenofovirdisoproxil-ratiopharm® 600 mg/200 mg/245 mg Filmtabletten
ratiopharm GmbH
-
Efavirenz/Emtricitabin/Tenofovirdisoproxil-Teva 600 mg/200 mg/245 mg BB Farma Filmtabletten
BB Farma S.R.L.
-
Efavirenz/Emtricitabin/Tenofovirdisoproxil Zentiva 600 mg/200 mg/245 mg Abacus Filmtabletten
Abacus Medicine A/S
-
Efavirenz/Emtricitabin/Tenofovirdisoproxil Zentiva 600 mg/200 mg/245 mg BB Farma Filmtabletten
BB Farma S.R.L.
-
Efavirenz/Emtricitabin/Tenofovirdisoproxil Zentiva 600 mg/200 mg/245 mg CC Pharma Filmtabletten
CC Pharma GmbH
-
Efavirenz/Emtricitabin/Tenofovirdisoproxil Zentiva 600 mg/200 mg/245 mg Eurim Filmtabletten
Eurim-Pharm Arzneimittel GmbH
-
Efavirenz/Emtricitabin/Tenofovirdisoproxil Zentiva 600 mg/200 mg/245 mg Filmtabletten
Zentiva Pharma GmbH
-
Efavirenz/Emtricitabin/Tenofovirdisoproxil Zentiva 600 mg/200 mg/245 mg kohlpharma Filmtabletten
kohlpharma GmbH
-
Emtenovo® 200 mg/245 mg Filmtabletten
TAD Pharma GmbH
-
Emtricitabin/Tenofovirdisoproxil Abdi 200 mg/245 mg Filmtabletten
Abdi Farma GmbH
-
Emtricitabin/Tenofovirdisoproxil AL 200 mg/245 mg Filmtabletten
ALIUD PHARMA® GmbH
-
Emtricitabin/Tenofovirdisoproxil Amarox 200 mg/245 mg Filmtabletten
Amarox Pharma GmbH
-
Emtricitabin/Tenofovirdisoproxil beta 200 mg/245 mg Filmtabletten
betapharm Arzneimittel GmbH
-
Emtricitabin/Tenofovirdisoproxil Cipla 200 mg/245 mg Filmtabletten
Cipla Europe NV
-
Emtricitabin/Tenofovirdisoproxil Heumann 200 mg/245 mg Filmtabletten
Heumann Pharma GmbH & Co. Generica KG
-
Emtricitabin/Tenofovirdisoproxil Hormosan 200 mg/245 mg Filmtabletten
Hormosan Pharma GmbH
-
Emtricitabin/Tenofovirdisoproxil Laurus 200 mg/245 mg Filmtabletten
Laurus Generics GmbH
-
Emtricitabin/Tenofovirdisoproxil Mylan 200 mg/245 mg BB Farma Filmtabletten
BB Farma S.R.L.
-
Emtricitabin/Tenofovirdisoproxil Mylan 200 mg/245 mg Filmtabletten
Viatris Healthcare GmbH
-
Emtricitabin/Tenofovirdisoproxil Mylan 200 mg/245 mg kohlpharma Filmtabletten
kohlpharma GmbH
-
Emtricitabin/Tenofovirdisoproxil PUREN 200 mg/245 mg Filmtabletten
PUREN Pharma GmbH & Co. KG
-
Emtricitabin/Tenofovirdisoproxil-ratiopharm® 200 mg/245 mg Filmtabletten
ratiopharm GmbH
-
Emtricitabin/Tenofovirdisoproxil Teva 200 mg/245 mg BB Farma Filmtabletten
BB Farma S.R.L.
-
Emtricitabin/Tenofovirdisoproxil Zentiva 200 mg/245 mg BB Farma Filmtabletten
BB Farma S.R.L.
-
Emtricitabin Tenofovirdisoproxil Zentiva 200 mg/245 mg Filmtabletten
Zentiva Pharma GmbH
-
Emtriva® 10 mg/ml Lösung zum Einnehmen
GILEAD Sciences GmbH
-
Emtriva 200 mg CC Pharma Hartkapseln
CC Pharma GmbH
-
Emtriva 200 mg Emra Hartkapseln
Emra-Med Arzneimittel GmbH
-
Emtriva 200 mg Eurim Hartkapseln
Eurim-Pharm Arzneimittel GmbH
-
Emtriva 200 mg Haemato Pharm Hartkapseln
HAEMATO PHARM GmbH
-
Emtriva® 200 mg Hartkapseln
GILEAD Sciences GmbH
-
Emtriva 200 mg kohlpharma Hartkapseln
kohlpharma GmbH
-
Eviplera 200 mg/25 mg/245 mg 2care4 Filmtabletten
2care4 ApS
-
Eviplera 200 mg/25 mg/245 mg Abacus Filmtabletten
Abacus Medicine A/S
-
Eviplera 200 mg/25 mg/245 mg ACA Filmtabletten
A.C.A. Müller ADAG Pharma AG













