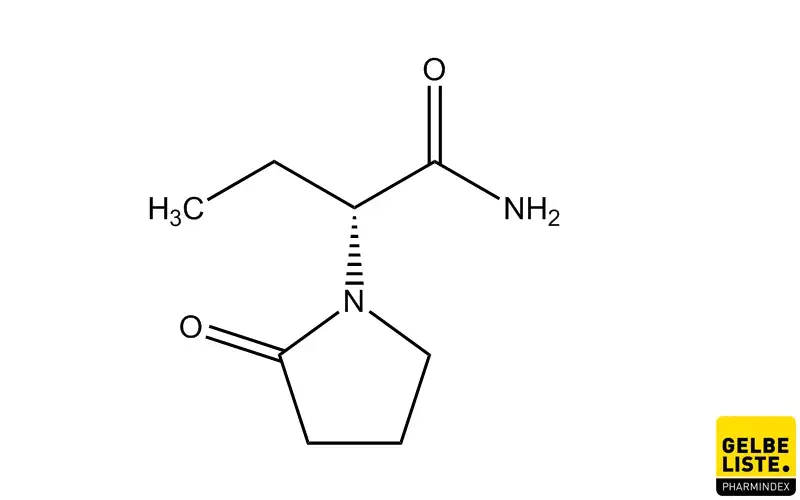
Levetiracetam
Levetiracetam ist ein Wirkstoff aus der Gruppe der Antiepiletika, der vor allem gegen Epilepsie bei fokalen Anfällen mit und ohne Generalisierung bei Patienten ab 16 Jahren zugelassen ist.
Levetiracetam: Übersicht
Anwendung
Levetiracetam ist bei Patienten ab 16 Jahren mit neu diagnostizierter Epilepsie zugelassen zur Monotherapie partieller Anfälle mit und ohne sekundärer Generalisierung.
Als Zusatztherapie kann es angewendet werden zur Behandlung fokaler Anfälle bei Erwachsenen und Kindern einschließlich Säuglingen ab einem Monat mit Epilepsie.
Im Rahmen eines Gesamttherapiekonzepts kann es bei Erwachsenen und Jugendlichen ab 12 Jahren auch zur Behandlung myoklonischer Anfälle bei juveniler myoklonischer Epilepsie (Janz-Syndrom) sowie primär generalisierter tonisch-klonischer Anfällen (schwere Grand mal-Anfälle mit Bewusstlosigkeit) bei idiopathisch generalisierter Epilepsie eingesetzt werden.
Wirkmechanismus
Der Wirkmechanismus beruht auf der Bindung an das synaptische Vesikelprotein SV2A. Daraus resultiert eine herabgesetzte Freisetzung von Glutamat aus dem präsynaptischen Vesikel und eine Veränderung der neuronalen Reizweiterleitung.
In-vitro-Daten zeigen, dass der durch N-Typ-Kanäle vermittelte Ca2+-Strom partiell inhibiert und die Freisetzung von Ca2+ aus intraneuronalen Speichern vermindert wird. Außerdem kehrt Levetiracetam partiell die Reduktion der GABA- und Glycin-gesteuerten Ströme um, die durch Zink und β-Carboline induziert wird. Der genaue molekulare Wirkmechanismus ist jedoch noch nicht vollständig aufgeklärt.
Pharmakokinetik
Levetiracetam ist sehr gut löslich und membrangängig. Es wird nach oraler Gabe dosisunabhängig, rasch und vollständig resorbiert. Die orale absolute Bioverfügbarkeit beträgt nahezu 100 %. Maximale Plasmakonzentrationen werden bei Erwachsenen 1,3 Stunden nach der Einnahme erzielt. Bei zweimal täglicher Gabe wird die Steady-State-Konzentration nach 2 Tagen erreicht.
Die Clearance verändert sich nach wiederholter Anwendung nicht. Aufgrund der vollständigen und linearen Resorption von Levetiracetam ist es möglich, die Plasmaspiegel anhand der oralen Dosis (mg/kg Körpergewicht) vorherzusagen. Eine Überwachung der Plasmaspiegel von Levetiracetam ist daher nicht notwendig. Bei eingeschränkter Nierenfunktion korreliert die Gesamtkörperclearance mit der Kreatinin-Clearance. Bei Kindern und Jugendlichen bis zu 12 Jahren ist die Gesamtkörperclearance um etwa 30% höher als bei erwachsenen Epilepsiepatienten. Insbesondere bei Kindern unter 4 Jahren hat sowohl das Alter als auch das Körpergewicht einen Einfluss auf die Clearance und das Verteilungsvolumen.
Im Menschen wird Levetiracetam nicht extensiv metabolisiert. Weder Levetiracetam noch sein primärer Metabolit werden signifikant an Plasmaproteine gebunden.
Das Verteilungsvolumen von Levetiracetam beträgt annähernd 0,5 bis 0,7 l/kg, und liegt damit nahe am Volumen des Gesamtkörperwassers.
Die Plasmahalbwertszeit bei Erwachsenen beträgt 7 ± 1 Stunden und verlängert sich bei älteren Patienten aufgrund einer verminderten Nierenfunktion um etwa 40% (10 bis 11 Stunden).
Nebenwirkungen
Die am häufigsten berichteten Nebenwirkungen waren Nasopharyngitis, Somnolenz, Kopfschmerzen, Müdigkeit und Schwindel.
Im Folgenden sind die Nebenwirkungen von Levetiracetam nach ihrer Häufigkeit aufgelistet:
Sehr häufig:
- Nasopharyngitis
- Somnolenz
- Kopfschmerzen.
Häufig:
- Anorexie
- Depression, Feindseligkeit/Aggression, Angst, Insomnie, Nervosität/Reizbarkeit
- Konvulsion, Gleichgewichtsstörungen, Schwindel, Lethargie, Tremor
- Drehschwindel
- Husten
- Abdominalschmerzen, Diarrhoe, Dyspepsie, Erbrechen, Nausea
- Rash
- Asthenie/Müdigkeit.
Gelegentlich:
- Thrombozytopenie, Leukopenie
- Gewichtsverlust, Gewichtszunahme
- Suizidversuch und suizidale Gedanken, psychotische Störungen, anormales Verhalten, Halluzination, Wut, Konfusion, Panikattacke, emotionale Labilität/Stimmungsschwankungen, Agitiertheit
- Amnesie, Beeinträchtigung des Gedächtnisses, Koordinationsstörungen/Ataxie, Parästhesie, Aufmerksamkeitsstörungen
- Diplopie, verschwommenes Sehen
- Anormaler Leberfunktionstest
- Alopezie, Ekzem, Juckreiz
- Muskelschwäche, Myalgie
- Verletzung.
Selten:
- Infektion
- Panzytopenie, Neutropenie, Agranulozytose
- Arzneimittelexanthem mit Eosinophilie und systemischen Symptomen (DRESS), Überempfindlichkeit (einschließlich Angioödem und Anaphylaxie)
- Hyponatriämie
- Suizid, Persönlichkeitsstörungen, anormales Denken
- Choreoathetose, Dyskinesie, Hyperkinesie
- Pankreatitis
- Leberversagen, Hepatitis
- Akute Nierenschädigung
- Toxische epidermale Nekrolyse, Stevens-Johnson-Syndrom, Erythema multiforme
- Rhabdomyolyse, erhöhte Kreatinphosphokinase im Blut (besonders bei japanischen Patienten).
Das Unbedenklichkeitsprofil von Levetiracetam ist im Allgemeinen in den verschiedenen Altersgruppen (Erwachsene sowie Kinder und Jugendliche) und unterschiedlichen zugelassenen Epilepsieindikationen ähnlich. Nebenwirkungen, die das Verhalten und die Psyche betreffen, traten jedoch bei Kindern häufiger auf als bei Erwachsenen.
Wechselwirkungen
Sowohl bei Erwachsenen als auch bei Kindern scheint es keine therapierelevanten Wechselwirkungen zwischen Levetiracetam und anderen vorhandenen Antiepileptika (Phenytoin, Carbamazepin, Valproinsäure, Phenobarbital, Lamotrigin, Gabapentin und Primidon) zu geben.
Probenecid hemmt die renale Clearance des primären Metaboliten, jedoch nicht die von Levetiracetam.
Bei gleichzeitiger Anwendung mit Methotrexat verringert sich die Methotrexat-Clearance. Dadurch erhöhte Methotrexatspiegel im Blut können toxische Konzentrationen erreichen. Bei Patienten mit gleichzeitiger Anwendung dieser Wirkstoffe, sollte deren Serumkonzentration sorgfältig überwacht werden.
Bei gleichzeitiger Anwendung von Levetiracetam mit Digoxin, oralen Kontrazeptiva oder Warfarin wurden keine pharmakokinetisch relevanten Interaktionen beobachtet.
Die Wirksamkeit von oral angewendetem Levetiracetam kann durch gleichzeitige Einnahme des osmotisch wirksamen Abführmittels Macrogol verringert werden. Macrogol sollte daher eine Stunde vor und eine Stunde nach der Einnahme von Levetiracetam nicht eingenommen werden.
Kontraindikation
Überempfindlichkeit gegenüber dem Wirkstoff, anderen Pyrrolidon-Derivaten oder anderen Bestandteilen der jeweiligen Arzneizubereitung.
Schwangerschaft/Stillzeit
Schwangerschaft
Bisher erhobene Daten weisen nicht auf ein wesentlich erhöhtes Risiko für erhebliche angeborene Missbildungen hin. Ein teratogenes Risiko kann jedoch nicht vollständig ausgeschlossen werden. Ist einen Behandlung während der Schwangerschaft notwendig, sollte die Monotherapie in Betracht gezogen werden, da Anwendung mehrerer Antiepileptika mit einem höheren Risiko für angeborene Missbildungen verbunden ist. Der Abbruch einer antiepileptischen Behandlung kann zu einer Verschlimmerung der Erkrankung führen, was gesundheitsgefährdende Auswirkungen auf die Mutter und den Fötus haben kann.
Physiologische Veränderungen während der Schwangerschaft können zu einer Abnahme der Levetiracetam-Plasma-Konzentration führen. Diese ist besonders deutlich ausgeprägt im dritten Trimenon (bis zu 60% der Anfangskonzentration vor Schwangerschaftsbeginn). Die klinische Betreuung von Schwangeren, die mit Levetiracetam behandelt werden, sollte sichergestellt sein.
Stillzeit
Das Stillen wird nicht empfohlen, da Levetiracetam in die Muttermilch ausgeschieden wird. Sollte jedoch eine Behandlung mit Levetiracetam während der Stillzeit erforderlich sein, müssen Nutzen und Risiko einer Behandlung gegeneinander abgewogen werden.
In tierexperimentellen Studien konnte kein Einfluss auf die Fertilität festgestellt werden. Das potentielle Risiko für den Menschen ist nicht bekannt.
Verkehrstüchtigkeit
Levetiracetam hat kann geringe bis mäßige Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen haben. Insbesondere zu Behandlungsbeginn oder nach Dosissteigerung können Somnolenz oder andere zentralnervöse Störungen auftreten. Beim Führen von Fahrzeugen und beim Bedienen von Maschinen ist daher Vorsicht geboten.
Weitere Details zu diesem Wirkstoff können Sie der Fachinformation entnehmen.
Wirkstoff-Informationen
- EMA: Fachinformation Keppra
- Freissmuth et al., Pharmakologie und Toxikologie, 2020, Springer
- Mutschler et al., Mutschler Arzneimittelwirkungen, 2019, Wissenschaftliche Verlagsgesellschaft Stuttgart
- AWMF: Leitlinie Erster epileptischer Anfall und Epilepsien im Erwachsenenalter (2017)
- Feyissa AM. Brivaracetam in the treatment of epilepsy: a review of clinical trial data. Neuropsychiatr Dis Treat. 2019 Sep 9;15:2587-2600. doi: 10.2147/NDT.S143548.
-
Levetiracetam Accord 250 mg Filmtabletten
Accord Healthcare GmbH
-
Levetiracetam Accord 500 mg BB Farma Filmtabletten
BB Farma S.R.L.
-
Levetiracetam Accord 500 mg Eurim Filmtabletten
Eurim-Pharm Arzneimittel GmbH
-
Levetiracetam Accord 500 mg Filmtabletten
Accord Healthcare GmbH
-
Levetiracetam Accord 750 mg Filmtabletten
Accord Healthcare GmbH
-
Levetiracetam Accord 1000 mg 101 Carefarm Filmtabletten
1 0 1 Carefarm GmbH
-
Levetiracetam Accord 1000 mg Abacus Filmtabletten
Abacus Medicine A/S
-
Levetiracetam Accord 1000 mg BB Farma Filmtabletten
BB Farma S.R.L.
-
Levetiracetam Accord 1000 mg Filmtabletten
Accord Healthcare GmbH
-
Levetiracetam Actavis Group 100 mg/ml BB Farma Lösung zum Einnehmen
BB Farma S.R.L.
-
Levetiracetam AL 100 mg/ml BB Farma Lösung zum Einnehmen
BB Farma S.R.L.
-
Levetiracetam AL 100 mg/ml Lösung zum Einnehmen
ALIUD PHARMA® GmbH
-
Levetiracetam AL 250 mg Filmtabletten
ALIUD PHARMA® GmbH
-
Levetiracetam AL 500 mg Filmtabletten
ALIUD PHARMA® GmbH
-
Levetiracetam AL 750 mg Filmtabletten
ALIUD PHARMA® GmbH
-
Levetiracetam AL 1000 mg Filmtabletten
ALIUD PHARMA® GmbH
-
Levetiracetam Altan 100 mg/ml Konzentrat zur Herstellung einer Infusionslösung, 5ml
Ethypharm GmbH
-
Levetiracetam Amarox 100 mg/ml Konzentrat zur Herstellung einer Infusionslösung
Amarox Pharma GmbH
-
Levetiracetam Amarox 100 mg/ml Lösung zum Einnehmen
Amarox Pharma GmbH
-
Levetiracetam Amarox 250 mg Filmtabletten
Amarox Pharma GmbH
-
Levetiracetam Amarox 500 mg Filmtabletten
Amarox Pharma GmbH
-
Levetiracetam Amarox 750 mg Filmtabletten
Amarox Pharma GmbH
-
Levetiracetam Amarox 1000 mg Filmtabletten
Amarox Pharma GmbH
-
Levetiracetam AMETAS 100 mg/ml Lösung zum Einnehmen
Ametas Medical GmbH
-
Levetiracetam AMETAS 250 mg Filmtabletten
Ametas Medical GmbH
-
Levetiracetam AMETAS 500 mg Filmtabletten
Ametas Medical GmbH
-
Levetiracetam AMETAS 750 mg Filmtabletten
Ametas Medical GmbH
-
Levetiracetam AMETAS 1000 mg Filmtabletten
Ametas Medical GmbH
-
Levetiracetam Aristo 100 mg/ml Lösung zum Einnehmen
Aristo Pharma GmbH
-
Levetiracetam Aristo 250 mg Filmtabletten
Aristo Pharma GmbH
-
Levetiracetam Aristo 500 mg Filmtabletten
Aristo Pharma GmbH
-
Levetiracetam Aristo 750 mg Filmtabletten
Aristo Pharma GmbH
-
Levetiracetam Aristo 1000 mg Filmtabletten
Aristo Pharma GmbH
-
Levetiracetam Aurobindo 100 mg BB Farma Lösung zum Einnehmen
BB Farma S.R.L.
-
Levetiracetam Aurobindo 100 mg/ml CC Pharma Lösung zum Einnehmen
CC Pharma GmbH
-
Levetiracetam Aurobindo 100 mg/ml Lösung zum Einnehmen
PUREN Pharma GmbH & Co. KG
-
Levetiracetam Aurobindo 100mg/ml Eurim Lösung zum Einnehmen
Eurim-Pharm Arzneimittel GmbH
-
Levetiracetam Aurobindo 250 mg Filmtabletten
PUREN Pharma GmbH & Co. KG
-
Levetiracetam Aurobindo 500 mg BB Farma Filmtabletten
BB Farma S.R.L.
-
Levetiracetam Aurobindo 500 mg Filmtabletten
PUREN Pharma GmbH & Co. KG
-
Levetiracetam Aurobindo 750 mg Filmtabletten
PUREN Pharma GmbH & Co. KG
-
Levetiracetam Aurobindo 1000 mg 101 Carefarm Filmtabletten
1 0 1 Carefarm GmbH
-
Levetiracetam Aurobindo 1000 mg BB Farma Filmtabletten
BB Farma S.R.L.
-
Levetiracetam Aurobindo 1000 mg CC Pharma Filmtabletten
CC Pharma GmbH
-
Levetiracetam Aurobindo 1000 mg Filmtabletten
PUREN Pharma GmbH & Co. KG
-
Levetiracetam axcount 250 mg Filmtabletten
axcount Generika AG
-
Levetiracetam axcount 500 mg Filmtabletten
axcount Generika AG
-
Levetiracetam axcount 750 mg Filmtabletten
axcount Generika AG
-
Levetiracetam axcount 1000 mg Filmtabletten
axcount Generika AG
-
LEVETIRACETAM BASICS 100 mg/ml Lösung zum Einnehmen
Basics GmbH














