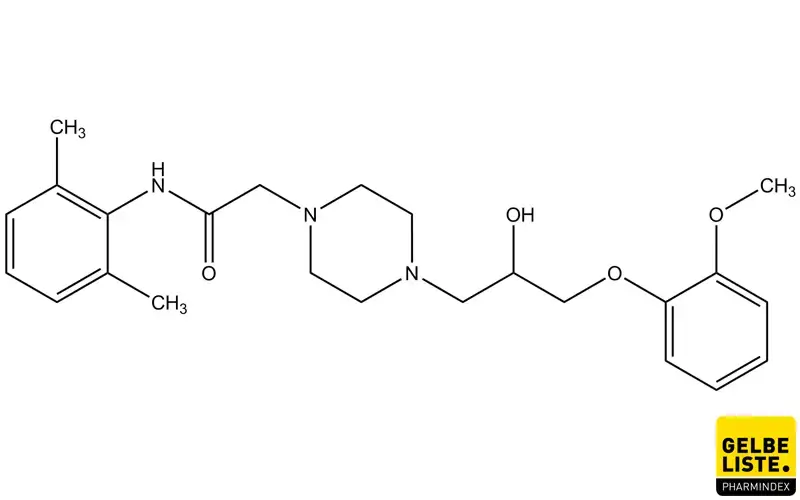
Ranolazin
Ranolazin wirkt inhibierend auf den späten Natriumeinstrom in kardialen Zellen und ist indiziert als Ergänzungstherapie zur symptomatischen Behandlung der stabilen Angina pectoris.
Ranolazin: Übersicht
Anwendung
Die antianginöse Therapie mit Ranolazin ist indiziert als Ergänzungstherapie zur symptomatischen Behandlung erwachsener Patienten mit stabiler Angina pectoris, die unzureichend eingestellt sind oder antianginöse Mittel der ersten Wahl (wie Betablocker und/oder Calciumkanalantagonisten) nicht tolerieren.
Anwendungsart
Ranolazin ist in Form von Retardtabletten (375 mg, 500 mg, 750 mg) erhältlich. Die Einnahme kann nahrungsunabhängig und sollte im Ganzen (nicht zerkleinert, zerbrochen oder zerkaut) erfolgen.
Wirkmechanismus
Der exakte antianginöse Wirkmechanismus von Ranolazin ist noch nicht vollständig erforscht. Die Hemmung des späten Natriumeinstroms in kardiale Zellen bzw. Kardiomyozyten wird als Hauptmechanismus angenommen. Die dadurch verminderte intrazelluläre Natriumakkumulation verringert eine intrazelluläre Calciumüberladung („Calciumoverload“), die durch Na+/Ca2+-Austauscher vermittelt wird. Vor allem unter ischämischen Bedingungen scheint dieses Ionenungleichgewicht durch Ranolazin reduziert zu werden.
Durch eine verminderte intrazelluläre Calciumüberladung kann die myokardiale Relaxation erleichtert und infolgedessen die diastolische linksventrikuläre Steifigkeit verringert werden.
Eine Open-Label-Studie an fünf Patienten mit QT-Verlängerungssyndrom (dabei LQT3 mit der Genmutation SCN5A ∆KPQ) zeigte eine erhebliche Verkürzung des korrigierten QT-Intervalls und eine Verbesserung der diastolischen Relaxation und lieferte damit einen klinischen Beweis für die Hemmung des späten Natriumstroms durch Ranolazin.
Pharmakokinetik
Resorption
- Nach oraler Einnahme werden Plasma-Spitzenkonzentrationen (cmax) üblicherweise nach 2-6 Stunden erreicht.
- Die durchschnittliche absolute Bioverfügbarkeit von Ranolazin nach oraler Einnahme von Tabletten mit sofortiger Wirkstofffreisetzung liegt im Bereich von 35-50% (große interindividuelle Variabilität).
- Die Ranolazin-Exposition steigt stärker als proportional zur Dosis.
Verteilung
- Ranolazin wird zu etwa 62% an Plasmaproteine gebunden (hauptsächlich an saures Alpha-1-Glykoprotein und nur schwach an Albumin).
- Das durchschnittliche Verteilungsvolumen im Steady State (Vss) beträgt etwa 180L.
Metabolismus
- Ranolazin wird schnell und umfassend metabolisiert (47 Metaboliten im Plasma, > 100 Metaboliten im Harn und 25 Metaboliten im Fäzes).
- Die O-Demethylierung und die N-Dealkylierung sind die wichtigsten primären Metabolisierungswege (von 14 identifizierten Metabolisierungswegen).
- Ranolazin wird hauptsächlich durch CYP3A4 aber auch durch CYP2D6 verstoffwechselt (CAVE: CYP2D6-Polymorphismus, denn „poor metabolisers“ zeigen eine höhere AUC als „extensive metabolisers“).
Elimination
- Ranolazin wird hauptsächlich durch Metabolisierung und zu ≤ 5% unverändert über den Harn oder die Fäzes eliminiert (etwa 3/4 renal und 1/4 über die Fäzes).
Patientenindividuelle Pharmakokinetik
- Alter: Eine altersbedingte verminderte Nierenfunktion kann die Ranolazin-Exposition bei älteren Patienten erhöhen.
- Gewicht: Probanden mit einem Gewicht von 40 kg zeigen eine etwa 1,4-fach höhere Ranolazin-Exposition im Vergleich zu Probanden mit einem Gewicht von 70 kg.
- Herzinsuffizienz: Die Plasmakonzentration bei Patienten mit mäßiger bis schwerer Herzinsuffizienz (NYHA-Klassen III-IV) ist etwa 1,3-fach erhöht.
- Nierenfunktion: In einer populationspharmakokinetischen Analyse wurde geschätzt, dass bei Probanden mit mäßig starker Funktionsstörung (Kreatinin-Clearance 40 mL/min) die Ranolazin-Exposition etwa auf das 1,2-Fache steigt, wobei bei Probanden mit schwerer Nierenfunktionsstörung (Kreatinin-Clearance 10-30 mL/min) eine 1,3- bis 1,8-Fache Zunahme der Ranolazin-Exposition geschätzt wurde.
- Leberfunktion: Bei Patienten mit leichten Leberfunktionsstörungen war die Ranolazin-AUC unbeeinflusst, sie erhöhte sich jedoch um das 1,8-Fache bei Patienten mit mäßig starken Funktionsstörungen (die Verlängerung des QT-Intervalls war bei diesen Patienten stärker ausgeprägt).
Dosierung
Die Dosierung orientiert sich an patientenindividuellen Faktoren wie Verträglichkeit, Begleitmedikation oder Grunderkrankungen.
Erwachsene:
- Anfangsdosis: 2x täglich 375 mg Ranolazin
- Dosistitration: Nach 2-4 Wochen sollte die Dosis auf 2x täglich 500 mg Ranolazin und je nach Ansprechen des Patienten auf eine empfohlene Maximaldosis von 2x täglich 750 mg Ranolazin titriert werden.
- Unverträglichkeit: Eine Abwärtstitration auf 2x täglich 500 mg oder 375 mg Ranolazin kann beim Auftreten von unerwünschten Arzneimittelwirkungen erforderlich sein (Therapieabbruch bei fehlendem Abklingen der Symptome).
Begleitmedikation mit CYP3A4- und P-gp-Inhibitoren:
- Eine sorgfältige Dosistitration bei Behandlung mit mittelstarken CYP3A4-Inhibitoren (z.B. Diltiazem, Fluconazol, Erythromycin) oder P-gp-Inhibitoren (z.B. Verapamil, Ciclosporin) wird empfohlen.
- Eine Begleitmedikation mit starken CYP3A4-Inhibitoren ist kontraindiziert.
Nierenfunktionsstörung:
- Eine sorgfältige Dosistitration bei Patienten mit leichter bis mäßiger Nierenfunktionsstörung (Kreatinin-Clearance 30-80 mL/min) wird empfohlen.
- Bei Patienten mit schwerer Nierenfunktionsstörung (Kreatinin-Clearance < 30 mL/min) ist Ranolazin kontraindiziert.
Leberfunktionsstörung:
- Eine sorgfältige Dosistitration bei Patienten mit leichter Leberfunktionsstörung wird empfohlen.
- Bei Patienten mit mäßiger oder schwerer Leberfunktionsstörung ist Ranolazin kontraindiziert.
Ältere Patienten:
- Bei älteren Patienten sollte die Dosistitration mit besonderer Vorsicht erfolgen.
- Eine altersbedingte verminderte Nierenfunktion kann die Ranolazin-Exposition erhöhen.
- Bei älteren Patienten traten häufiger Nebenwirkungen auf.
Gewicht:
- Bei Patienten mit geringem Gewicht (≤ 60 kg) sollte die Dosistitration mit besonderer Vorsicht erfolgen (häufiger Nebenwirkungen).
Kongestive Herzinsuffizienz (CHF):
- Bei Patienten mit mäßiger bis schwerer Herzinsuffizienz (NYHA-Klassen III-IV) sollte die Dosistitration mit besonderer Vorsicht erfolgen.
Nebenwirkungen
Unter der Therapie mit Ranolazin entwickeln sich potenzielle Nebenwirkungen häufig innerhalb der ersten zwei Behandlungswochen. Diese fallen im Allgemeinen leicht bis mäßig stark aus. Zu den häufigen Nebenwirkungen zählen:
- Kopfschmerzen und Schwindel
- Obstipation
- Übelkeit und Erbrechen
- Asthenie (Schwäche)
Üblicherweise treten durch Ranolazin bedingte Nebenwirkungen häufiger bei älteren Patienten sowie bei Patienten mit Nierenfunktionsstörung auf.
Wechselwirkungen
Ranolazin ist ein mittelstarker bis starker P-gp-Inhibitor und ein schwacher CYP3A4-Inhibitor, weshalb der Wirkstoff die Plasmakonzentration von P-gp- oder CYP3A4-Substraten erhöhen kann. Zusätzlich ist Ranolazin Substrat von CYP3A4 und CYP2D6 sowie P-gp.
Die gleichzeitige Einnahme von Ranolazin mit Substraten oder Inhibitoren bzw. Induktoren von CYP3A4, CYP2D6 oder P-gp sollte demnach mit Vorsicht erfolgen oder vermieden werden (siehe Kontraindikationen).
Kontraindikationen
Ranolazin ist kontraindiziert bei:
- Überempfindlichkeit gegen den Wirkstoff oder sonstige Bestandteile des Arzneimittels
- Schwerer Nierenfunktionsstörung (Kreatinin-Clearance < 30 mL/min)
- Mäßige oder schwere Leberfunktionsstörung
- Begleitmedikation mit starken CYP3A4-Inhibitoren wie Ketoconazol, HIV-Proteaseinhibitoren und Clarithromycin
- Begleitmedikation mit Antiarrhythmika der Klasse Ia (z.B. Chinidin) oder Klasse III (z.B. Dofetilid oder Sotalol) mit Ausnahme von Amiodaron
Schwangerschaft
Der Einsatz von Ranolazin in der Schwangerschaft wird nicht empfohlen, da über die Sicherheit einer Anwendung beim Menschen nur sehr begrenzte Erfahrungen vorliegen. Tierexperimentelle Studien haben eine Embryotoxizität gezeigt. Das potenzielle Risiko für den Menschen ist nicht bekannt, weshalb Ranolazin nicht während der Schwangerschaft verwendet werden darf, es sei denn, dies ist zwingend erforderlich.
Stillzeit
Es ist nicht bekannt, ob Ranolazin in die Muttermilch übergeht. Tierexperimentelle Studien bei Ratten haben gezeigt, dass Ranolazin in die Muttermilch übergeht. Ein Risiko für das gestillte Kind kann nicht ausgeschlossen werden, weshalb Ranolazin nicht während der Stillzeit angewendet werden darf.
Verkehrstüchtigkeit
Ranolazin kann unter anderem Schwindel, verschwommenes Sehen, Doppeltsehen und Verwirrtheitszustände verursachen, was die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen beeinträchtigen kann.
Anwendungshinweise
Patienten mit zu erwartender Expositionserhöhung
Ranolazin muss mit Vorsicht angewendet werden bei:
- Begleitmedikation mit mittelstarken CYP3A4-Inhibitoren
- Begleitmedikation mit P-gp-Inhibitoren
- Leichter Leberfunktionsstörung
- Leichter bis mäßiger Nierenfunktionsstörung (Kreatinin-Clearance 30-80 mL/min)
- Älteren Patienten
- Patienten mit geringem Gewicht (≤ 60 kg)
- Patienten mit mäßiger bis schwerer Herzinsuffizienz (NYHA-Klassen III-IV)
QT-Zeit-Verlängerung
- Ranolazin hemmt hERG-Kaliumkanäle und verlängert das QTc-Intervall dosisabhängig.
- Eine populationsbasierte Analyse kombinierter Daten von Patienten und gesunden Probanden hat gezeigt, dass die Steigung im Verhältnis von Plasmakonzentration zu korrigierter QT-Zeit (QTc-Zeit) auf 2,4 msec je 1000 ng/mL geschätzt wurde, was über den Plasmakonzentrationsbereich für Ranolazin 500 bis 1000 mg 2x täglich etwa einer Zunahme von 2-7 msec entspricht (daher ist bei der
Behandlung von Patienten mit kongenitalem oder in der Familie aufgetretenem QT-Verlängerungssyndrom, bei Patienten mit bekanntermaßen erworbener Verlängerung des QT-Intervalls sowie bei Patienten, die mit einem Arzneimittel behandelt werden, das das QTc-Intervall beeinflusst, Vorsicht geboten).
Alternativen
Zur Prophylaxe und Langzeitbehandlung der Angina pectoris stehen neben der nicht-medikamentösen Therapie diese alternativen Wirkstoffe zur Verfügung:
- NO-Donatoren wie Glyceroltrinitrat und Isosorbiddinitrat (Nitrate) oder Molsidomin
- ß-Blocker wie Bisoprolol und Metoprolol
- Calciumkanalblocker wie Amlodipin und Nifedipin (retardiert)
- Ivabradin
Dabei sollte sich die antianginöse Therapie an den patientenindividuellen Komorbiditäten sowie den möglichen unerwünschten Nebenwirkungen orientieren.
Patienten mit stabiler Angina pectoris sollen darüber hinaus über ein schnellwirksames Nitrat zur Anfallskupierung verfügen.
Weitere Informationen sind der jeweiligen Fachinformation zu entnehmen.
Wirkstoff-Informationen
- EMA: Ranexa
- Freissmuth et al., Pharmakologie und Toxikologie, 2020, Springer
- Mutschler et al., Mutschler Arzneimittelwirkungen, 2019, Wissenschaftliche Verlagsgesellschaft Stuttgart
- Langfassung Nationale VersorgungsLeitlinie Chronische KHK (Stand: 2019)
-
Ranexa 375 mg 2care4 Retardtabletten
2care4 ApS
-
Ranexa 375 mg Abacus Retardtabletten
Abacus Medicine A/S
-
Ranexa 375 mg ACA Retardtabletten
A.C.A. Müller ADAG Pharma AG
-
Ranexa 375 mg axicorp Retardtabletten
axicorp Pharma GmbH
-
Ranexa 375 mg B2B Medical Retardtabletten
B2B Medical GmbH
-
Ranexa 375 mg BB Farma Retardtabletten
BB Farma S.R.L.
-
Ranexa 375 mg CC Pharma Retardtabletten
CC Pharma GmbH
-
Ranexa 375 mg Eurim Retardtabletten
Eurim-Pharm Arzneimittel GmbH
-
Ranexa 375 mg FD Pharma Retardtabletten
FD Pharma GmbH
-
Ranexa 375 mg kohlpharma Retardtabletten
kohlpharma GmbH
-
Ranexa 375 mg Medicopharm Retardtabletten
Medicopharm AG
-
Ranexa 375 mg Orifarm Retardtabletten
Orifarm GmbH
-
Ranexa 375 mg Originalis Retardtabletten
Originalis B.V.
-
Ranexa 375 mg Paranova Retardtabletten
Paranova Pack A/S
-
Ranexa® 375 mg Retardtabletten
Berlin-Chemie AG
-
Ranexa 500 2care4 mg Retardtabletten
2care4 ApS
-
Ranexa 500 mg Abacus Retardtabletten
Abacus Medicine A/S
-
Ranexa 500 mg ACA Retardtabletten
A.C.A. Müller ADAG Pharma AG
-
Ranexa 500 mg axicorp Retardtabletten
axicorp Pharma GmbH
-
Ranexa 500 mg B2B Medical Retardtabletten
B2B Medical GmbH
-
Ranexa 500 mg BB Farma Retardtabletten
BB Farma S.R.L.
-
Ranexa 500 mg CC Pharma Retardtabletten
CC Pharma GmbH
-
Ranexa 500 mg Eurim Retardtabletten
Eurim-Pharm Arzneimittel GmbH
-
Ranexa 500 mg FD Pharma Retardtabletten
FD Pharma GmbH
-
Ranexa 500 mg kohlpharma Retardtabletten
kohlpharma GmbH
-
Ranexa 500 mg Medicopharm Retardtabletten
Medicopharm AG
-
Ranexa 500 mg Orifarm Retardtabletten
Orifarm GmbH
-
Ranexa 500 mg Originalis Retardtabletten
Originalis B.V.
-
Ranexa 500 mg Paranova Retardtabletten
Paranova Pack A/S
-
Ranexa® 500 mg Retardtabletten
Berlin-Chemie AG
-
Ranexa 750 mg 2care4 Retardtabletten
2care4 ApS
-
Ranexa 750 mg Abacus Retardtabletten
Abacus Medicine A/S
-
Ranexa 750 mg ACA Retardtabletten
A.C.A. Müller ADAG Pharma AG
-
Ranexa 750 mg axicorp Retardtabletten
axicorp Pharma GmbH
-
Ranexa 750 mg B2B Medical Retardtabletten
B2B Medical GmbH
-
Ranexa 750 mg BB Farma Retardtabletten
BB Farma S.R.L.
-
Ranexa 750 mg CC Pharma Retardtabletten
CC Pharma GmbH
-
Ranexa 750 mg Eurim Retardtabletten
Eurim-Pharm Arzneimittel GmbH
-
Ranexa 750 mg FD Pharma Retardtabletten
FD Pharma GmbH
-
Ranexa 750 mg kohlpharma Retardtabletten
kohlpharma GmbH
-
Ranexa 750 mg Medicopharm Retardtabletten
Medicopharm AG
-
Ranexa 750 mg Orifarm Retardtabletten
Orifarm GmbH
-
Ranexa 750 mg Originalis Retardtabletten
Originalis B.V.
-
Ranexa 750 mg Paranova Retardtabletten
Paranova Pack A/S
-
Ranexa® 750 mg Retardtabletten
Berlin-Chemie AG
-
Ranolazin - 1 A Pharma® 375 mg Retardtabletten
1 A Pharma GmbH
-
Ranolazin - 1 A Pharma® 500 mg Retardtabletten
1 A Pharma GmbH
-
Ranolazin - 1 A Pharma® 750 mg Retardtabletten
1 A Pharma GmbH
-
Ranolazin 123-Acurae Pharma 375 mg Retardtabletten
123 Acurae Pharma GmbH
-
Ranolazin 123-Acurae Pharma 500 mg Retardtabletten
123 Acurae Pharma GmbH












