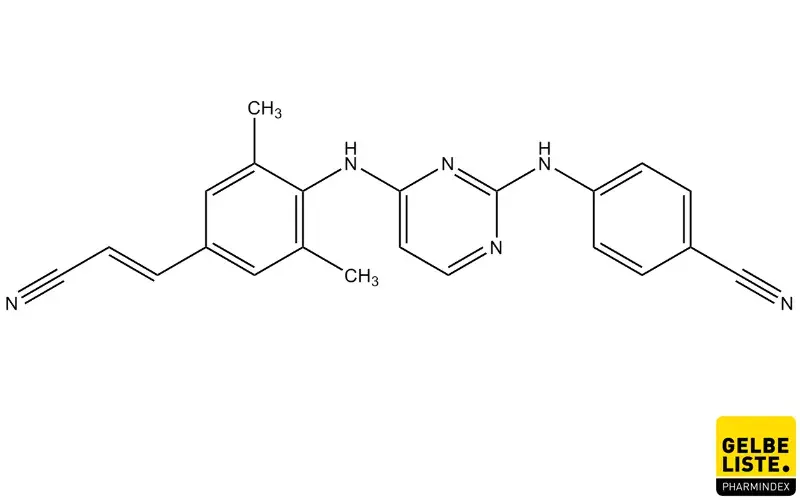
Rilpivirin
Rilpivirin ist ein antiretroviral wirksamer Arzneistoff aus der Gruppe der nicht-nukleosidischen Reverse-Transkriptase-Hemmer (NNRTI) der 2. Generation. Der Wirkstoff wird zur Behandlung von Infektionen mit dem Virus vom Typ HIV-1 in Kombination mit anderen Wirkstoffen angewendet, um die Viruslast zu senken.
Rilpivirin : Übersicht
Anwendung
Rilpivirin wird mit anderen antiretroviralen Arzneimitteln zur Behandlung von Infektionen mit dem humanen Immundefizienz-Virus vom Typ HIV-1 bei Erwachsenen, Jugendlichen und Kindern ab einem Alter von 12 Jahren eingesetzt. Die Behandlung beschränkt sich auf antiretroviral nicht vorbehandelte Patienten mit einer Viruslast von ≤ 100.000 HIV-1-RNA-Kopien/ml.
Im Mai 2018 wurde Rilpivirin in einer Fixkombination mit Dolutegravir als Single-Tablet-Regime europaweit als erstes duales HIV-Arzneimittel (2DR) zur Behandlung erwachsener, virologisch supprimierter Patienten (HIV-1 RNA <50 Kopien/ml) zugelassen.
Rilpivirin wird häufig in Kombination mit anderen antiretroviral wirksamen Arzneimitteln wie Rifabutin, Lamivudin, Abacavir, Efavirenz, Tenofovir und Emtricitabin angewendet.
Wirkmechanismus
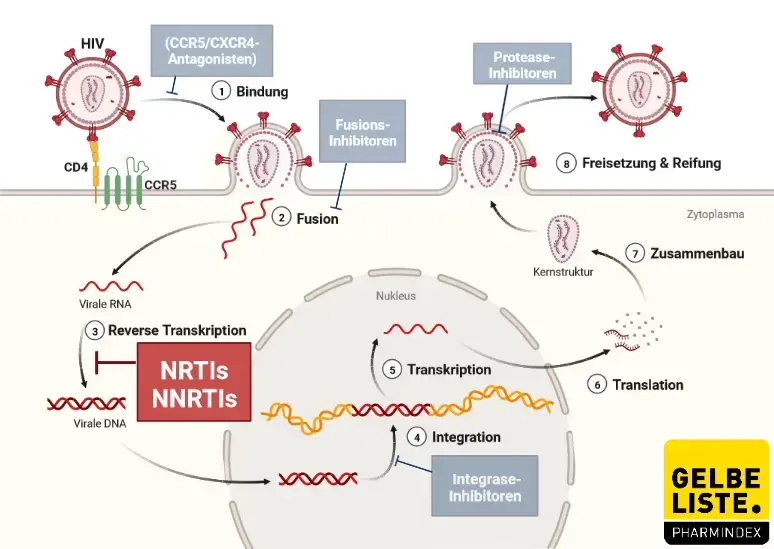
Rilpivirin gehört zur pharmakotherapeutischen Gruppe der nicht-nukleosidischen Reverse-Transkriptase-Hemmer (NNRTI) der 2. Generation. Der Wirkstoff hemmt nicht-kompetitiv die HIV-1-Reverse-Transkriptase. Damit wird das Umschreiben von viraler RNA in menschliche DNA verhindert. So können HI-Viren humane Wirtszellen nicht mehr missbrauchen um neue HI-Viren zu produzieren.
Als NNRTI der 2. Generation hat Rilpivirin ein breiteres Wirkspektrum als seine Vorgänger - wirkt aber auch nicht gegen alle Varianten der HI-Viren. Bislang konnte eine Wirksamkeit gegen Laborstämme vom HIV-1-Wildtyp bei akut infizierten T-Zell-Linien mit einem medianen EC50-Wert für HIV-1/IIIB von 0,73 nM (0,27 ng/ml) gezeigt werden. In vitro erwies sich Rilpivirin auch ein begrenzt wirksam gegen HIV-2 mit EC50-Werten im Bereich von 2.510 bis 10.830 nM (920 bis 3.970 ng/ml). Aufgrund fehlender klinischer Daten wird der Wirkstoff dennoch nicht zur Behandlung einer HIV-2-Infektion empfohlen.
Darüber hinaus erwies sich Rilpivirin in vitro antiviral wirksam gegen ein breites Spektrum von primären Isolaten der HIV-1-Gruppe M (Subtypen A, B, C, D, F, G, H) mit EC50-Werten im Bereich von 0,07 bis 1,01 nM (0,03 bis 0,37 ng/ml) und Gruppe O mit EC50-Werten im Bereich von 2,88 bis 8,45 nM (1,06 bis 3,10 ng/ml).
Anhand der verfügbaren in-vitro- und in-vivo-Daten von nicht vorbehandelten Patienten, können die folgenden Resistenz-assoziierten Mutationen - wenn sie bei Therapiebeginn vorliegen - die Wirksamkeit von Rilpivirin beeinflussen: K101E, K101P, E138A, E138G, E138K, E138R, E138Q, V179L, Y181C, Y181I, Y181V, Y188L, H221Y, F227C, M230I und M230L. Diese Rilpivirinresistenz-assoziierten Mutationen gelten aber nur als richtungsweisend. Über die Wirksamkeit von Rilpivirin bei Patienten mit solchen Mutationen, bei denen eine antiretrovirale Therapie versagt hat, kann keine sichere Aussage getroffen werden. Wie auch bei anderen antiretroviralen Arzneimitteln, ist die Anwendung von Rilpivirin mit den Ergebnissen eines Resistenztests abzustimmen.
Pharmakokinetik
Die pharmakokinetischen Eigenschaften von Rilpivirin wurden an gesunden erwachsenen Probanden sowie an antiretroviral nicht vorbehandelten HIV-1-infizierten Patienten ab 12 Jahren untersucht. Die Verfügbarkeit von Rilpivirin war bei den HIV-1-infizierten Patienten im Allgemeinen niedriger als bei den gesunden Studienteilnehmern.
Im Schnitt wird die maximale Plasmakonzentration von Rilpivirin nach oraler Gabe innerhalb von 4 bis 5 Stunden erreicht. Über die absolute Bioverfügbarbeit gibt es keine Angaben.
Für eine optimale Resorption muss Rilpivirin zusammen mit einer Mahlzeit eingenommen werden. Wird Rilpivirin im Nüchternzustand eingenommen, kann dessen Verfügbarkeit im Vergleich zur Einnahme mit einer Mahlzeit mit normalem Kaloriengehalt (533 kcal) oder einer fetthaltigen, kalorienreichen Mahlzeit (928 kcal) um rund 40 Prozent niedriger sein. Das zeigen bisherige Daten. Des Weiteren wurde eine 50 Prozent niedrigere Verfügbarkeit beobachtet, wenn Rilpivirin nur mit einem proteinreichen, nahrhaften Getränk eingenommen wurde – verglichen mit der Einnahme mit einer Mahlzeit. Die Einnahme von Rilpivirin im Nüchternzustand oder nur mit einem nahrhaften Getränk kann verminderte Plasmakonzentrationen von Rilpivirin zur Folge haben. Das ist mit einer potentiell verminderten therapeutischen Wirkung assoziiert.
Rilpivirin wird in vitro zu etwa 99,7 Prozent an Plasmaproteine gebunden, vornehmlich an Albumin. Über die Verteilung von Rilpivirin in andere Kompartimente als Plasma (z. B. zerebrospinale Flüssigkeit oder Genitaltraktsekretionen) gibt es beim Menschen bislang keine Untersuchungen.
In-vitro-Experimente weisen darauf hin, dass Rilpivirin hauptsächlich durch das Cytochrom-P450 (CYP) 3A-System metabolisiert wird.
Die terminale Eliminationshalbwertzeit von Rilpivirin beträgt etwa 45 Stunden. Nach Gabe einer oralen Einzeldosis von 14C-Rilpivirin konnten durchschnittlich 85 Prozent der Radioaktivität im Stuhl und 6,1 Prozent im Urin gefunden werden. Im Stuhl lag der Anteil des unveränderten Rilpivirin bei durchschnittlich 25 Prozent der verabreichten Dosis, im Urin konnten nur Spuren von unverändertem Rilpivirin (< 1 Prozent der Dosis) festgestellt werden.
Nebenwirkungen
Sehr häufig:
- Schlaflosigkeit
- erhöhtes Gesamtcholesterin (nüchtern), erhöhtes LDL-Cholesterin (nüchtern)
- Kopfschmerzen, Schwindel
- Übelkeit
- erhöhte Pankreasamylase
- erhöhte Transaminasen.
Häufig:
- verminderte Zahl der weißen Blutkörperchen, vermindertes Hämoglobin
- verminderte Thrombozytenzahl
- erhöhte Triglyceride (nüchtern)
- erhöhte Lipase
- Schlafstörungen, abnorme Träume
- Depressionen, depressive Verstimmung
- Somnolenz
- verminderter Appetit, Bauchschmerzen, Erbrechen, abdominelle Beschwerden
- Mundtrockenheit
- erhöhtes Bilirubin
- Hautausschlag
- Erschöpfung (Fatigue).
Gelegentlich:
- Immun-Rekonstitutions-Syndrom.
Wechselwirkungen
Arzneimittel, deren Wirkung durch die Anwendung von Rilpivirin beeinträchtigt wird
Bei einer Rilpivirin-Dosis von 25 mg pro Tag sind klinisch relevante Auswirkungen auf die Exposition von Arzneimitteln, die durch CYP-Enzyme metabolisiert werden, unwahrscheinlich.
Arzneimittel, welche die Aufnahme von Rilpivirin beeinträchtigen
Rilpivirin wird hauptsächlich durch Cytochrom P450 (CYP)3A metabolisiert. Daher können Arzneimittel, die CYP3A induzieren oder hemmen, die Clearance von Rilpivirin beeinträchtigen. Die gleichzeitige Gabe von Rilpivirin und Arzneimitteln, die CYP3A induzieren, kann zu verringerten Plasmakonzentrationen von Rilpivirin führen und dessen therapeutische Wirkung möglicherweise herabsetzen.
Die gleichzeitige Verabreichung von Rilpivirin und Arzneimitteln, die CYP3A hemmen, kann im Gegensatz dazu zu erhöhten Plasmakonzentrationen von Rilpivirin führen. Die gleichzeitige Verabreichung von Rilpivirin und Arzneimitteln, die den pH-Wert des Magens erhöhen, kann zu verringerten Plasmakonzentrationen von Rilpivirin führen. Die therapeutische Wirkung von Rilpivirin kann daher möglicherweise vermindert sein. Anhand von Wechselwirkungsstudien müssen folgende Arzneimittel-Interaktionen beachtet werden:
Komedikation mit HIV nukleosidischen bzw. nukleotidischen Reverse-Transkriptase-Inhibitoren
Didanosin (400 mg einmal täglich): Bei gleichzeitiger Anwendung von Rilpivirin und Didanosin ist keine Dosisanpassung erforderlich. Es ist aber zu beachten, dass Didanosin auf leeren Magen und mindestens zwei Stunden vor oder mindestens vier Stunden nach Rilpivirin (das zusammen mit einer Mahlzeit eingenommen werden sollte) eingenommen werden muss.
Komedikation mit HIV nicht-nukleosidischen Reverse-Transkriptase-Inhibitoren
NNRTI wie Delavirdin, Efavirenz, Etravirin, Nevirapin: Eine gleichzeitige Anwendung von Rilpivirin und NNRTIs wird nicht empfohlen.
Komedikation mit HIV Proteaseinhibitoren (PIs) – mit gleichzeitiger Verabreichung von niedrig dosiertem Ritonavir
Darunavir/Ritonavir (800/100 mg einmal täglich): Die gleichzeitige Anwendung von Rilpivirin und Darunavir/Ritonavir kann zu erhöhten Plasmakonzentrationen von Rilpivirin führen (Hemmung von CYP3A-Enzymen). Eine Dosisanpassung scheint jedoch nicht erforderlich zu sein.
Lopinavir/Ritonavir als Softgelkapsel (400/100 mg zweimal täglich): Die gleichzeitige Anwendung von Rilpivirin und Lopinavir/Ritonavir kann zu erhöhten Plasmakonzentrationen von Rilpivirin führen (Hemmung von CYP3A-Enzymen). Dennoch wird bei gleichzeitiger Anwendung keine Dosisanpassung empfohlen.
Andere geboosterte PIs (Atazanavir/Ritonavir, Fosamprenavir/Ritonavir, Saquinavir/Ritonavir, Tipranavir/Ritonavir): Die gleichzeitige Anwendung von Rilpivirin und verstärkten PIs kann zu erhöhten Plasmakonzentrationen von Rilpivirin führen (Hemmung von CYP3A-Enzymen). Auswirkungen von Rilpivirin auf die Plasmakonzentrationen von gleichzeitig verabreichten PIs sind nicht zu erwarten.
Komedikation mit HIV Proteaseinhibitoren (PIs) – ohne gleichzeitige Verabreichung von niedrig dosiertem Ritonavir.
Nicht geboosterte PIs (Atazanavir, Fosamprenavir, Indinavir, Nelfinavir): Die gleichzeitige Anwendung von Rilpivirin und nicht verstärkten PIs kann zu erhöhten Plasmakonzentrationen von Rilpivirin führen (Hemmung von CYP3A-Enzymen). Auswirkungen von Rilpivirin auf die Plasmakonzentrationen von gleichzeitig verabreichten PIs sind nicht zu erwarten.
Komedikation mit Antikonvulsiva
Carbamazepin, Oxcarbazepin, Phenobarbital, Phenytoin: Rilpivirin sollte nicht in Kombination mit Carbamazepin, Oxcarbazepin, Phenobarbital und/oder Phenytoin angewandt werden. Eine gleichzeitige Anwendung kann die Plasmakonzentration von Rilpivirin signifikant reduzieren (Induktion von CYP3A-Enzymen). Infolge wird die therapeutische Wirkung von Rilpivirin herabgesetzt oder bleibt ganz aus.
Komedikation mit Azol-Antimykotika
Ketoconazol, Fluconazol, Itraconazol, Posaconazol, Voriconazol: Die gleichzeitige Anwendung von Rilpivirin und Azol-Antimykotika kann zu erhöhten Rilpivirin-Plasmakonzentrationen führen (Hemmung von CYP3A-Enzymen). Eine Dosisanpassung scheint jedoch nicht erforderlich zu sein.
Komedikation mit Mitteln gegen Mykobakterien
Rifabutin: Die gleichzeitige Anwendung von Rilpivirin und Rifabutin kann die Plasmakonzentration von Rilpivirin signifikant reduzieren (Induktion von CYP3A-Enzymen). Infolge kann die therapeutische Wirkung von Rilpivirin herabgesetzt sein oder ausbleiben. Während der gleichzeitigen Anwendung von Rilpivirin und Rifabutin sollte die Rilpivirin-Dosis von 25 mg einmal täglich auf 50 mg einmal täglich erhöht werden. Wird die gleichzeitige Anwendung von Rifabutin beendet, ist die Rilpivirin-Dosis wieder auf 25 mg einmal täglich zu reduzieren.
Rifampicin, Rifapentin: Rilpivirin sollte nicht in Kombination mit Rifampicin oder Rifapentin angewandt werden. Bei gleichzeitiger Gabe ist eine signifikante Reduktion der Rilpivirin-Plasmakonzentration zu erwarten (Induktion von CYP3A-Enzymen). Infolge kann die therapeutische Wirkung von Rilpivirin herabgesetzt sein oder ausbleiben.
Komedikation mit Makrolid-Antibiotika
Clarithromycin, Erythromycin: Die gleichzeitige Anwendung von Rilpivirin und Clarithromycin oder Erythromycin kann die Plasmakonzentrationen von Rilpivirin erhöhen (Hemmung von CYP3A-Enzymen). Sofern möglich, sind Alternativen wie Azithromycin zu wählen.
Komedikation mit Glucocortikoiden
Dexamethason (systemisch): Rilpivirin sollte nicht in Kombination mit systemischem Dexamethason angewandt werden (ausgenommen ist eine Einzeldosis). Bei gleichzeitiger Anwendung ist eine signifikante Reduktion der Plasmakonzentration von Rilpivirin wahrscheinlich (Induktion von CYP3A-Enzymen). Infolge kann die therapeutische Wirkung von Rilpivirin herabgesetzt sein oder ausbleiben. Bei der Verordnung sind möglichst Alternativen zu wählen, insbesondere für eine Langzeitbehandlung.
Komedikation mit Protonenpumpenhemmern
Omeprazol, Lansoprazol, Rabeprazol, Pantoprazol, Esomeprazol: Rilpivirin sollte nicht gemeinsam mit Protonenpumpeninhibitoren angewandt werden. Eine gleichzeitige Anwendung ist mit einer signifikanten Reduktion der Plasmakonzentration von Rilpivirin assoziiert (Anstieg des pH-Wertes im Magen). Dadurch kann die therapeutische Wirkung von Rilpivirin herabgesetzt sein oder ausbleiben.
Komedikation mit H2-Rezeptor-Antagonisten
Famotidin, Cimetidin, Nizatidin, Ranitidin: Die gleichzeitige Gabe von Rilpivirin und H2-Rezeptor-Antagonisten sollte mit besonderer Vorsicht erfolgen. Eine kombinierte Anwendung kann die Plasmakonzentration von Rilpivirin signifikant reduzieren (Anstieg des pH-Wertes im Magen). H2-Rezeptor-Antagonisten sollten mindestens 12 Stunden vor oder mindestens 4 Stunden nach Rilpivirin eingenommen werden.
Komedikation mit Antazida
Antazida wie Aluminium- oder Magnesiumhydroxid, Calciumcarbonat: Die gleichzeitige Anwendung von Rilpivirin und Antazida sollte mit Vorsicht erfolgen. Im Fall einer kombinierten Gabe ist mit einer signifikanten Reduktion der Rilpivirin-Plasmakonzentration zu rechnen (Anstieg des pH-Wertes im Magen). Antazida sollten deshalb entweder mindestens 2 Stunden vor oder mindestens 4 Stunden nach Rilpivirin eingenommen werden.
Komedikation mit Narkotika
Methadon: Bei Einleitung einer gleichzeitigen Therapie von Rilpivirin mit Methadon sind keine Dosisanpassungen erforderlich. Dennoch wird eine klinische Überwachung der Patienten empfohlen. Möglicherweise muss die Methadon-Erhaltungstherapie bei einigen Patienten angepasst werden.
Komedikation mit Antikoagulantien
Dabigatranetexilat: Die gleichzeitige Anwendung von Rilpivirin und Dabigatranetexilat sollte nur bei besonderer ärztlicher Überwachung der Patienten erfolgen.
Komedikation mit Phytopharmaka
Johanniskraut (Hypericum perforatum): Rilpivirin sollte nicht in Kombination mit Johanniskraut angewandt werden. Eine gleichzeitige Gabe kann die Plasmakonzentration von Rilpivirin signifikant reduzieren (Induktion von CYP3A-Enzymen). Dadurch kann dessen therapeutische Wirkung herabgesetzt sein oder ausbleiben.
Komedikation mit Arzneimitteln, die das QT-Intervall verlängern
Bislang gibt es nur begrenzte Informationen zur Möglichkeit einer pharmakodynamischen Wechselwirkung zwischen Rilpivirin und Arzneimitteln, die das QTc-Intervall im EKG verlängern. In einer Studie mit gesunden Probanden verlängerten supratherapeutische Dosen von Rilpivirin (75 mg einmal täglich und 300 mg einmal täglich) das QTc-Intervall im EKG. Rilpivirin ist deshalb nur mit besonderer Vorsicht zu verordnen, wenn gleichzeitig Arzneimittel mit bekanntem Risiko für Torsade de Pointes angewendet werden.
Kontraindikationen
Rilpivirin darf nicht bei Überempfindlichkeit gegen den Wirkstoff angewendet werden. Da es aufgrund der CYP3A-Enzyminduktion oder einem erhöhten pH-Wert im Magen zu einer signifikanten Abnahme der Rilpivirin-Konzentration im Plasma mit einem daraus resultierenden Verlust der therapeutischen Wirkung von Rilpivirin kommen kann, darf Rilpivirin nicht gleichzeitig mit folgenden Arzneimitteln angewendet werden:
- den Antikonvulsiva Carbamazepin, Oxcarbazepin, Phenobarbital und Phenytoin
- den Tuberkulostatika Rifampicin und Rifapentin
- Protonenpumpenhemmern wie Omeprazol, Esomeprazol, Lansoprazol, Pantoprazol und Rabeprazol
- dem systemischen Glucocorticoid Dexamethason (außer einer Behandlung mit einer Einzeldosis)
- Johanniskraut (Hypericum perforatum).
Schwangerschaft/Stillzeit
Rilpivirin sollte während der Schwangerschaft nur angewendet werden, wenn der potentielle Nutzen das potentielle Risiko rechtfertigt. Es gibt Berichte über eine geringere Verfügbarkeit von Rilpivirin, wenn schwangere Frauen 25 mg Rilpivirin einmal täglich einnahmen. In den Phase-III-Studien wurde eine geringere Rilpivirin-Verfügbarkeit (vergleichbar mit der während der Schwangerschaft) mit einem erhöhten Risiko für virologisches Versagen in Verbindung gebracht. Daher sollte die Viruslast in der Schwangerschaft engmaschig überwacht werden. Alternativ ist der Wechsel auf ein anderes ART-Regime in Betracht zu ziehen.
Bislang gibt es nur begrenzte Daten (weniger als 300 Schwangerschaftsverläufe) zur Anwendung von Rilpivirin in der Schwangerschaft. Tierexperimentelle Studien ergaben keine direkten oder indirekten schädlichen Effekte im Zusammenhang mit einer Reproduktionstoxizität. Vorsichtshalber sollte aber möglichst auf die Anwendung von Rilpivirin während der Schwangerschaft verzichtet werden.
Es ist nicht bekannt, ob Rilpivirin in die Muttermilch übergeht. Bei säugenden Ratten war dies jedoch der Fall. Mütter, die Rilpivirin einnehmen, sollten sowohl wegen der Möglichkeit einer HIV-Übertragung als auch der Möglichkeit unerwünschter Wirkungen bei gestillten Säuglingen besser nicht stillen.
Derzeit liegen keine Daten über die Auswirkung von Rilpivirin auf die Fertilität beim Menschen vor. Tierexperimentelle Studien ergaben bislang jedoch keine Hinweise auf klinisch relevante Fertilitäts-Effekte.
Verkehrstüchtigkeit
Rilpivirin hat keinen oder einen zu vernachlässigenden Einfluss auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen. Dennoch kann es bei einigen Patienten während einer Rilpivirin-Behandlung zu Erschöpfung (Fatigue), Schwindel und Somnolenz kommen. Dies sollte beachtet werden, wenn bei einem Patienten die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen beurteilt werden soll.
Weitere Details zu diesem Wirkstoff können Sie der entsprechenden Fachinformation entnehmen.
Anwendungshinweise
Virus-Übertragung
Es hat sich gezeigt, dass eine erfolgreiche Virussuppression durch eine antiretrovirale Therapie das Risiko einer sexuellen Übertragung erheblich reduziert. Dennoch kann ein Restrisiko nicht gänzlich ausgeschlossen werden. Deshalb sind Vorsichtsmaßnahmen zur Vermeidung der Übertragung gemäß nationaler Richtlinien zu treffen.
Virologisches Versagen und Resistenzbildung
Bislang gibt es keine Untersuchungen zu Rilpivirin bei Patienten mit vorherigem virologischem Versagen unter irgendeiner anderen antiretroviralen Therapie. In der gepoolten Wirksamkeitsanalyse der Phase-III-Studien mit Erwachsenen hatten mit Rilpivirin behandelte Patienten mit einer Ausgangsviruslast von > 100.000 HIV-1-RNA-Kopien/ml nach 96 Wochen ein höheres Risiko eines virologischen Versagens (18,2 % mit Rilpivirin versus 7,9 % mit Efavirenz) als Patienten mit einer Ausgangsviruslast von ≤ 100.000 HIV-1-RNA-Kopien/ml auf (5,7 % mit Rilpivirin versus 3,6 % mit Efavirenz). Das höhere Risiko eines virologischen Versagens wurde bei Patienten im Rilpivirin-Arm in den ersten 48 Wochen dieser Studien beobachtet.
Patienten mit einer Viruslast von > 100.000 HIV-1-RNA-Kopien/ml zeigten bei einem virologischen Versagen eine höhere Rate behandlungsbedingter Resistenzen gegen die Klasse der nicht-nukleosidalen Reverse-Transkriptase-Inhibitoren. Bei virologischem Versagen unter Rilpivirin entwickelten mehr Patienten eine Lamivudin/Emtricitabin-assoziierte Resistenz, als bei virologischem Versagen unter Efavirenz.
In Studie C213 stimmten die Ergebnisse bei Jugendlichen (12 Jahre bis unter 18 Jahren) im Allgemeinen mit diesen Daten überein. Mit Rilpivirin sollten nur Jugendliche behandelt werden, bei denen eine gute Adhärenz zur antiretroviralen Behandlung angenommen wird. Eine suboptimale Adhärenz kann zur Entstehung von Resistenzen und einem Verlust zukünftiger Behandlungsoptionen führen.
Herz-Kreislaufsystem
Bei supratherapeutischen Dosen (einmal täglich 75 und 300 mg) war Rilpivirin mit einer Verlängerung des QTc-Intervalls im EKG assoziiert. Bei der empfohlenen Dosierung von 25 mg einmal täglich konnten keine klinisch relevanten Auswirkungen dieser Art festgestellt werden. Bei gleichzeitiger Anwendung mit einem Arzneimittel mit bekanntem Risiko für Torsade de Pointes sollte Rilpivirin nur mit Vorsicht verordnet werden.
Immun-Rekonstitutions-Syndrom
Bei HIV-infizierten Patienten mit einer schwerwiegenden Immunschwäche zu Beginn der cART ist eine entzündliche Reaktion auf asymptomatische oder residuale opportunistische Erreger möglich - zudem ernsthafte Erkrankungen oder eine Verstärkung der Symptome. Solche Reaktionen wurden typischerweise innerhalb der ersten Wochen oder Monate nach Beginn einer cART beobachtet. Relevante Beispiele sind Cytomegalievirus-Retinitis, generalisierte und/oder fokale mykobakterielle Infektionen sowie Pneumocystis-jiroveci-Pneumonie. Etwaige entzündliche Symptome sollten untersucht und gegebenenfalls behandelt werden.
Darüber hinaus gibt es Berichte über Autoimmunerkrankungen wie Morbus Basedow, die im Rahmen einer Immun-Reaktivierung auftreten können. Der Zeitpunkt des Auftretens ist allerdings sehr variabel. Diese Ereignisse sind auch noch viele Monate nach Beginn der Behandlung möglich.
Alternativen
Verwandte Wirkstoffe
Rilpivirin (ATC-Klasse J05AG05) gehört zu den antiviralen Mittel zur systemischen Anwendung bei HIV-Infektionen, wie beispielsweise auch:
Fachinformationen Edurant, European Medicines Agency
Abbildung
Adapted from „HIV Sites for Therapeutic Intervention”, by BioRender.com