Tocilizumab
Tocilizumab ist ein monoklonaler Antikörper, der zur Therapie der rheumatoiden Arthritis und des Zytokin-Freisetzungs-Syndroms angewendet wird. Zudem wird der Wirkstoff als Therapieoption bei COVID-19-Patienten klinisch geprüft.
Tocilizumab: Übersicht
Anwendung
Tocilizumab ist ein monoklonaler Antikörper gegen das entzündungsfördernde Zytokin Interleukin-6. Die Anwendung erfolgt bei folgenden Indikationsgebieten in der Regel als Kombinationstherapie mit Methotrexat (MTX), aber auch eine Monotherapie mit Tocilizumab ist möglich.
- Schwere, aktive und progressive rheumatoiden Arthritis bei Erwachsenen, die zuvor nicht mit Methotrexat behandelt wurden
- Mäßige bis schwere aktive rheumatoide Arthritis bei Erwachsene, die unzureichend auf eine vorangegangene Behandlung mit einem oder mehreren krankheitsmodifizierenden Antirheumatika (DMARDs) oder Tumornekrosefaktor(TNF)-Inhibitoren angesprochen oder diese nicht vertragen haben
- Aktive systemische juvenile idiopathische Arthritis (sJIA) bei Patienten ab einem Alter von 2 Jahren, die nur unzureichend auf eine vorangegangene Behandlung mit nichtsteroidalen Antiphlogistika (NSAIDs) und systemischen Glucocorticoiden angesprochen haben
- Polyartikuläre juvenile idiopathische Arthritis (pJIA; Rheumafaktor-positiv oder -negativ und erweiterte Oligoarthritis) bei Patienten ab einem Alter von 2 Jahren, die nur unzureichend auf eine vorangegangene Behandlung mit MTX angesprochen haben
- Riesenzellarteriitis (RZA) bei Erwachsenen
- Chimärer-Antigenrezeptor(CAR)-T-Zell-induziertes schweres oder lebensbedrohliches Zytokin-Freisetzungs-Syndrom (Cytokine Release Syndrome, CRS) bei Erwachsenen, Jugendlichen und Kindern ab 2 Jahren
In der S1-Leitline zur Therapie von COVID-19 wird Tocilizumab als Teil der immunmodulatorischen Therapieoptionen aufgeführt. Die Ergebnisse einer am 6. Juli 2021 im Journal of the American Medical Association (JAMA) veröffentlichten Studie haben zu einer entsprechenden Empfehlung der Weltgesundheitsorganisation (WHO) geführt, Interleukin-6-Antagonisten zusammen mit Glucocorticoiden bei Patienten mit schwerem oder kritischem COVID-19 zu verwenden.
Im Dezember 2021 erhielt Tocilizumab durch die EU-Kommission die Zulassung für die Behandlung erwachsener Patienten mit COVID-19, die systemische Kortikosteroide erhalten und zusätzlich Sauerstoff oder eine mechanische Beatmung benötigen.
Anwendungsart
Tocilizumab ist als Konzentrat zur Herstellung einer Infusionslösung im Handel, die vor der Anwendung mit 0,9%-iger Natriumchlorid-Lösung verdünnt und dann intravenös verabreicht wird. Weiterhin stehen Injektionslösungen in einer Fertigspritze zur subkutanen Applikation zur Verfügung.
Wirkmechanismus
Interleukin-6 ist ein pleiotropes, proinflammatorisches Zytokin, das von verschiedenen Zelltypen wie T- und B-Lymphozyten, Monozyten und Fibroblasten synthetisiert wird. Das Signalmolekül ist an verschiedenen physiologischen Prozessen wie der T-Zell-Aktivierung, Induktion der Immunglobulin-Sekretion, Induktion der Synthese hepatischer Akute-Phase-Proteine sowie der Stimulation der Hämatopoese beteiligt. Interleukin-6 wird mit der Entstehung verschiedener Erkrankungen wie entzündlicher Erkrankungen, Osteoporose und Neoplasien in Verbindung gebracht.
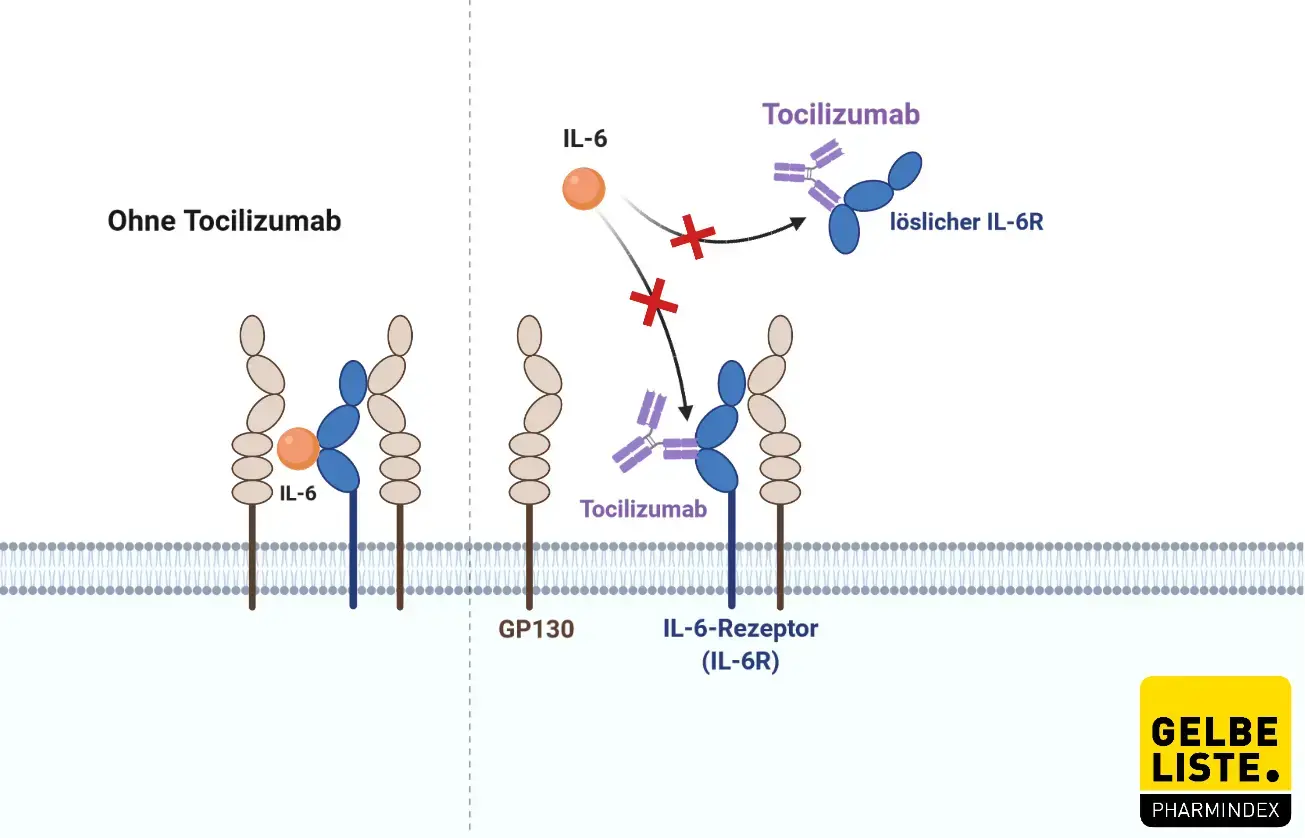
Der humanisierter monoklonaler IgG1-Antikörper Tocilizumab ist gegen den humanen Interleukin-6-(IL-6)-Rezeptor gerichtet. Der Wirkstoff bindet sowohl lösliche als auch membrangebundene IL-6-Rezeptoren und inhibiert die Signaltransduktion.
Aufgrund der Hemmung der IL-6-Effekte kann Tocilizumab bei rheumatoider Arthritis in Kombination mit Methotrexat das Fortschreiten der radiologisch nachweisbaren strukturellen Gelenkschädigungen vermindern und die körperliche Funktionsfähigkeit verbessern.
Daten vom Februar 2021der RECOVERY-Studie, die verschiedene medikamentöse Therapien bei COVID-19 untersucht, legen nahe, dass die Kombination eines systemischen Glucocorticoids (wie Dexamethason) und Tocilizumab die Mortalität bei COVID-19-Patienten, die einfachen Sauerstoff benötigen, um etwa ein Drittel und bei Patienten, die eine invasive mechanische Beatmung brauchen, um fast die Hälfte verringert.
Pharmakokinetik
Resorption
Die Bioverfügbarkeit von Tocolizumab bei subkutaner Injektion beträgt etwa 79%, dabei werden die maximalen Plasmaspiegel nach etwa 2,8 Tagen erreicht.
Bei der Infusion von höheren Dosierungen flacht die Dosis-Wirkungs-Kurve ab, sodass nur eine geringe Wirksamkeitsverbesserung ab Dosierungen von über 800 mg Tocilizumab pro Infusion erwartet werden kann.
Verteilung (Distribution)
Das Verteilungsvolumen von Tocilizumab im Steady State setzt sich aus einem zentralen sowie peripheren Verteilungsvolumen zusammen. Bei Erwachsenen mit rheumatoider Arthritis wurde nach intravenöser Infusion ein gesamtes Verteilungsvolumen von etwa 7,07 L beobachtet.
Elimination
Tocilizumab wird biphasisch eliminiert. Bei niedrigen Dosierungen wird der Wirkstoff mit einer nichtlinearen Kinetik ausgeschieden. Bei höheren Dosierungen ist diese gesättigt, sodass eine lineare Kinetik die Elimination von Tocilizumab bestimmt.
Die Halbwertszeit von Tocilizumab ist konzentrationsabhängig. Bei einmaliger Gabe von 8mg/kg alle vier Wochen verkürzt sich die Halbwertszeit mit abnehmender Konzentration im Steady State von etwa 16 bis 18 Tagen auf sechs Tage innerhalb eines Dosierintervalls.
Dosierung
Die Dosierung und Häufigkeit der Anwendung von Tocilizumab ist abhängig von der Erkrankung sowie dem Körpergewicht des Patienten.
Rheumatoide Arthritis
Bei Erwachsenen mit Rheumatoider Arthritis wird eine Infusion mit einer Tocilizumab-Dosierung von 8 mg/kg einmal alle vier Wochen empfohlen. Personen, deren Körpergewicht über 100 kg liegt, sollten eine Maximaldosis von 800 mg Tocilizumab pro Infusion erhalten. Dosierungen von über 1,2 g wurden in klinischen Prüfungen nicht untersucht.
Bei der Injektion mit einer Fertigspritze werden einmal wöchentlich 162 mg Tocolizumab subkutan verabreicht.
Aktive systemische juvenile idiopathische Arthritis (sJIA) und polyartikuläre juvenile idiopathische Arthritis (pJIA)
Bei Patienten ab einem Alter von 2 Jahren mit einem Mindestgewicht von 30 kg werden 8 mg Tocilizumab/kg, bei Patienten mit einem Gewicht unter 30 kg eine Dosierung von 12 mg/kg empfohlen. Die Anwendung erfolgt bei sJIA alle zwei Wochen, bei pJIA alle vier Wochen. Eine entsprechende Anpassung der Dosierung sollte nur bei einer dauerhaften Änderung des Gewichts erfolgen.
Riesenzellarteriitis (RZA)
Es wird zur subkutanen Injektion eine Dosierung von 162 mg Tocilizumab einmal wöchentlich in Kombination mit einer Ausschleichtherapie der Glucocorticoide empfohlen. Nach deren Absetzen kann Tocolizumab als Monotherapie angewendet werden.
Zytokin-Freisetzungs-Syndrom (CRS)
Bei einem Mindestgewicht von 30 kg wird eine Tocilizumab-Dosis von 8 mg/kg, bei einem Gewicht unter 30 kg eine Dosierung von 12 mg/kg zur Infusion empfohlen. Eine Maximaldosis von 800 mg pro Infusion sollte nicht überschritten werden. Die Gabe erfolgt als intravenöse Infusion über 60 Minuten als Monotherapie oder in Kombination mit systemischen Glucocorticoiden. Tritt nach der ersten Dosis keine klinische Verbesserung ein, können bis zu drei weitere Dosen in einem Abstand von jeweils 8 Stunden verabreicht werden.
Dosisanpassung
Im Falle von Leberenzymabweichungen unter der Therapie mit Tocilizumab kann eine Dosisreduktion oder das Absetzen der Behandlung sowie eine Dosisanpassung von Methotrexat nötig werden.
Sinkt die absolute Anzahl neutrophiler Granulozyten auf etwa 0,5 bis 1 x 109 Zellen/l, sollte die Behandlung mit Tocilizumab unterbrochen, bei Werten unter 0,5 x 109 Zellen/l vollständig abgebrochen werden.
Auch bei niedrigen Thrombozytenzahl kann eine Unterbrechung (50 bis 100 x 103 Zellen/l) oder ein Abbruch (< 50 x 103 Zellen/l) der Therapie nötig werden.
In diesen Fällen ist jedoch zu beachten, dass Patienten mit Zytokin-Freisetzungs-Syndrom (CRS) aufgrund der zugrundeliegenden malignen Erkrankung, vorangegangener chemotherapiebedingter Lymphozytendepletion oder des CRS selbst häufig Zytopenien oder Leberenzymwerte aufweisen.
Nebenwirkungen
Die folgenden Nebenwirkungen können während der Therapie mit Tocilizumab häufig (≥ 1/100 bis < 1/10) bis sehr häufig (≥ 1/10) auftreten:
- Infektionen des oberen Respirationstrakts
- Hypercholesterinämie
- Zellulitis, Pneumonie, oraler Herpes simplex, Herpes zoster
- Abdominale Schmerzen, Mundulzera, Gastritis
- Übelkeit, Diarrhoe
- Exanthem, Pruritus, Urtikaria
- Kopfschmerzen, Schwindel
- Erhöhung der Lebertransaminasen und des Gesamtbilirubins, Gewichtszunahme
- Hypertonie
- Leukopenie, Neutropenie, Hypofibrinogenämie
- Peripheres Ödem, Überempfindlichkeitsreaktionen
- Konjunktivitis
- Husten, Dyspnoe
Wechselwirkungen
Studien zu Wechselwirkungen von Tocilizumab mit anderen Arzneimitteln wurden nur bei Erwachsenen durchgeführt.
Der Wirkstoff sollte nicht mit Lebendimpfstoffen oder anderen biologischen Therapien wie TNF-Inhibitoren kombiniert werden, da die klinische Sicherheit bisher nicht nachgewiesen wurde.
Durch proinflammatorische Zytokine wie IL-6 kann die Bildung von Cytochrom-P450-Enzymen (CYP-Enzyme) reduziert sein. Tocilizumab normalisiert die Enzymexpression der CYP-Enzyme, daher sollten Patienten, die Arzneimittel anwenden, deren Metabolismus vom CYP-System abhängt überwacht werden, da eine Dosisanpassung nötig werden kann. Zu den betroffenen Arzneimitteln zählen unter anderem:
Kontraindikation
Die Behandlung mit Tocilizumab ist in folgenden Fällen kontraindiziert:
- Überempfindlichkeit gegen den Wirkstoff
- Aktive, schwere Infektionen
Schwangerschaft
Bisher liegen keine ausreichenden Daten zur Anwendung von Tocilizumab in der Schwangerschaft vor. Im Tierversuch wurden bei hohen Dosierungen ein erhöhtes Risiko für Spontanaborte und embryonal-fetalen Tod beobachtet. Eine Anwendung von Tocilizumab während der Schwangerschaft wird daher nicht empfohlen, es sei denn, dies ist eindeutig erforderlich.
Stillzeit
Es ist nicht bekannt, ob Tocilizumab beim Menschen in die Muttermilch übergeht. Die Anwendung in der Stillzeit sollte nur unter strenger Nutzen-Risiko-Abwägung erfolgen, gegebenenfalls kann eine Stillpause erwogen werden.
Verkehrstüchtigkeit
Tocilizumab hat einen geringen Einfluss auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen.
Anwendungshinweise
Patienten, die mit Tocilizumab behandelt werden, sollten einen entsprechenden Patientenpass erhalten.
Patienten, die von der intravenösen auf die subkutane Darreichungsform von Tocilizumab wechseln, sollten die erste subkutane Dosis zum Zeitpunkt der nächsten geplanten intravenösen Dosis unter Aufsicht von qualifiziertem medizinischen Fachpersonal anwenden.
Überwachung
Die Anwendung von Tocilizumab bei Patienten mit mäßiger bis schwerer Nierenfunktionsstörung ist nicht untersucht. Daher müssen diese Personen engmaschig überwacht werden.
Bei der Behandlung mit Tocilizumab können zwischen zwei Wochen und bis zu mehr als fünf Jahre nach Beginn der Therapie schwerwiegende Leberschädigungen auftreten. Daher sollten Patienten angewiesen werden, sofort einen Arzt aufzusuchen, wenn Anzeichen und Symptome einer Leberschädigung auftreten. Weiterhin sollten während der ersten 6 Monate der Behandlung alle vier bis acht Wochen und danach alle zwölf Wochen die Leberenzymwerte kontrolliert werden.
Bei Patienten mit rheumatoider Arthritis müssen neutrophile Granulozyten und Thrombozyten vier bis acht Wochen nach Behandlungsbeginn, bei Patienten mit sJIA und pJIA zum Zeitpunkt der zweiten Infusion kontrolliert werden. Anschließend sollte eine regelmäßige Kontrolle entsprechend der normalen klinischer Praxis erfolgen.
Vier bis acht Wochen nach Beginn der Behandlung mit Tocilizumab muss bei Patienten mit sJIA, pJIA und rheumatoider Arthritis eine Überprüfung der Lipidwerte erfolgen. Die Patienten sollten gemäß lokaler Therapieleitlinien für Hyperlipidämien behandelt werden.
Weitere Informationen sind der jeweiligen Fachinformation zu entnehmen.
- EMA: Fachinformation RoActemra 20 mg/ml Konzentrat zur Herstellung einer Infusionslösung
- Roche Pharma AG: Fachinformation RoActemra® Fertigspritze
- AWMF: Empfehlungen zur intensivmedizinischen Therapie von Patienten mit COVID-19
- recoverytrial.net: Tocilizumab reduces deaths in patients hospitalised with COVID-19
Abbildung
Created with Biorender
-
RoActemra 162 mg Abacus Injektionslösung in einer Fertigspritze
Abacus Medicine A/S
-
RoActemra 162 mg ACA Injektionslösung in einem Fertigpen
A.C.A. Müller ADAG Pharma AG
-
RoActemra 162 mg ACA Injektionslösung in einer Fertigspritze
A.C.A. Müller ADAG Pharma AG
-
RoActemra 162 mg axicorp Injektionslösung in einem Fertigpen
axicorp Pharma B.V.
-
RoActemra 162 mg axicorp Injektionslösung in einer Fertigspritze
axicorp Pharma B.V.
-
RoActemra 162 mg BB Farma Injektionslösung in einer Fertigspritze
BB Farma S.R.L.
-
RoActemra 162 mg Canoma Injektionslösung in einem Fertigpen
Canoma Pharma GmbH
-
RoActemra 162 mg Canoma Injektionslösung in einer Fertigspritze
Canoma Pharma GmbH
-
RoActemra 162 mg CC-Pharma Injektionslösung in einem Fertigpen
CC Pharma GmbH
-
RoActemra 162 mg CC-Pharma Injektionslösung in einer Fertigspritze
CC Pharma GmbH
-
RoActemra 162 mg Eurim Injektionslösung in einem Fertigpen
Eurim-Pharm Arzneimittel GmbH
-
RoActemra 162 mg Eurim Injektionslösung in einer Fertigspritze
Eurim-Pharm Arzneimittel GmbH
-
RoActemra 162 mg European Injektionslösung in einer Fertigspritze
European Pharma B.V.
-
RoActemra 162 mg FD Pharma Injektionslösung in einer Fertigspritze
FD Pharma GmbH
-
RoActemra 162 mg Haemato Pharm Injektionslösung in einem Fertigpen
HAEMATO PHARM GmbH
-
RoActemra 162 mg Haemato Pharm Injektionslösung in einer Fertigspritze
HAEMATO PHARM GmbH
-
RoActemra® 162 mg Injektionslösung in einem Fertigpen
Roche Pharma AG
-
RoActemra® 162 mg Injektionslösung in einer Fertigspritze
Roche Pharma AG
-
RoActemra 162 mg kohlpharma Injektionslösung in einem Fertigpen
kohlpharma GmbH
-
RoActemra 162 mg kohlpharma Injektionslösung in einer Fertigspritze
kohlpharma GmbH
-
RoActemra 162 mg Medicopharm Injektionslösung in einem Fertigpen
Medicopharm AG
-
RoActemra 162 mg Medicopharm Injektionslösung in einer Fertigspritze
Medicopharm AG
-
RoActemra 162 mg NMG Pharma Injektionslösung in einem Fertigpen
NMG Pharma GmbH
-
RoActemra 162 mg NMG Pharma Injektionslösung in einer Fertigspritze
NMG Pharma GmbH
-
RoActemra 162 mg Orifarm Injektionslösung in einem Fertigpen
Orifarm GmbH
-
RoActemra 162 mg Orifarm Injektionslösung in einer Fertigspritze
Orifarm GmbH
-
RoActemra 162 mg Originalis Injektionslösung in einem Fertigpen
Originalis B.V.
-
RoActemra 162 mg Originalis Injektionslösung in einer Fertigspritze
Originalis B.V.
-
RoActemra 162 mg Paranova Injektionslösung in einem Fertigpen
Paranova Pack A/S
-
Roactemra 162 mg Paranova Injektionslösung in einer Fertigspritze
Paranova Pack A/S
-
RoActemra 162 mg PB Pharma Injektionslösung in einem Fertigpen
PB Pharma GmbH
-
RoActemra 162 mg PB Pharma Injektionslösung in einer Fertigspritze
PB Pharma GmbH
-
RoActemra 162 mg Synco Pharma Injektionslösung in einem Fertigpen
SynCo pharma B.V.
-
RoActemra 162 mg Synco Pharma Injektionslösung in einer Fertigspritze
SynCo pharma B.V.
-
Tofidence 20 mg/ml 80 mg Konzentrat zur Herstellung einer Infusionslösung
Biogen GmbH
-
Tofidence 20 mg/ml 200 mg Konzentrat zur Herstellung einer Infusionslösung
Biogen GmbH
-
Tofidence 20 mg/ml 400 mg Konzentrat zur Herstellung einer Infusionslösung
Biogen GmbH
-
Tyenne 20 mg/ml Abacus Konzentrat zur Herstellung einer Infusionslösung, 80 mg
Abacus Medicine A/S
-
Tyenne 20 mg/ml Abacus Konzentrat zur Herstellung einer Infusionslösung, 200 mg
Abacus Medicine A/S
-
Tyenne 20 mg/ml Abacus Konzentrat zur Herstellung einer Infusionslösung, 400 mg
Abacus Medicine A/S
-
Tyenne 20 mg/ml axicorp Konzentrat zur Herstellung einer Infusionslösung, 80 mg
axicorp Pharma GmbH
-
Tyenne 20 mg/ml axicorp Konzentrat zur Herstellung einer Infusionslösung, 200 mg
axicorp Pharma GmbH
-
Tyenne 20 mg/ml axicorp Konzentrat zur Herstellung einer Infusionslösung, 400 mg
axicorp Pharma GmbH
-
Tyenne 20 mg/ml Haemato Pharm Konzentrat zur Herstellung einer Infusionslösung, 80 mg
HAEMATO PHARM GmbH
-
Tyenne 20 mg/ml Haemato Pharm Konzentrat zur Herstellung einer Infusionslösung, 200 mg
HAEMATO PHARM GmbH
-
Tyenne 20 mg/ml Haemato Pharm Konzentrat zur Herstellung einer Infusionslösung, 400 mg
HAEMATO PHARM GmbH
-
Tyenne 20 mg/ml kohlpharma Konzentrat zur Herstellung einer Infusionslösung, 80 mg
kohlpharma GmbH
-
Tyenne 20 mg/ml kohlpharma Konzentrat zur Herstellung einer Infusionslösung, 200 mg
kohlpharma GmbH
-
Tyenne 20 mg/ml kohlpharma Konzentrat zur Herstellung einer Infusionslösung, 400 mg
kohlpharma GmbH
-
Tyenne 20 mg/ml Konzentrat zur Herstellung einer Infusionslösung, 80 mg
FRESENIUS KABI Deutschland GmbH














