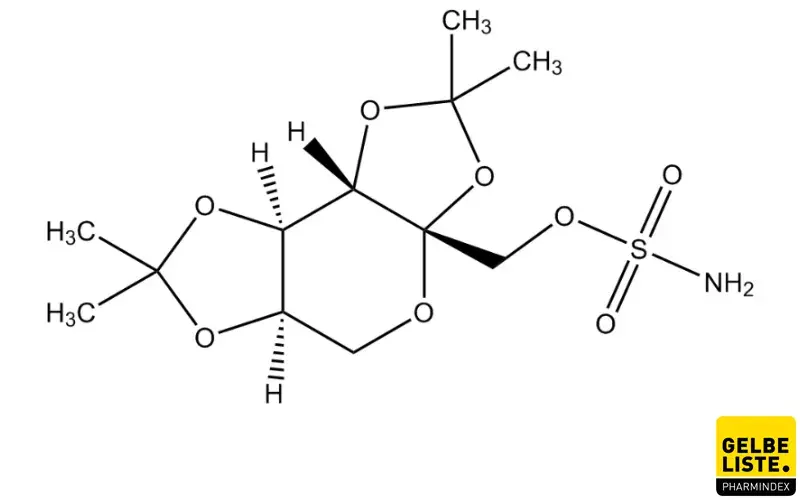
Topiramat
Topiramat ist ein Wirkstoff aus der Gruppe der Antiepileptika (Antikonvulsiva), der über multiple Mechanismen antiepileptische Wirkungen entfaltet. Darüber hinaus wird Topiramat zur Migräneprophylaxe eingesetzt.
Topiramat: Übersicht
Anwendung
Der antikonvulsive Wirkstoff Topiramat ist zur Behandlung unterschiedlicher Epilepsieformen indiziert:
- Monotherapie bei Erwachsenen, Jugendlichen und Kindern ab 6 Jahren mit fokalen Krampfanfällen mit oder ohne sekundär generalisierten Anfällen und primär generalisierten tonisch-klonischen Anfälle
- Zusatztherapie bei Kindern ab 2 Jahren, Jugendlichen und
Erwachsenen mit fokalen Anfällen mit oder ohne sekundärer Generalisierung oder primär generalisierten tonisch-klonischen Anfällen und zur Behandlung von Anfällen, die mit dem Lennox-Gastaut Syndrom assoziiert sind.
Zusätzlich ist Topiramat indiziert bei Erwachsenen zur Prophylaxe von Migräne-Kopfschmerzen nach sorgfältiger Abwägung möglicher alternativer Behandlungsmethoden. Der Wirkstoff ist nicht für die Akutbehandlung einer Migräne-Attacke vorgesehen.
Anwendungsart
Topiramat ist in Form von Filmtabletten (25, 50, 100, 200 mg) erhältlich.
Die Filmtabletten sollen nicht geteilt und unzerkaut mit einer ausreichenden Wassermenge eingenommen werden. Die Einnahme kann nahrungsunabhängig erfolgen.
Die Tablettenzusammensetzung ist nicht für Kinder geeignet, die weniger als 25 mg/Tag benötigen. In diesem Fall sollte eine passende alternative Formulierung verordnet werden.
Wirkmechanismus
Der exakte Wirkmechanismus, auf dem die antiepileptischen und Migräne prophylaktischen Eigenschaften von Topiramat beruhen, ist noch nicht vollständig aufgeklärt. Topiramat wirkt über multiple Mechanismen antiepileptisch:
- Hemmung spannungsabhängiger Natriumkanäle, wodurch Aktionspotenziale unterdrückt werden, die durch anhaltende Depolarisation der Neuronen ausgelöst werden.
- Antagonismus an AMPA/Kainat-Subtypen der exzitatorischen Glutamatrezeptoren ohne wesentliche Effekte auf NMDA-Subtypen.
- Verstärkung GABAA-vermittelter GABA-Wirkungen (inhibitorischer Neurotransmitter), wobei sich das Wirkprofil von dem der Benzodiazepine unterscheidet.
Pharmakokinetik
Allgemein
- Das pharmakokinetische Profil von Topiramat zeigt, verglichen mit anderen Antiepileptika, eine lange Plasmahalbwertzeit, eine lineare Pharmakokinetik, eine prädominante renale Clearance, das Fehlen einer signifikanten Proteinbindung und das Fehlen von klinisch relevanten aktiven Metaboliten.
- Topiramat ist kein potenter Induktor arzneimittelmetabolisierender Enzyme und kann unabhängig von den Mahlzeiten verabreicht werden.
- Zusätzlich ist keine Routineüberwachung der Topiramat-Plasmakonzentrationen notwendig.
- In klinischen Studien gab es keine konsistente Beziehung zwischen den Plasmakonzentrationen und der Wirksamkeit oder unerwünschten Ereignissen.
Resorption
- Topiramat wird schnell und gut resorbiert.
- Nach der Einnahme von 100 mg Topiramat wurde eine mittlere maximale Plasmakonzentration (cmax) von 1,5 μg/mL innerhalb von 2-3 Stunden (tmax) erreicht.
- Es gibt keine klinisch signifikante Auswirkung von Nahrung auf die Bioverfügbarkeit von Topiramat.
Verteilung
- Topiramat wird zu etwa 13-17% an Plasmaproteine gebunden.
- In/an Erythrozyten wurde eine Bindungsstelle mit niedriger Kapazität für Topiramat beobachtet, die bei Plasmakonzentrationen über 4 μg/mL sättigbar ist.
- Das Verteilungsvolumen verhält sich umgekehrt zur Dosis.
- Das mittlere scheinbare Verteilungsvolumen beträgt etwa 0,80 bis 0,55 L/kg für eine Einzeldosis im Bereich von 100 bis 1.200 mg.
Metabolismus
- Topiramat wird in geringem Ausmaß metabolisiert (ca. 20%).
- Topiramat wird bis zu 50% metabolisiert, wenn gleichzeitig eine antiepileptische Therapie mit bekannten Induktoren wirkstoffmetabolisierender Enzyme durchgeführt wird.
- Es sind 6 Metaboliten, die durch Hydroxylierung, Hydrolyse und Glucuronidierung gebildet werden, bekannt (2 Metaboliten, die strukturell am wenigsten von Topiramat abweichen und untersucht wurden, zeigten wenig oder keine antikonvulsive Aktivität).
Elimination
- Topiramat und Metaboliten werden hauptsächlich (≥ 81% der Dosis) renal eliminiert (ungefähr 66% einer Dosis werden innerhalb von 4 Tagen unverändert mit dem Urin ausgeschieden).
- Nach zweimal täglicher Dosierung von 50 mg und 100 mg Topiramat beträgt die mittlere renale Clearance ca. 18 mL/min und 17 mL/min.
- Es gibt Hinweise für eine renale tubuläre Reabsorption von Topiramat.
- Insgesamt beträgt die Plasmaclearance nach Einnahme beim Menschen ungefähr 20 bis 30 mL/min.
Linearität/Nicht-Linearität
- Topiramat besitzt eine geringe interindividuelle Variabilität der Plasmakonzentration und daher eine vorhersagbare Pharmakokinetik.
- Die Pharmakokinetik von Topiramat ist linear mit einer konstant bleibenden Plasmaclearance und einer Fläche unter der Plasmakonzentrationskurve (AUC), die nach oraler Einmaldosis bei Probanden sich dosis-proportional verhaltend über einen Bereich 100 bis 400 mg ansteigt.
- Bei Patienten mit normaler Nierenfunktion kann es 4 bis 8 Tage dauern, bis Steady-State-Plasmakonzentrationen erreicht sind.
- Die mittlere cmax nach multiplen, zweimal täglichen oralen Dosen von 100 mg beträgt bei gesunden Personen etwa 6,76 μg/mL.
- Nach Verabreichung von multiplen Dosen von 50 mg und 100 mg Topiramat zweimal täglich beträgt die mittlere Eliminationshalbwertzeit im Plasma ungefähr 21 Stunden.
Patientenindividuelle Pharmakokinetik
Nierenfunktionsstörung:
- Die Plasma- und die renale Clearance von Topiramat sind bei Patienten mit mäßig und schwer eingeschränkter Nierenfunktion (CLCR ≤ 70 mL/min) vermindert.
- Als ein Ergebnis werden höhere Topiramat-Steady-State Plasmakonzentrationen für eine gegebene Dosis bei renal eingeschränkten Patienten erwartet verglichen mit Patienten mit normaler Nierenfunktion.
- Darüber hinaus brauchen Patienten mit eingeschränkter Nierenfunktion in jeder Dosierung einen längeren Zeitraum zum Erreichen des Steady-State.
- Bei Patienten mit mäßig oder schwer eingeschränkter Nierenfunktion wird eine Halbierung der üblichen Anfangs- und Erhaltungsdosis empfohlen.
- Topiramat wird effektiv durch Hämodialyse aus dem Plasma entfernt.
- Hämodialyse über einen verlängerten Zeitraum kann das Absinken der Topiramatkonzentration unter die zur Erhaltung des antikonvulsiven Effektes erforderlichen Spiegel verursachen.
- Um einen rapiden Abfall der Topiramat-Plasmakonzentration während der Hämodialyse zu vermeiden, kann eine zusätzliche Dosis Topiramat erforderlich sein. Bei der jeweiligen Dosisanpassung soll 1) die Dauer der Dialysebehandlung, 2) die Clearance-Rate des verwendeten Dialysesystems und 3) die tatsächliche renale Clearance von Topiramat beim Patienten, der dialysiert wird, berücksichtigt werden.
Leberfunktionsstörung:
- Die Plasmaclearance von Topiramat ist bei Patienten mit mäßiger bis schwerer Leberfunktionsstörung um durchschnittlich 26% erniedrigt.
- Daher soll Topiramat bei Patienten mit Leberfunktionsstörung mit Vorsicht verabreicht werden.
Pädiatrische Patienten (Pharmakokinetik bis zu einem Alter von 12 Jahren):
- Die Pharmakokinetik von Topiramat bei Kindern ist wie bei Erwachsenen, die eine Add-on Therapie erhalten, linear mit einer von der Dosis unabhängigen Clearance und Steady-State-Plasmakonzentrationen, die proportional zur Dosis ansteigen.
- Kinder haben jedoch eine höhere Clearance und eine kürzere Eliminationshalbwertzeit.
- Als Konsequenz können die Plasmakonzentrationen von Topiramat bei derselben mg/kg Dosis bei Kindern niedriger sein verglichen mit Erwachsenen.
- Auch bei Kindern vermindern enzyminduzierende antiepileptische Arzneimittel die Steady-State-Plasmakonzentrationen.
Dosierung
Monotherapie Epilepsie
Allgemein:
- Wenn begleitende Antiepileptika abgesetzt werden, um eine Monotherapie mit Topiramat zu erreichen, sind die Auswirkungen, die dies auf die Anfallkontrolle haben kann, zu berücksichtigen.
- Sofern Sicherheitsbedenken nicht ein sofortiges Absetzen des begleitenden Antiepileptikums erfordern, wird ein schrittweises Ausschleichen in der Höhe von etwa einem Drittel der bislang verabreichten Antiepileptikadosis alle zwei Wochen empfohlen.
- Wenn enzyminduzierende Arzneimittel abgesetzt werden, wird der Topiramat-Spiegel ansteigen (wenn klinisch indiziert, kann eine Reduzierung der Topiramat-Dosis erforderlich sein).
Erwachsene:
- Die Dosierung und die Dosistitration sollten sich am klinischen Ansprechen orientieren.
- Die Titration sollte mit 25 mg abends über eine Woche beginnen.
- Die Dosis sollte dann in 1- oder 2-wöchentlichen Intervallen in Schritten von 25 oder 50 mg/Tag, verteilt auf zwei Dosen, erhöht werden.
- Wenn der Patient das Titrationsschema nicht tolerieren kann, können kleinere Schritte oder längere Intervalle zwischen den Erhöhungen angewendet werden.
- Die empfohlene initiale Zieldosis für die Topiramat-Monotherapie beträgt bei Erwachsenen 100 mg/Tag bis 200 mg/Tag, verteilt auf zwei Dosen.
- Die maximale empfohlene Tagesdosis beträgt 500 mg/Tag verteilt auf zwei Dosen.
- Einige Patienten mit refraktären Formen der Epilepsie haben eine Topiramat-Monotherapie bei Dosen von 1.000 mg/Tag toleriert.
- Diese Dosisempfehlungen gelten für alle Erwachsenen einschließlich älterer Patienten bei Nicht-Vorliegen einer zugrundeliegenden Nierenerkrankung.
Kinder und Jugendliche (Kinder über 6 Jahren):
- Die Dosierung und die Titrationsrate sollten sich nach dem klinischen Erfolg richten.
- Die Behandlung von Kindern über 6 Jahren sollte in der ersten Woche mit 0,5 bis 1 mg/kg abends beginnen.
- Die Dosis sollte dann in 1- oder 2- wöchentlichen Intervallen in Schritten von 0,5 oder 1 mg/kg/Tag, verteilt auf zwei Dosen, erhöht werden.
- Wenn das Kind das Titrationsschema nicht tolerieren kann, können kleinere Schritte oder längere Intervalle zwischen den Erhöhungen angewendet werden.
- Abhängig vom klinischen Ansprechen liegt die empfohlene initiale Zieldosis für die Topiramat-Monotherapie bei Kindern über 6 Jahren im Bereich von 100 mg/Tag (dies entspricht 2,0 mg/kg/Tag bei 6- bis 16-jährigen Kindern).
Zusatztherapie Epilepsie (fokale epileptische Anfälle mit oder ohne sekundäre Generalisierung, primär generalisierte tonisch-klonische Anfälle oder epileptische Anfälle, die mit dem Lennox-Gastaut Syndrom assoziiert sind)
Erwachsene:
- Die Therapie sollte mit 25-50 mg abends über eine Woche beginnen (die Anwendung geringerer initialer Dosen wurde berichtet, aber nicht systematisch untersucht).
- Anschließend sollte die Dosis in ein- oder zwei-wöchentlichen Intervallen um 25-50 mg/Tag, verteilt auf zwei Dosen, gesteigert werden.
- Einige Patienten können eine Wirksamkeit bei einmal täglicher Dosierung erreichen.
- In klinischen Studien zur Zusatztherapie waren 200 mg die niedrigste wirksame Dosis.
- Die übliche Tagesdosis beträgt 200-400 mg verteilt auf zwei Dosen.
- Diese Dosisempfehlungen gelten für alle Erwachsenen einschließlich älterer Patienten bei Nicht-Vorliegen einer zugrundeliegenden Nierenerkrankung.
Kinder und Jugendliche (Kinder über 6 Jahren):
- Die empfohlene Gesamttagesdosis von Topiramat als Zusatztherapie liegt ungefähr bei 5 bis 9 mg/kg/Tag verteilt auf zwei Dosen.
- Die Titration sollte in der ersten Woche mit 25 mg (oder weniger, basierend auf einem Bereich von 1 bis 3 mg/kg/Tag) abends beginnen.
- Die Dosis sollte dann in 1- oder 2-wöchentlichen Intervallen in Schritten von 1 bis 3 mg/kg/Tag (verteilt auf zwei Dosen) erhöht werden, um ein optimales klinisches Ansprechen zu erreichen.
- Tagesdosen bis zu 30 mg/kg/Tag wurden untersucht und im Allgemeinen gut toleriert.
Migräne
Erwachsene:
- Die empfohlene Gesamttagesdosis von Topiramat zur Prophylaxe von Migräne-Kopfschmerzen beträgt 100 mg/Tag, verteilt auf zwei Dosen.
- Die Titration sollte mit 25 mg abends über eine Woche beginnen.
- Die Dosis sollte in Schritten von 25 mg/Tag, verabreicht in 1-wöchentlichen Intervallen, erhöht werden.
- Wenn der Patient das Titrationsschema nicht tolerieren kann, können längere Intervalle zwischen den Dosisanpassungen angewendet werden.
- Einige Patienten können von einer Gesamttagesdosis von 50 mg/Tag profitieren.
- Patienten haben eine Gesamttagesdosis bis zu 200 mg/Tag erhalten (diese
Dosis kann für manche Patienten von Vorteil sein, dennoch wird wegen einer erhöhten Inzidenz an Nebenwirkungen zur Vorsicht geraten).
Kinder und Jugendliche:
- Aufgrund unzureichender Daten zur Unbedenklichkeit und Wirksamkeit, wird Topiramat nicht für die Behandlung oder Prävention von Migräne bei Kindern empfohlen.
Allgemeine Dosierungsempfehlungen für Topiramat bei speziellen Patientengruppen
Nierenfunktionsstörungen:
- Bei Patienten mit Nierenfunktionsstörung (CLCR ≤ 70 mL/min) sollte Topiramat mit Vorsicht verabreicht werden, da die Plasmaclearance und die renale Clearance von Topiramat reduziert sind.
- Personen mit bekannter Nierenfunktionsstörung können bei jeder Dosis eine längere Zeit zum Erreichen des Steady State benötigen.
- Eine Halbierung der üblichen Anfangs- und Erhaltungsdosis wird empfohlen.
- Bei Patienten mit terminaler Niereninsuffizienz sollte an Hämodialyse-Tagen eine Supplementärdosis von Topiramat, die ungefähr der Hälfte der Tagesdosis entspricht, verabreicht werden, da Topiramat durch Hämodialyse aus dem Plasma entfernt wird
- Die Supplementärdosis sollte in Teildosen zu Beginn und nach Beendigung der Hämodialyse verabreicht werden.
- Die Supplementärdosis kann, basierend auf den Eigenschaften des verwendeten Dialyse-Equipments, variieren.
Leberfunktionsstörung:
- Bei Patienten mit mäßiger bis schwerer Leberfunktionsstörung sollte Topiramat mit Vorsicht verabreicht werden, da die Clearance von Topiramat reduziert ist.
Generell wird empfohlen, die Therapie mit Topiramat mit einer geringen Dosis zu beginnen, gefolgt von einer Titration bis zur wirksamen Dosis. Dosis und Titrationsgeschwindigkeit sollten sich dabei nach dem klinischen Ansprechen richten. Es ist nicht notwendig, die Topiramat-Plasmakonzentrationen zu überwachen, um die Therapie mit Topiramat zu optimieren.
In seltenen Fällen kann die Ergänzung von Topiramat zu Phenytoin eine Anpassung der Phenytoindosis erfordern, um ein optimales klinisches Ergebnis zu erzielen. Die Ergänzung oder das Absetzen von Phenytoin und Carbamazepin als Zusatztherapie mit Topiramat kann eine Anpassung der Dosis von Topiramat erfordern.
Bei Patienten mit oder ohne Anfälle oder Epilepsie in der Anamnese sollten antiepileptische Arzneimittel einschließlich Topiramat schrittweise abgesetzt werden, um das Potenzial für Krampfanfälle oder einen Anstieg der Anfallsfrequenz zu minimieren.
In klinischen Studien wurden die Tagesdosen bei Erwachsenen mit Epilepsie in wöchentlichen Intervallen um 50-100 mg reduziert und um 25-50 mg bei Erwachsenen, die Topiramat in Dosen bis zu 100 mg/Tag zur Migräneprophylaxe erhielten.
In klinischen Studien mit Kindern wurde Topiramat schrittweise über eine Dauer von 2-8 Wochen abgesetzt.
Nebenwirkungen
Die häufigsten Nebenwirkungen unter einer Therapie mit Topiramat umfassen:
- Psychatrisch: Depression bzw. depressive Stimmung, Bradyphrenie, Insomnie, Beeinträchtigung des sprachlichen Ausdrucksvermögens, Angst, Verwirrtheit, Desorientierung, Aggression, veränderte Stimmung, Agitiertheit, Stimmungsschwankungen, Wut, anomales Verhalten
- Nervensystem: Parästhesie, Schwindel, Somnolenz, Aufmerksamkeitsstörung, Gedächtnisstörung, Amnesie, kognitive Störung, Beeinträchtigung der geistigen Leistungsfähigkeit, eingeschränkte psychomotorische Fähigkeiten, Konvulsion, anomale Koordination, Tremor, Lethargie, Hypästhesie, Nystagmus, Dysgeusie, Gleichgewichtsstörung, Dysarthrie, Intentionstremor, Sedierung
- Gastrointestinal: Nausea, Diarrhö, Erbrechen, Obstipation, Oberbauchschmerz, Dyspepsie, abdominale Schmerzen bzw. Beschwerden, Mundtrockenheit, Magenbeschwerden, orale Parästhesie, Gastritis
- Weitere: Anämie, Anorexie, verminderter Appetit, Hypersensitivität, Sehstörungen (Verschwommensehen, Diplopie)
In seltenen Fällen kann es zu schwerwiegenden Hautreaktionen (Stevens-Johnson-Syndrom [SJS] und toxische epidermale Nekrolyse [TEN]) kommen, die einen Therapieabbruch erfordern. Nebenwirkungen, die häufiger (≥ 2-fach) bei Kindern als bei Erwachsenen in kontrollierten Doppelblindstudien berichtet wurden, umfassen:
- Verminderter oder erhöhter Appetit
- Hyperchlorämische Azidose
- Hypokaliämie
- Anormales Verhalten
- Aggression
- Apathie
- Einschlafstörung
- Suizidgedanken
- Aufmerksamkeitsstörung
- Lethargie
- Störung des zirkadianen Schlafrhythmus
- Schlechte Schlafqualität
- Erhöhter Tränenfluss
- Sinusbradykardie
- Anormales Gefühl
- Gangstörung
Nebenwirkungen, die bei Kindern aber nicht bei Erwachsenen in kontrollierten Doppelblindstudien berichtet wurden, umfassen:
- Eosinophilie
- Psychomotorische Hyperaktivität
- Vertigo
- Erbrechen
- Hyperthermie
- Pyrexie
- Lernschwierigkeiten
Wechselwirkungen
Antiepileptika
Antiepileptika können miteinander wechselwirken, weshalb das Risiko von Wechselwirkungen in Kombinationstherapien in jedem Fall berücksichtigt werden muss.
Topiramat kann dabei Einfluss auf andere Antiepileptika nehmen:
- Der Zusatz von Topiramat zu anderen Antiepileptika (Phenytoin, Carbamazepin, Valproinsäure, Phenobarbital, Primidon) hat keine Auswirkung auf deren Steady-State-Plasmakonzentrationen, außer bei vereinzelten Patienten, bei denen der Zusatz von Topiramat zu Phenytoin in einem der Plasmakonzentration von Phenytoin resultieren kann.
- Dies ist möglicherweise auf die Inhibition eines spezifischen polymorphen Isoenzyms zurückzuführen (CYP2C19).
- Als Konsequenz sollen die Phenytoin-Spiegel bei jedem Patienten unter Phenytoin, der klinische Zeichen oder Symptome von Toxizität aufweist, überwacht werden.
Andere Antikonvulsiva können wiederum Einfluss auf Topiramat nehmen:
- Phenytoin und Carbamazepin reduzieren die Plasmakonzentration von Topiramat.
- Die Zugabe oder das Absetzen von Phenytoin oder Carbamazepin zur
Topiramat-Therapie kann eine Anpassung der Topiramat-Dosis erfordern (dies sollte durch Titration bis zur klinischen Wirksamkeit erfolgen).
- Die gleichzeitige Anwendung von Topiramat und Valproinsäure wurde mit einer Hyperammonämie mit oder ohne Enzephalopathie bei Patienten, die eines der beiden Arzneimittel alleine toleriert haben, in Verbindung gebracht (die Nebenwirkung beruht nicht auf einer pharmakokinetischen Interaktion und in den meisten Fällen klingen die Symptome und Anzeichen mit dem Absetzen eines der beiden Arzneimittel ab).
- Hypothermie, definiert als ein unwillkürliches Sinken der Körpertemperatur auf < 35 °C, wurde im Zusammenhang mit der gleichzeitigen Anwendung von Topiramat und Valproinsäure, sowohl in Verbindung mit als auch ohne Hyperammonämie, berichtet (dieses unerwünschte Ereignis bei Patienten, die gleichzeitig Topiramat und Valproinsäure einnehmen, kann nach Beginn der Behandlung mit Topiramat oder nach Erhöhung der Tagesdosis von Topiramat auftreten).
CYP2C19
Topiramat hemmt das Enzym CYP2C19 und kann mit anderen Wirkstoffen interferieren, die durch dieses Enzym metabolisiert werden (z.B. Diazepam, Imipramin, Moclobemid, Proguanil, Omeprazol).
Weitere Arzneimittelwechselwirkungen
Potenzielle Wechselwirkungen sind auch bei gleichzeitiger Einnahme dieser Wirkstoffe in Betracht zu ziehen:
- Digoxin: In einer Einzeldosisstudie sank die AUC des Serum-
Digoxins um 12% aufgrund der begleitenden Einnahme von Topiramat. Die klinische Relevanz dieser Beobachtung konnte nicht festgestellt werden. Wenn Topiramat bei Patienten unter einer Digoxin-Therapie hinzugegeben oder abgesetzt wird, sollte die routinemäßige Überwachung des Serum-Digoxins sorgfältig durchgeführt werden.
- Orale Kontrazeptiva: In einer Studie war die Exposition von EE bei Dosen von 200, 400 und 800 mg/Tag statistisch signifikant vermindert (18%, 21% bzw. 30%), wenn Topiramat als Zusatztherapie bei Patienten, die Valproinsäure einnehmen, gegeben wurde. Obwohl eine dosisabhängige Verminderung der EE-Exposition bei Dosen zwischen 200-800 mg/Tag (bei Epilepsiepatienten) auftrat, gab es keine dosisabhängige signifikante Änderung in der EE-Exposition bei Dosen von 50-200 mg/Tag (bei gesunden Probanden). Die klinische Signifikanz dieser beobachteten Änderungen ist nicht bekannt. Die Möglichkeit einer verminderten kontrazeptiven Wirksamkeit und vermehrter Durchbruchblutungen sollte bei Patienten, die orale kontrazeptive Kombinationsprodukte mit Topiramat einnehmen, berücksichtigt werden.
Patienten, die estrogenhaltige Kontrazeptiva einnehmen, sollten aufgefordert werden, jede Änderung ihrer Menstruationsblutung zu berichten. Die kontrazeptive Wirksamkeit kann auch bei Abwesenheit vonDurchbruchblutungen vermindert sein.
- Lithium: Bei gesunden Probanden wurde eine Reduktion der systemischen Lithium-Exposition (18% der AUC) während der gleichzeitigen Verabreichung von Topiramat 200 mg/Tag beobachtet. Bei Patienten mit bipolaren Störungen wurde die Pharmakokinetik von Lithium während der Behandlung mit Topiramat bei Dosen von 200 mg/Tag nicht beeinflusst, wobei jedoch ein Anstieg in der systemischen Exposition (26% der AUC) nach Topiramat Dosen bis zu 600 mg/Tag beobachtet wurde. Die Lithiumspiegel sollten bei gleichzeitiger Gabe mit
Topiramat überwacht werden.
- Risperidon: Wenn zu einer bestehenden Behandlung mit Risperidon (1-6 mg/Tag) zusätzlich Topiramat gegeben wurde, wurde häufiger über unerwünschte Ereignisse berichtet als vor der Topiramat-Einleitung (250-400 mg/Tag) (entsprechend 90% und 54%). Die am häufigsten berichteten unerwünschten Ereignisse nach Topiramat-Einleitung, wenn es zusätzlich zu einer Risperidon-Behandlung gegeben wurde, waren: Somnolenz (27% und 12%), Parästhesie (22% und 0%) und Übelkeit (18% und 9%).
- Hydrochlorothiazid (HCT): Die Ergebnisse einer Studie zeigen, dass die Topiramat cmax um 27% und die AUC um 29% anstieg, wenn HCT zu Topiramat gegeben wurde. Die klinische Bedeutung dieser Änderung ist unbekannt. Die Zugabe von HCT zur Topiramat-Therapie kann eine Anpassung der Topiramat-Dosis erfordern. Die Pharmakokinetik von HCT im Steady State wurde durch die gleichzeitige Verabreichung von Topiramat nicht signifikant beeinflusst. Klinische Laborergebnisse zeigen einen Abfall des Serumkaliums nach Topiramat oder HCT Verabreichung, der höher war, wenn HCT und Topiramat in Kombination verabreicht wurden.
- Antidiabetika: Arzneimittelwechselwirkungsstudien mit Metformin, Glibenclamid oder Pioglitazon zeigen bei gleichzeitiger Gabe von Topiramat Einfluss des Antikonvulsivums auf die Pharmakokinetik dieser Antidiabetika. Wenn Topiramat zur Therapie der Antidiabetika hinzugegeben oder diese zur Topiramat-Therapie hinzugegeben werden, sollte besonderes Augenmerk auf die Routineüberwachung von Patienten zur adäquaten Kontrolle ihrer diabetischen Erkrankung gelegt werden.
- Arzneimittel, die für eine Nephrolithiasis prädisponieren: Topiramat kann das Risiko für eine Nephrolithiasis erhöhen, wenn es begleitend mit anderen Substanzen angewendet wird, die eine Nephrolithiasis prädisponieren. Während der Einnahme von Topiramat sollten solche Substanzen vermieden werden, da sie eine physiologische Umgebung erzeugen können, die das Risiko der Bildung von Nierensteinen erhöht.
- Warfarin: Bei mit Topiramat in Kombination mit Warfarin behandelten Patienten wurde über eine verkürzte Prothrombinzeit (PT)/International Normalized Ratio (INR) berichtet. Daher sollte bei Patienten, die gleichzeitig mit Topiramat und Warfarin behandelt werden, die INR sorgfältig überwacht werden.
Kontraindikationen
Topiramat ist kontraindiziert bei:
- Überempfindlichkeit gegen den Wirkstoff oder sonstige Bestandteile des Arzneimittels
- Prophylaxe von Migräne-Kopfschmerzen in der Schwangerschaft oder bei Frauen im gebärfähigen Alter, die keine hochwirksame Verhütungsmethode anwenden.
Schwangerschaft
Allgemeines Risiko im Zusammenhang mit Antiepileptika und Epilepsie
- Frauen im gebärfähigen Alter sollen eine fachkundige Beratung erhalten.
- Sobald eine Frau eine Schwangerschaft plant, soll die Notwendigkeit einer Behandlung mit Antiepileptika überprüft werden.
- Bei Frauen, die wegen einer Epilepsie behandelt werden, soll ein plötzliches Absetzen der Antiepileptika-Therapie vermieden werden, da dies zu Durchbruchsanfällen führen und schwerwiegende Folgen für die Mutter und das ungeborene Kind haben kann.
- Wann immer es möglich ist, soll eine Monotherapie bevorzugt werden, da die Therapie mit verschiedenen Antiepileptika gegenüber einer Monotherapie mit einem höheren Risiko für kongenitale Fehlbildungen in Zusammenhang gebracht werden kann, abhängig von den angewendeten Antiepileptika.
Risiko im Zusammenhang mit Topiramat
- Topiramat ist bei Mäusen, Ratten und Kaninchen teratogen.
- Beim Menschen passiert Topiramat die Plazenta (im Nabelschnurblut und im Maternalblut wurden vergleichbare Konzentrationen beschrieben).
- Klinische Daten aus Schwangerschaftsregistern weisen darauf hin, dass für Säuglinge, die einer Monotherapie mit Topiramat ausgesetzt waren, ein erhöhtes Risiko für kongenitale Fehlbildungen (vor allem für Lippenspalte/Gaumenspalte, Hypospadien und Anomalien, die verschiedene Körpersysteme einschließen) in Folge der Exposition während des ersten Trimesters besteht.
- Das Nordamerikanische (North American Antiepileptic Drug) Schwangerschaftsregister zeigte für die Monotherapie mit Topiramat eineungefähr 3-fach höhere Prävalenz für schwerwiegende kongenitale Fehlbildungen (4,3%) im Vergleich zu einer Referenzgruppe, die keine Antiepileptika eingenommen hat (1,4%).
- Des Weiteren weisen die Daten aus anderen Studien darauf hin, dass, verglichen mit der Monotherapie, die Anwendung von Antiepileptika in einer Kombinationstherapie mit einem erhöhten Risiko für teratogene Effekte verbunden ist.
- Berichten zufolge ist das Risiko dosisabhängig, wobei die Effekte bei allen Dosen beobachtet wurden.
- Bei mit Topiramat behandelten Frauen, die ein Kind mit einer kongenitalen Fehlbildung zur Welt gebracht haben, scheint das Risiko für Fehlbildungen in späteren Schwangerschaften bei Topiramat-Exposition erhöht zu sein.
- Eine höhere Prävalenz für ein geringes Geburtsgewicht (< 2.500 g) verglichen mit der Referenzgruppe besteht.
- Eine erhöhte Prävalenz für ihr Gestationsalter zu kleine oder zu leichte Neugeborene (SGA, Small for Gestational Age; definiert als Geburtsgewicht unter dem 10. Perzentil nach Berichtigung gemäß des Gestationsalters und stratifiziert nach Geschlecht) besteht (die Langzeitauswirkungen der SGA-Befunde konnten nicht bestimmt werden).
Indikation Epilepsie
- Es wird empfohlen, bei Frauen im gebärfähigen Alter alternative therapeutische Optionen in Betracht zu ziehen.
- Wenn Topiramat von Frauen im gebärfähigen Alter eingenommen wird, wird die Anwendung einer hochwirksamen Verhütungsmethode und eine vollständige Aufklärung über die bekannten Risiken einer unbehandelten Epilepsie für die Schwangerschaft und die potenziellen Risiken des Arzneimittels für den Fetus empfohlen.
- Wenn eine Frau eine Schwangerschaft plant, wird vorab eine Untersuchung zur Neubewertung der Behandlung und zur Berücksichtigung anderer therapeutischer Optionen empfohlen.
- Im Falle einer Einnahme während des ersten Trimesters soll eine sorgfältige pränatale Überwachung erfolgen.
Indikation Migräneprophylaxe
- Topiramat ist während der Schwangerschaft und bei Frauen im gebärfähigen Alter, die keine hochwirksame Verhütungsmethode anwenden, kontraindiziert.
Stillzeit
- Tierexperimentelle Studien haben eine Exkretion von Topiramat in die Milch gezeigt.
- Die Exkretion von Topiramat in die humane Milch wurde in kontrollierten Studien nicht untersucht.
- Begrenzte Beobachtungen bei Patientinnen weisen auf eine erhebliche Exkretion von Topiramat in die Muttermilch hin.
- Zu den Auswirkungen, die bei gestillten Neugeborenen/Kindern von behandelten Frauen beobachtet wurden, gehören Diarrhö, Schläfrigkeit, Erregbarkeit und unzureichende Gewichtszunahme.
- Aus diesem Grund muss unter Berücksichtigung der Vorteile des Stillens für das Kind und des Nutzens einer Topiramat- Behandlung für die Mutter eine Entscheidung getroffen werden, ob das Stillen zu unterbrechen ist oder ob auf die Behandlung mit Topiramat verzichtet werden soll bzw. die Behandlung mit Topiramat zu unterbrechen ist.
Verkehrstüchtigkeit
- Topiramat hat einen geringfügigen oder mäßigen Einfluss auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen.
- Topiramat wirkt auf das zentrale Nervensystem und kann zu Benommenheit, Schwindel und anderen verwandten Symptomen führen.
- Zusätzlich kann Topiramat auch Sehstörungen und/oder Verschwommensehen verursachen.
- Diese Nebenwirkungen können bei Patienten, die ein Fahrzeug führen oder Maschinen bedienen, potenziell gefährlich sein, besonders bis zu dem Zeitpunkt, an dem der individuelle Patient Erfahrung mit dem Arzneimittel gesammelt hat.
Anwendungshinweise
Anfallshäufigkeit
- Wie bei anderen Antiepileptika kann es bei Behandlung mit Topiramat bei manchen Patienten zu einer erhöhten Anfallshäufigkeit oder Auftreten neuer Arten von Krampfanfällen kommen.
- Dieses Phänomen kann die Folge von Überdosierung, verringerten Plasmakonzentrationen gleichzeitig verabreichter Antiepileptika, Fortschreiten der Erkrankung oder ein paradoxer Effekt sein.
Flüssigkeitszufuhr
- Eine adäquate Flüssigkeitszufuhr während der Anwendung von Topiramat ist sehr wichtig.
- Die Flüssigkeitszufuhr kann das Risiko einer Nephrolithiasis reduzieren.
- Eine angemessene Flüssigkeitszufuhr vor und während Aktivitäten wie z.B. körperlichen Aktivitäten oder Wärmeexposition kann das Risiko von hitzebezogenen Nebenwirkungen reduzieren.
Nephrolithiasis
- Einige Patienten, besonders diejenigen mit einer Prädisposition zur Nephrolithiasis, können ein erhöhtes Risiko für Nierensteine und damit assoziierten Zeichen und Symptomen, wie z.B. Nierenkolik, Nierenschmerzen oder Flankenschmerzen, aufweisen.
- Risikofaktoren für eine Nephrolithiasis schließen vorherige Nierensteine sowie Nephrolithiasis und Hyperkalziurie in der Familienanamnese ein.
- Keiner dieser Risikofaktoren kann verlässlich Nierensteine während der Topiramat-Behandlung prognostizieren.
- Des Weiteren können Patienten, die andere mit Nephrolithiasis assoziierte Arzneimittel einnehmen, ein erhöhtes Risiko aufweisen.
Frauen im gebärfähigen Alter
- Wird Topiramat bei schwangeren Frauen angewendet, kann dies möglicherweise zu einer Schädigung des Fetus und einer fetalen Wachstumsrestriktion (zu klein für das Gestationsalter und geringes Geburtsgewicht) führen.
- Das Nordamerikanische (North American Antiepileptic Drug) Schwangerschaftsregister zeigte für die Monotherapie mit Topiramat eine ungefähr 3-fach höhere Prävalenz für schwerwiegende kongenitale Fehlbildungen (4,3%) im Vergleich zu einer Referenzgruppe, die keine Antiepileptika eingenommen hat (1,4%).
- Die Daten aus anderen Studien weisen zusätzlich darauf hin, dass, verglichen mit der Monotherapie, die Anwendung von Antiepileptika in einer Kombinationstherapie mit einem erhöhten Risiko für teratogene Effekte verbunden ist.
- Vor dem Beginn der Behandlung mit Topiramat ist bei Frauen im gebärfähigen Alter ein Schwangerschaftstest durchzuführen.
- Darüber hinaus ist die Patientin in Hinblick auf eine hochwirksame Verhütungsmethode zu beraten.
- Die Patientin muss in vollem Umfang über die Risiken in Zusammenhang mit der Anwendung von Topiramat während der Schwangerschaft aufgeklärt werden.
Oligohidrose
- Im Zusammenhang mit der Anwendung von Topiramat wurde über Oligohidrose (vermindertes Schwitzen) berichtet.
- Vermindertes Schwitzen und Hyperthermie (Anstieg der Körpertemperatur) können insbesondere bei kleinen Kindern auftreten, die einer hohen Umgebungstemperatur ausgesetzt sind.
Stimmungsschwankungen und Suizidgedanken
- Eine erhöhte Inzidenz von Stimmungsschwankungen und Depression wurde während der Topiramat-Behandlung beobachtet.
- Über suizidale Gedanken und suizidales Verhalten wurde bei Patienten, die mit Antiepileptika in verschiedenen Indikationen behandelt wurden, berichtet.
- Eine Metaanalyse randomisierter, placebokontrollierter Studien mit Antiepileptika zeigte auch ein leicht erhöhtes Risiko für das Auftreten von Suizidgedanken und suizidalem Verhalten.
- Der Mechanismus für die Auslösung dieser Nebenwirkung ist nicht bekannt und die verfügbaren Daten schließen die Möglichkeit eines erhöhten Risikos bei der Einnahme von Topiramat nicht aus.
- In doppelblinden klinischen Studien traten suizidbezogene Ereignisse (Suizidgedanken, Suizidversuche und Suizide) bei mit Topiramat behandelten Patienten mit einer Häufigkeit von 0,5% (46 von 8.652 behandelten Patienten) und einer nahezu 3-mal höheren Inzidenz als bei den mit Placebo behandelten Patienten (0,2%; 8 von 4.045 behandelten Patienten) auf.
- Deshalb sollten Patienten hinsichtlich Anzeichen von Suizidgedanken und suizidalen Verhaltensweisen überwacht und eine geeignete Behandlung in Erwägung gezogen werden.
- Patienten (und deren Betreuern) sollte geraten werden, medizinische Hilfe einzuholen, wenn Anzeichen für Suizidgedanken oder suizidales Verhalten auftreten.
Schwerwiegende Hautreaktionen
- Bei Patienten, die Topiramat erhalten, wurde von schwerwiegenden Hautreaktionen (Stevens-Johnson- Syndrom [SJS] und toxische epidermale Nekrolyse [TEN]) berichtet.
- Es wird empfohlen, Patienten über die Anzeichen von schwerwiegenden
Hautreaktionen zu informieren.
- Wenn ein SJS oder eine TEN vermutet wird, sollte die Einnahme von Topiramat beendet werden.
Ophthalmologische Komplikationen
- Über ein Syndrom bestehend aus akuter Myopie assoziiert mit sekundärem Engwinkelglaukom wurde bei Patienten, die Topiramat erhielten, berichtet.
- Die Symptome beinhalten das akute Auftreten einer verminderten Sehschärfe und/oder Augenschmerzen.
- Ophthalmologische Befunde können Myopie, eine Einengung der vorderen Augenkammer, okuläre Hyperämie (Rötung) und einen erhöhten intraokulären Druck einschließen (Mydriasis kann oder kann nicht vorliegen).
- Das Syndrom kann mit einem supraziliären Erguss assoziiert sein, der in einer Vorverlagerung der Linse und der Iris mit einem sekundären Engwinkelglaukom resultiert.
- Die Symptome treten üblicherweise im ersten Monat nach Beginn der Topiramat-Therapie auf.
- Im Gegensatz zu dem primären Engwinkelglaukom, das selten in einem Alter unter 40 Jahren auftritt, wurde das sekundäre, mit Topiramat assoziierte Engwinkelglaukom sowohl bei pädiatrischen Patienten als auch bei Erwachsenen berichtet.
- Die Behandlung umfasst das nach Ermessen des behandelnden Arztes schnellstmögliche Absetzen von Topiramat und geeignete Maßnahmen, um den intraokulären Druck zu reduzieren.
- Im Allgemeinen resultieren diese Maßnahmen in einem Abfall des intraokulären Druckes.
- Bei Patienten, die Topiramat erhielten, wurde über Gesichtsfeld-Ausfälle berichtet, die von einem erhöhten intraokulären Druck unabhängig waren.
- In klinischen Studien waren die meisten dieser Fälle nach Absetzen von Topiramat reversibel.
- Wenn zu irgendeinem Zeitpunkt der Behandlung mit Topiramat Gesichtsfeld-Ausfälle auftreten, soll in Erwägung gezogen werden, das Arzneimittel abzusetzen.
Metabolische Azidose
- Die hyperchlorämische, metabolische Azidose ohne Anionenlücke (d.h. das Absinken des Serum-Bicarbonats unter den normalen Referenzbereich in Abwesenheit einer respiratorischen Alkalose) wird mit einer Topiramat-Behandlung in Verbindung gebracht.
- Dieses Absinken des Serum-Bicarbonats beruht auf der inhibitorischen Wirkung von Topiramat auf die renale Carboanhydrase.
- Im Allgemeinen tritt dieser Abfall des Bicarbonats zu Beginn der Behandlung auf, obwohl er zu jedem Zeitpunkt der Behandlung auftreten kann.
- Der Abfall ist in der Regel gering bis mäßig (durchschnittliches Absinken von 4 mmol/l bei Dosen von 100 mg/Tag oder darüber bei Erwachsenen bzw. von durchschnittlich 6 mg/kg/Tag bei pädiatrischen Patienten).
- Selten erlebten Patienten Abfälle auf Werte unter 10 mmol/l.
- Umstände oder Therapien, die eine Azidose prädisponieren (wie z.B. Nierenerkrankungen, schwere respiratorische Erkrankungen, Status epilepticus, Diarrhö, chirurgische Eingriffe, ketogene Diät oder bestimmte Arzneimittel) können additiv zu dem Bicarbonat-senkenden Effekt von Topiramat wirken.
- Chronische, unbehandelte metabolische Azidose erhöht das Risiko für eine Nephrolithiasis und Nephrokalzinose und kann möglicherweise zu Osteopenie führen.
- Chronische metabolische Azidose bei pädiatrischen Patienten kann die Wachstumsraten reduzieren.
- Die Auswirkungen von Topiramat auf knochenbezogene Folgeerkrankungen wurden nicht systematisch bei pädiatrischen oder erwachsenen Patienten untersucht.
- Abhängig von den zugrundeliegenden Umständen, wird unter der Topiramat-Behandlung eine geeignete Bewertung einschließlich des Serum-Bicarbonat-Spiegels empfohlen. Wenn sich Anzeichen oder Symptome (z.B. Kussmaul-Atmung, Dyspnoe, Anorexie, Übelkeit, Erbrechen, übermäßige Müdigkeit, Tachykardie oder Arrhythmie) zeigen, die auf eine metabolische Azidose hinweisen, wird eine Bestimmung des Serum-Bicarbonats empfohlen.
- Wenn sich eine metabolische Azidose entwickelt und persistiert, sollte in Erwägung gezogen werden, die Dosis zu reduzieren oder Topiramat abzusetzen (durch schrittweise Dosisreduktion).
Bei Patienten mit Voraussetzungen oder Behandlungen, die ein Risiko für das Auftreten einer metabolischen Azidose darstellen, sollte Topiramat mit Vorsicht angewandt werden.
Kognitive Beeinträchtigung
- Eine kognitive Beeinträchtigung bei einer Epilepsie ist multifaktoriell bedingt und kann durch die zugrundeliegende Krankheitsursache, durch die Epilepsie oder durch die antiepileptische Behandlung verursacht werden.
- Es gibt Berichte in der Literatur über die Beeinträchtigung der kognitiven Funktion bei Erwachsenen unter einer Topiramat-Behandlung, die eine Reduktion der Dosierung oder eine Beendigung der Behandlung erforderten.
- Studien hinsichtlich der Auswirkung auf die Kognition bei Kindern, die mit Topiramat behandelt wurden, sind jedoch unzureichend und der Einfluss des Wirkstoffes diesbezüglich muss noch geklärt werden.
Hyperammonämie und Enzephalopathie
- Über Hyperammonämie mit oder ohne Enzephalopathie wurde im Zusammenhang mit einer Topiramat-Behandlung berichtet.
- Das Risiko für eine Hyperammonämie unter Topiramat scheint dosisabhängig zu sein.
- Über eine Hyperammonämie wurde häufiger berichtet, wenn Topiramat zusammen mit Valproinsäure eingenommen wurde.
- Bei Patienten, die eine nicht zu erklärende Lethargie oder Veränderungen des mentalen Zustands im Zusammenhang mit einer Topiramat-Monotherapie oder -Zusatztherapie entwickeln, wird empfohlen, eine hyperammonämische Enzephalopathie in Betracht zu ziehen und die Ammoniakspiegel zu messen.
Gewichtsverlust
- Manche Patienten können während der Behandlung mit Topiramat einen Gewichtsverlust erleiden.
- Es wird empfohlen, dass Patienten unter der Behandlung mit Topiramat auf Gewichtsverlust kontrolliert werden sollten.
- Eine diätetische Ergänzung oder gesteigerte Nahrungsaufnahme können erwogen werden, wenn der Patient unter Topiramat Gewicht verliert.
Alternativen
Die Pharmakotherapie von Epilepsien bzw. epileptischen Anfällen bietet ein breites Spektrum an alternativen antikonvulsiven Wirkstoffen:
- Benzodiazepine wie Midazolam, Clobazam und Clonazepam
- Carbamazepin, Oxcarbazepin
- Ethosuximid, Mesuximid
- Felbamat
- Gabapentin, Pregabalin
- Lacosamid
- Levetiracetam, Brivaracetam
- Lamotrigin
- Perampanel
- Phenobarbital
- Phenytoin
- Piracetam
- Primidon
- Rufinamid
- Stiripentol
- Sultiam
- Valproinsäure
- Vigabatrin
- Zonisamid
Zur Migräneprophylaxe stehen diese evidenzbasierten alternativen Wirkstoffe zur Verfügung:
- Betablocker wie Propranolol, Bisoprolol und Metoprolol
- Flunarizin
- Valproinsäure
- Amitriptylin
- OnabotulinumtoxinA (chronische Migräne)
Weitere Informationen sind der jeweiligen Fachinformation zu entnehmen.
Wirkstoff-Informationen
- Glenmark: Fachinformation
- Freissmuth et al., Pharmakologie und Toxikologie, 2020, Springer
- Mutschler et al., Mutschler Arzneimittelwirkungen, 2019, Wissenschaftliche Verlagsgesellschaft Stuttgart
-
Topamax® 25 mg Filmtabletten
Janssen-Cilag GmbH
-
Topamax® 25 mg Hartkapseln
Janssen-Cilag GmbH
-
Topamax 25 mg kohlpharma Filmtabletten
kohlpharma GmbH
-
Topamax® 50 mg Filmtabletten
Janssen-Cilag GmbH
-
Topamax® 50 mg Hartkapseln
Janssen-Cilag GmbH
-
Topamax 50 mg kohlpharma Filmtabletten
kohlpharma GmbH
-
Topamax® 100 mg Filmtabletten
Janssen-Cilag GmbH
-
Topamax 100 mg kohlpharma Filmtabletten
kohlpharma GmbH
-
Topamax® 200 mg Filmtabletten
Janssen-Cilag GmbH
-
Topamax 200 mg kohlpharma Filmtabletten
kohlpharma GmbH
-
Topiramat - 1 A Pharma® 25 mg Filmtabletten
1 A Pharma GmbH
-
Topiramat - 1 A Pharma® 50 mg Filmtabletten
1 A Pharma GmbH
-
Topiramat - 1 A Pharma® 100 mg Filmtabletten
1 A Pharma GmbH
-
Topiramat - 1 A Pharma® 200 mg Filmtabletten
1 A Pharma GmbH
-
Topiramat AL 25 mg Filmtabletten
ALIUD PHARMA® GmbH
-
Topiramat AL 50 mg Filmtabletten
ALIUD PHARMA® GmbH
-
Topiramat AL 100 mg Filmtabletten
ALIUD PHARMA® GmbH
-
Topiramat AL 200 mg Filmtabletten
ALIUD PHARMA® GmbH
-
Topiramat AL Migräne 25 mg Filmtabletten
ALIUD PHARMA® GmbH
-
Topiramat AL Migräne 50 mg Filmtabletten
ALIUD PHARMA® GmbH
-
Topiramat Aurobindo 25 mg Filmtabletten
PUREN Pharma GmbH & Co. KG
-
Topiramat Aurobindo 50 mg Filmtabletten
PUREN Pharma GmbH & Co. KG
-
Topiramat Aurobindo 100 mg Filmtabletten
PUREN Pharma GmbH & Co. KG
-
Topiramat Aurobindo 200 mg Filmtabletten
PUREN Pharma GmbH & Co. KG
-
Topiramat Glenmark 25 mg Filmtabletten
Glenmark Arzneimittel GmbH
-
Topiramat Glenmark 50 mg Filmtabletten
Glenmark Arzneimittel GmbH
-
Topiramat Glenmark 100 mg Filmtabletten
Glenmark Arzneimittel GmbH
-
Topiramat Glenmark 200 mg Filmtabletten
Glenmark Arzneimittel GmbH
-
Topiramat Heumann 25 mg Filmtabletten
Heumann Pharma GmbH & Co. Generica KG
-
Topiramat Heumann 50 mg Filmtabletten
Heumann Pharma GmbH & Co. Generica KG
-
Topiramat Heumann 100 mg Filmtabletten
Heumann Pharma GmbH & Co. Generica KG
-
Topiramat Heumann 200 mg Filmtabletten
Heumann Pharma GmbH & Co. Generica KG
-
Topiramat HEXAL® 25 mg Filmtabletten
Hexal AG
-
Topiramat HEXAL® 50 mg Filmtabletten
Hexal AG
-
Topiramat HEXAL® 100 mg Filmtabletten
Hexal AG
-
Topiramat HEXAL® 200 mg Filmtabletten
Hexal AG
-
Topiramat-Hormosan 25 mg Filmtabletten
Hormosan Pharma GmbH
-
Topiramat-Hormosan 50 mg Filmtabletten
Hormosan Pharma GmbH
-
Topiramat-Hormosan 100 mg Filmtabletten
Hormosan Pharma GmbH
-
Topiramat-Hormosan 200 mg Filmtabletten
Hormosan Pharma GmbH
-
Topiramat Migräne STADA® 25 mg Filmtabletten
STADAPHARM GmbH
-
Topiramat Migräne STADA® 50 mg Filmtabletten
STADAPHARM GmbH
-
Topiramat Migräne STADA® 100 mg Filmtabletten
STADAPHARM GmbH
-
Topiramat PUREN 25 mg Filmtabletten
PUREN Pharma GmbH & Co. KG
-
Topiramat PUREN 50 mg Filmtabletten
PUREN Pharma GmbH & Co. KG
-
Topiramat PUREN 100 mg Filmtabletten
PUREN Pharma GmbH & Co. KG
-
Topiramat PUREN 200 mg Filmtabletten
PUREN Pharma GmbH & Co. KG
-
Topiramat-ratiopharm® 25 mg Filmtabletten
ratiopharm GmbH
-
Topiramat-ratiopharm® 50 mg Filmtabletten
ratiopharm GmbH
-
Topiramat-ratiopharm® 100 mg Filmtabletten
ratiopharm GmbH













