Ustekinumab
Ustekinumab ist ein humaner monoklonaler Antikörper, der gegen Entzündungsreaktionen im Körper wirkt und zur Behandlung von Plaque-Psoriasis, psoriatischer Arthritis und Morbus Crohn zugelassen ist. Studien zeigen auch eine Wirksamkeit bei systemischem Lupus erythematodes. Das Biological bindet an freies Interleukin IL-12 und IL-23 und hemmt so eine Entzündungsantwort.
Ustekinumab: Übersicht
Anwendung
Ustekinumab ist indiziert für die Behandlung von:
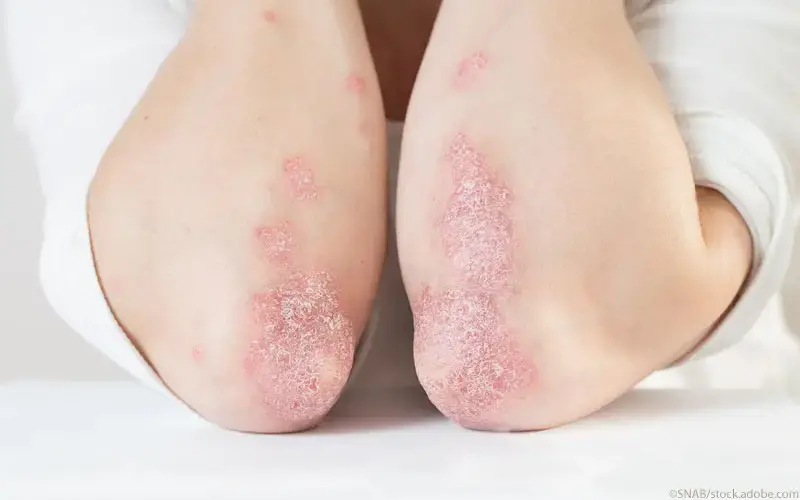
- Plaque-Psoriasis, wenn andere systemische Therapien einschließlich Ciclosporin, Methotrexat oder PUVA (Psoralen und Ultraviolett A) nicht angesprochen haben, kontraindiziert sind oder nicht vertragen wurden
- psoriatischer Arthritis, wenn das Ansprechen auf eine vorherige nicht-biologische krankheitsmodifizierende antirheumatische (DMARD-) Therapie unzureichend gewesen ist
- Morbus Crohn, wenn das Ansprechen auf eine konventionelle Therapie oder einen Tumornekrosefaktor-alpha (TNFα)-Antagonisten unzureichend war, oder die Patienten nicht mehr darauf ansprechen oder eine Unverträglichkeit oder eine Kontraindikation gegen eine entsprechende Behandlung vorliegt.
Anwendungsart
Ustekinumab ist in Form einer Injektionslösung in einer Fertigspritze und als Konzentrat zur Herstellung einer Infusionslösung auf dem deutschen Markt zugelassen. Nach einer Schulung in subkutaner Injektionstechnik können sich Patienten Ustekinumab selbst injizieren, wenn der behandelnde Arzt dies für angebracht hält.
Wirkmechanismus
Ustekinumab ist ein humaner, monoklonaler Antikörper, der die beiden Interleukine IL-12 und IL-23 in ihrer Funktion hemmt. Das Biological bindet hierzu an die p40 Untereinheit der Interleukine, wodurch diese nicht mehr an ihre Rezeptoren auf der Oberfläche von Immunzellen binden können und so die Entzündungsreaktion ausbleibt. IL-12 und IL-23 sind heterodimere Zytokine, die von aktivierten Antigen-präsentierenden Zellen, wie Makrophagen und dendritischen Zellen, sezerniert werden. IL-12 stimuliert natürliche Killerzellen (NK) und vermittelt die Differenzierung von CD4+ T-Zellen zum Phänotyp T-Helferzelle 1 (Th1), IL-23 induziert den T-Helfer-17 (Th17)-Pfad. Eine anomale IL-12- und IL-23-Regulierung wird mit immunvermittelten Krankheiten wie Psoriasis, psoriatischer Arthritis, Morbus Crohn und Lupus erythematodes in Verbindung gebracht.
Pharmakokinetik
Resorption
Die mittlere Zeit bis zum Erreichen der maximalen Serumkonzentration (tmax) betrug bei gesunden Personen, denen eine Einzeldosis von 90 mg subkutan verabreicht wurde 8,5 Tage, was mit der Gabe an Psoriasis-Patienten vergleichbar war. Die absolute Bioverfügbarkeit von Ustekinumab nach einer einzelnen subkutanen Gabe wurde bei Patienten mit Psoriasis auf 57,2 Prozent geschätzt.
Verteilung
Das mittlere Verteilungsvolumen lag in der terminalen Phase (Vz) nach einer einzelnen intravenösen Verabreichung bei Patienten mit Psoriasis zwischen 57 und 83 ml/kg.
Biotransformation
Der genaue Stoffwechselweg von Ustekinumab ist nicht bekannt.
Elimination
Die mittlere systemische Clearance (CL) lag nach einer einzelnen intravenösen Verabreichung an Patienten mit Psoriasis zwischen 1,99 und 2,34 ml/Tag/kg. Die mittlere Halbwertszeit (t½) von Ustekinumab betrug bei Patienten mit Psoriasis, psoriatischer Arthritis oder Morbus Crohn ungefähr 3 Wochen und bewegte sich in allen Studien zu Psoriasis und psoriatischer Arthritis zwischen 15 und 32 Tagen. In einer populationspharmakokinetischen Analyse betrugen bei Patienten mit Psoriasis apparente Clearance (CL/F) und apparentes Verteilungsvolumen (V/F) 0,465 l/Tag bzw. 15,7 l. Die CL/F von Ustekinumab wurde nicht vom Geschlecht beeinflusst. Die populationspharmakokinetische Analyse zeigte, dass es einen Trend zu einer höheren Ustekinumab-Clearance bei Patienten gab, die positiv auf Ustekinumab-Antikörper getestet wurden.
Dosislinearität
Die systemische Verfügbarkeit von Ustekinumab (Cmax und AUC) erhöhte sich ungefähr dosisproportional bei Patienten mit Psoriasis nach einer einzelnen intravenösen Verabreichung von Dosen zwischen 0,09 mg/ kg und 4,5 mg/kg oder nach einer einzelnen subkutanen Verabreichung von Dosen zwischen
ungefähr 24 mg und 240 mg.
Auswirkung des Gewichts auf die Pharmakokinetik
Das Körpergewicht ist die bedeutendste Kovariable, die die Clearance von Ustekinumab beeinflusst. Die mittlere CL/F war bei Patienten mit einem Gewicht > 100 kg um ungefähr 55 Prozent höher als bei Patienten mit einem Gewicht ≤ 100 kg. Das mittlere V/F war bei Patienten mit einem Gewicht > 100 kg ungefähr 37 Prozent höher als bei Patienten mit einem Gewicht ≤ 100 kg. Die mittleren Talkonzentrationen von Ustekinumab waren bei Patienten mit höherem Gewicht (> 100 kg) in der 90-mg-Gruppe mit denen von Patienten mit einem niedrigeren Gewicht (≤ 100 kg) in der 45-mg-Gruppe vergleichbar.
Dosierung
Plaque-Psoriasis und psoriatische Arthritis
Die empfohlene Initialdosis beträgt 45 mg Ustekinumab als subkutane Injektion. 4 Wochen darauf folgt eine weitere 45 mg Dosis, danach alle 12 Wochen.
Morbus Crohn
Bei der Behandlung von Morbus Crohn mit Ustekinumab wird die erste Ustekinumab-Dosis intravenös appliziert. Die Dosierung richtet sich nach dem Körpergewicht.
| Körpergewicht des Patienten zum Zeitpunkt der Dosierung | Empfohlene Dosis |
| < 55 kg | 260 mg |
| > 55 kg < 85 kg | 390 mg |
| > 85 kg | 520 mg |
Die erste subkutane Dosis soll 8 Wochen nach der intravenösen Dosis gegeben werden. Anschließend wird eine Applikation alle 12 Wochen empfohlen.
Nebenwirkungen
Zu den häufigen Nebenwirkungen (≥ 1/100 bis < 1/10) unter der Behandlung mit Ustekinumab zählen:
- Infektion der oberen Atemwege, Nasopharyngitis
- Schwindel, Kopfschmerzen
- Oropharyngeale Schmerzen
- Diarrhö, Nausea, Erbrechen
- Pruritus
- Rückenschmerzen, Myalgie, Arthralgie
- Müdigkeit, Erythem an der Injektionsstelle, Schmerzen an der Injektionsstelle.
Wechselwirkungen
Folgende Wechselwirkungen sind bei der Anwendung von Ustekinumab zu beachten:
- Lebendimpfstoffe sollen nicht zusammen mit Ustekinumab gegeben werden.
Kontraindikation
Ustekinumab darf nicht angewendet werden bei:
- Überempfindlichkeit gegenüber dem Wirkstoff
- Klinisch relevante, aktive Infektion (z. B. aktive Tuberkulose).
Schwangerschaft/Stillzeit
Es liegen keine ausreichenden Erfahrungen mit der Anwendung von Ustekinumab in der Schwangerschaft vor. Tierexperimentelle Studien ergaben keine Hinweise auf direkte oder indirekte gesundheitsschädliche Wirkungen in Bezug auf Schwangerschaft, embryonale/fetale Entwicklung, Geburt oder postnatale Entwicklung. Aus Vorsichtsgründen ist die Anwendung während der Schwangerschaft möglichst zu vermeiden.
Es ist nicht bekannt, ob Ustekinumab beim Menschen in die Muttermilch übergeht. Tierexperimentelle Studien haben gezeigt, dass Ustekinumab in geringen Mengen in die Muttermilch übergeht. Es ist nicht bekannt, ob Ustekinumab nach der Aufnahme systemisch resorbiert wird. Aufgrund der Möglichkeit von unerwünschten Reaktionen bei gestillten Kindern muss eine Entscheidung darüber getroffen werden, ob das Stillen während und bis zu 15 Wochen nach der Behandlung zu unterbrechen ist oder ob die Behandlung mit Ustekinumab zu beenden ist. Dabei ist sowohl der Nutzen des Stillens für das Kind als auch der Nutzen der Ustekinumab-Therapie für die Frau zu berücksichtigen.
Verkehrstüchtigkeit
Ustekinumab hat keinen oder einen zu vernachlässigenden Einfluss auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen.
Weitere Informationen sind der jeweiligen Fachinformation zu entnehmen.
Anwendungshinweise
Rückverfolgbarkeit
Name und Chargenbezeichnung des verabreichten Produkts sollten deutlich protokolliert werden, um die Rückverfolgbarkeit biologischer Arzneimittel zu verbessern.
Infektionen
Ustekinumab kann unter Umständen das Risiko von Infektionen erhöhen und latente Infektionen reaktivieren. In klinischen Studien wurden bei Patienten, die Ustekinumab erhielten, schwerwiegende bakterielle Infektionen, Pilz- und Virusinfektionen beobachtet.
Maligne Tumoren
Immunsuppressiva wie Ustekinumab haben das Potenzial, das Risiko von malignen Tumoren zu erhöhen. Einige Patienten entwickelten kutane und nicht kutane maligne Tumoren unter der Behandlung mit Ustekinumab.
Überempfindlichkeitsreaktionen
Nach Markteinführung wurde über schwerwiegende Überempfindlichkeitsreaktionen berichtet, in einigen Fällen mehrere Tage nach der Behandlung. Anaphylaxie und Angioödem traten auf.
Wirkstoff-Informationen
- Lupus Science and Medicine: Ustekinumab targets a novel mechanism of action to treat patients with systemic lupus erythematosus
- Fachinformation Stelara
-
Fymskina® 45 mg Injektionslösung in einer Fertigspritze
ratiopharm GmbH
-
Fymskina® 90 mg Injektionslösung in einer Fertigspritze
ratiopharm GmbH
-
Fymskina® 130 mg Konzentrat zur Herstellung einer Infusionslösung
ratiopharm GmbH
-
Imuldosa 45 mg Abacus Injektionslösung in einer Fertigspritze
Abacus Medicine A/S
-
IMULDOSA 45 mg Injektionslösung in einer Fertigspritze
Accord Healthcare GmbH
-
Imuldosa 90 mg Abacus Injektionslösung in einer Fertigspritze
Abacus Medicine A/S
-
IMULDOSA 90 mg Injektionslösung in einer Fertigspritze
Accord Healthcare GmbH
-
IMULDOSA 130 mg Konzentrat zur Herstellung einer Infusionslösung
Accord Healthcare GmbH
-
Otulfi 45 mg Abacus Injektionslösung in einer Fertigspritze
Abacus Medicine A/S
-
Otulfi 45 mg Injektionslösung
FRESENIUS KABI Deutschland GmbH
-
Otulfi 45 mg Injektionslösung in einer Fertigspritze
FRESENIUS KABI Deutschland GmbH
-
Otulfi 45 mg Orifarm Injektionslösung in einer Fertigspritze
Orifarm GmbH
-
Otulfi 90 mg 2care4 Injektionslösung in einer Fertigspritze
2care4 ApS
-
Otulfi 90 mg Abacus Injektionslösung in einer Fertigspritze
Abacus Medicine A/S
-
Otulfi 90 mg Injektionslösung in einer Fertigspritze
FRESENIUS KABI Deutschland GmbH
-
Otulfi 90 mg kohlpharma Injektionslösung in einer Fertigspritze
kohlpharma GmbH
-
Otulfi 90 mg Orifarm Injektionslösung in einer Fertigspritze
Orifarm GmbH
-
Otulfi 90 mg Paranova Injektionslösung in einer Fertigspritze
Paranova Pack A/S
-
Otulfi 130 mg Abacus Konzentrat zur Herstellung einer Infusionslösung
Abacus Medicine A/S
-
Otulfi 130 mg Konzentrat zur Herstellung einer Infusionslösung
FRESENIUS KABI Deutschland GmbH
-
Otulfi 130 mg Orifarm Konzentrat zur Herstellung einer Infusionslösung
Orifarm GmbH
-
Pyzchiva 45 mg 101 Carefarm Injektionslösung in einer Fertigspritze
1 0 1 Carefarm GmbH
-
Pyzchiva 45 mg Aaragon Injektionslösung in einer Fertigspritze
Aaragon Pharma S.R.O.
-
Pyzchiva 45 mg Abacus Injektionslösung in einem Fertigpen
Abacus Medicine A/S
-
Pyzchiva 45 mg Abacus Injektionslösung in einer Fertigspritze
Abacus Medicine A/S
-
Pyzchiva 45 mg ACA Injektionslösung in einer Fertigspritze
A.C.A. Müller ADAG Pharma AG
-
Pyzchiva 45 mg Allomedic Injektionslösung in einem Fertigpen
Allomedic GmbH
-
Pyzchiva 45 mg Allomedic Injektionslösung in einer Fertigspritze
Allomedic GmbH
-
Pyzchiva 45 mg axicorp Injektionslösung in einer Fertigspritze
axicorp Pharma B.V.
-
Pyzchiva 45 mg CC Pharma Injektionslösung in einem Fertigpen
CC Pharma GmbH
-
Pyzchiva 45 mg CC Pharma Injektionslösung in einer Fertigspritze
CC Pharma GmbH
-
Pyzchiva 45 mg Eurim Injektionslösung in einer Fertigspritze
Eurim-Pharm Arzneimittel GmbH
-
Pyzchiva® 45 mg Injektionslösung in einem Fertigpen
Hexal AG
-
Pyzchiva® 45 mg Injektionslösung in einer Fertigspritze
Hexal AG
-
Pyzchiva 45 mg kohlpharma Injektionslösung in einer Fertigspritze
kohlpharma GmbH
-
Pyzchiva 45 mg Medicopharm Injektionslösung in einer Fertigspritze
Medicopharm AG
-
Pyzchiva 45 mg Orifarm Injektionslösung in einem Fertigpen
Orifarm GmbH
-
Pyzchiva 45 mg Orifarm Injektionslösung in einer Fertigspritze
Orifarm GmbH
-
Pyzchiva 45 mg Originalis Injektionslösung in einer Fertigspritze
Originalis B.V.
-
Pyzchiva 45 mg Paranova Injektionslösung in einem Fertigpen
Paranova Pack A/S
-
Pyzchiva 45 mg Paranova Injektionslösung in einer Fertigspritze
Paranova Pack A/S
-
Pyzchiva 90 mg 101 Carefarm Injektionslösung in einer Fertigspritze
1 0 1 Carefarm GmbH
-
Pyzchiva 90 mg Aaragon Injektionslösung in einer Fertigspritze
Aaragon Pharma S.R.O.
-
Pyzchiva 90 mg Abacus Injektionslösung in einem Fertigpen
Abacus Medicine A/S
-
Pyzchiva 90 mg Abacus Injektionslösung in einer Fertigspritze
Abacus Medicine A/S
-
Pyzchiva 90 mg ACA Injektionslösung in einer Fertigspritze
A.C.A. Müller ADAG Pharma AG
-
Pyzchiva 90 mg Allomedic Injektionslösung in einem Fertigpen
Allomedic GmbH
-
Pyzchiva 90 mg Allomedic Injektionslösung in einer Fertigspritze
Allomedic GmbH
-
Pyzchiva 90 mg axicorp Injektionslösung in einer Fertigspritze
axicorp Pharma B.V.
-
Pyzchiva 90 mg CC Pharma Injektionslösung in einem Fertigpen
CC Pharma GmbH