Ein internationales Forscherteam unter Leitung des Deutschen Zentrums für Neurodegenerative Erkrankungen (DZNE) und der Universität Bonn konnte in einer aktuellen Studie [1] das Inflammasom NLRP3 als gemeinsamen Aktivator von Amyloid beta- und Tau-Akkumulation bei Demenz vom Alzheimer-Typ und anderen neurodegenerativen Erkrankungen nachweisen.
Inflammasomen aktivieren Entzündungsreaktionen
Inflammasomen sind im Zytosol lokalisierte Multiproteinkomplexe, die zum angeborenen Immunsystem gehören. Inflammasomen setzen Entzündungsreaktionen in Gang und werden selbst durch eine Vielzahl von Stimuli aktiviert.
Das Inflammasom NLRP3 kann beispielsweise durch Harnsäurekristalle bei Gicht aktiviert werden. Mutationen im Gen CIAS1, welches für eine der Proteinkomponenten von Inflammasom NLRP3 kodiert, lösen das Syndrom NOMID (Neonatal Onset Multisystem Inflammatory Disease) bei Neugeborenen aus, das innerhalb der ersten Lebenswochen zu einer entzündlichen Systemerkrankung führt.
NLRP3 Inflammasom und Amyloid beta
Die Bonner Forscher konnten in einer früheren Studie bereits zeigen, dass das Inflammasom die Akkumulation von Amyloid beta fördern kann [2]. „Unsere Ergebnisse stützen die Amyloid-Kaskaden-Hypothese für die Entwicklung der Alzheimer-Erkrankung. Demnach führen die Ablagerungen von Aβ letztlich zur Entstehung der Tau-Pathologie und damit zum Zelltod“, sagt Professor Michael Heneka, Direktor der Klinik für Neurodegenerative Erkrankungen und Gerontopsychiatrie am Universitätsklinikum Bonn und Arbeitsgruppenleiter am DZNE [3].
Entzündungen als Verursacher der Tau-Pathologie
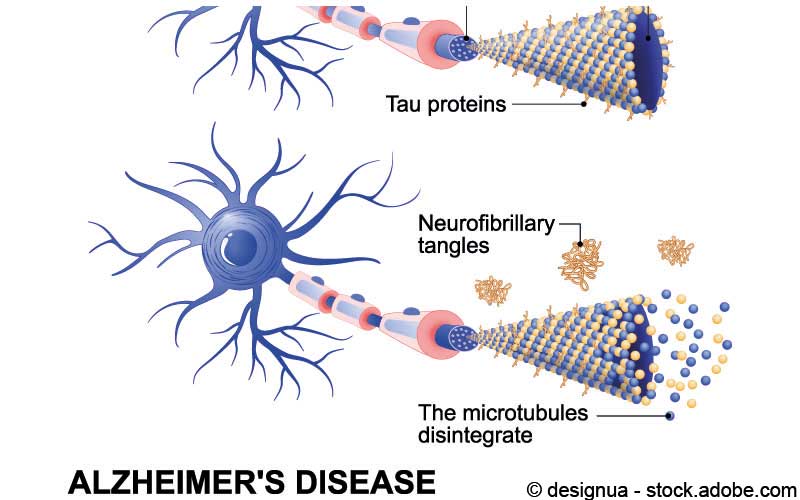
Die Ablagerung von Amyloid beta geschieht bei Alzheimer vor der Anhäufung von Tau-Proteinen. Eigentlich stabilisieren Tau-Proteine das Gerüst der Neurone. Bei Alzheimer, Frontotemporaler Demenz (FTD) und anderen Tauopathien lösen sich die Tau-Proteine vom Zytoskelett und verkleben miteinander. Wie die Forscher nun zeigen konnten, lösen Entzündungsprozesse und die damit einhergehende Aktivierung des NLRP3 Inflammasoms, dies Änderung aus.
Inflammasomen-vermittelte Entzündungen zentral bei neurodegenerativen Erkrankungen
In der aktuellen Studie untersuchten die Wissenschaftler Gewebeproben aus den Gehirnen von an FTD verstorbenen Patienten sowie Zellkulturen von Mäusen, die für Alzheimer und FTD typische Krankheitsmerkmale aufwiesen.
Das NLRP3 Inflammasom ist in Mikroglia-Zellen lokalisiert und setzt sich bei deren Aktivierung zusammen. Dieses Inflammasom beeinflusst wiederum Enzyme, die zur Hyperphosphorylierung der Tau-Proteine führen. Diese chemische Veränderung führt letztendlich dazu, dass sich die Tauproteine vom Zytoskelett ablösen und Aggregate bilden. „Offenbar sind vom Inflammasom vermittelte Entzündungsvorgänge für die meisten, wenn nicht für alle neurodegenerative Erkrankungen mit Tau-Pathologie von zentraler Bedeutung“, so Heneka.
Amyloid beta-Plaques fördern Tau-Ablagerungen
Das Inflammasom stellte sich in der Studie als Bindeglied zwischen Amyloid beta- und Tau-Ablagerungen heraus. Zunächst fördert das aktive Inflammasom die Anhäufung von Amyloid beta. Dies fördert einerseits die Entstehung weiterer Amyloid beta-Plaques. Andererseits wird durch die bestehende Aktivierung des Inflammasoms auch die Hyperphosphorylierung der Tau-Proteine induziert, so dass zusätzlich Tau-Ablagerungen entstehen. Damit spielt das Inflammasom eine entscheidende Rolle, denn es vermittelt die Entwicklung von der Amyloid beta- zur Tau-Pathologie.
Inflammasom als neuer Ansatzpunkt für Alzheimer-Therapie?
Die Forscher hoffen mit der Entschlüsselung dieses Mechanismus zur Entwicklung neuer Therapieoptionen beizutragen. Gerade die Akkumulation von Tau-Proteinen scheint die geistigen Fähigkeiten von Alzheimer-Patienten stark zu beeinträchtigen.
„Entzündungsprozesse befördern die Entwicklung der Aβ-Pathologie, und wie wir nun zeigen konnten, auch der Tau-Pathologie. Insofern hat das Inflammasom bei Alzheimer und anderen Hirnerkrankungen eine Schlüsselstellung“, informiert Heneka.