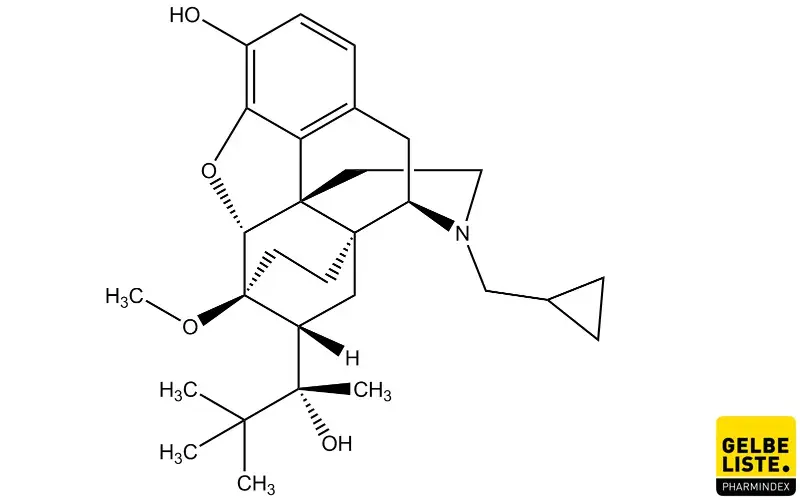
Buprenorphin
Buprenorphin ist ein Wirkstoff aus der Gruppe der Opioide, der zur Substitutionstherapie bei Opioidabhängigkeit sowie zur Schmerzlinderung bei starken Schmerzen und Tumorschmerzen indiziert ist. Buprenorphin ist in verschiedenen Darreichungsformen erhältlich.
Buprenorphin: Übersicht
Anwendung
Das Opioid Buprenorphin wird in folgenden Indikationsgebieten eingesetzt:
- Mäßig starke bis starke Tumorschmerzen und starke Schmerzen bei ungenügender Wirksamkeit nicht-opioider Schmerzmittel (nicht geeignet zur Behandlung akuter Schmerzen)
- Substitutionstherapie bei Opioidabhängigkeit im Rahmen medizinischer, sozialer und psychotherapeutischer Maßnahmen
Anwendungsart
Buprenorphin ist in unterschiedlichen Darreichungsformen erhältlich, um die effektivste Wirkung für die jeweilige Indikation zu erzielen:
- Transdermales Pflaster (35, 52,5 oder 70 µg/h für 4 Tage)
- Transdermales Pflaster (5, 10, 15 oder 20 µg/h für 7 Tage)
- Sublingualtablette (0,4, 2 oder 8 mg)
- Depot-Injektionslösung (8, 16, 24, 32, 64, 96, 128 oder 160 mg)
Für die transdermale Applikation von Buprenorphin gilt:
- Das Pflaster darf nicht geteilt oder in Teile geschnitten werden.
- Das Pflaster darf nicht verwendet werden, wenn die Versiegelung des Beutels beschädigt ist.
- Das transdermale Pflaster soll auf nicht gereizte, gereinigte, relativ unbehaarte, flache Hautpartien und nicht auf Hautstellen mit größeren Narben aufgebracht werden.
- Vorzugsweise erfolgt die Applikation am Oberkörper (auf der oberen Rückenpartie beziehungsweise unterhalb des Schlüsselbeins auf der Brust).
- Eventuell vorhandene Haare sollen nicht rasiert, sondern mit einer Schere entfernt werden.
- Falls die Applikationsstelle gereinigt werden muss, soll dies mit Wasser geschehen (dabei dürfen weder Seife noch andere Reinigungsmittel benutzt werden).
- Die Anwendung von Dermatika, die das Kleben auf der ausgewählten Hautstelle beeinträchtigen könnten, ist zu vermeiden.
- Die Haut muss vor der Applikation vollkommen trocken sein.
- Das Pflaster soll unmittelbar nach Entnahme aus dem Beutel appliziert werden.
- Nach Entfernung der Schutzfolie wird das transdermale Pflaster mit der flachen Hand ca. 30 Sekunden fest auf die gewählte Hautstelle gepresst.
- Das Pflaster wird durch Baden, Duschen oder Schwimmen nicht beeinflusst und soll kontinuierlich bis zu 4 bzw. 7 Tage getragen werden.
- Nachdem das vorangegangene transdermale Pflaster entfernt wurde, ist ein neues Pflaster an einer anderen Stelle anzubringen.
- Bevor auf dieselbe Hautstelle wieder ein neues transdermales Pflaster appliziert wird, sollte mindestens 1 Woche vergangen sein.
- Im unwahrscheinlichen Fall, dass sich das transdermale Pflaster vor dem nächsten Wechsel löst, darf dasselbe transdermale Pflaster nicht nochmals benutzt werden (es ist umgehend ein neues Pflaster aufzukleben).
Für die sublinguale Applikation von Buprenorphin gilt:
- Der Arzt muss den Patienten darüber informieren, dass die sublinguale Anwendung die einzige wirksame und sichere Art der Anwendung darstellt.
- Die Tablette wird bis zur Auflösung unter der Zunge gehalten (dies geschieht üblicherweise innerhalb von 5 bis 10 Minuten).
- Gegebenenfalls sollte zuvor die Mundschleimhaut angefeuchtet werden, um die Auflösung der Sublingualtablette zu erleichtern.
Für die Depot-Injektionslösung von Buprenorphin gilt:
- Die Depot-Injektionslösung ist nur zur subkutanen Anwendung bestimmt.
- Es sollte langsam und vollständig in das subkutane Gewebe verschiedener Bereiche (Gesäß, Oberschenkel, Bauch oder Oberarm) injiziert werden, sofern ausreichend subkutanes Gewebe vorhanden ist.
- Jeder Bereich kann mehrere Injektionsstellen aufweisen.
- Sowohl bei wöchentlichen als auch bei monatlichen Injektionen sollte eine Rotation der Injektionsstellen erfolgen.
- Es sollten mindestens 8 Wochen vor einer erneuten Injektion einer wöchentlichen Dosis in eine der zuvor verwendeten Injektionsstellen vergehen.
- Es liegen keine klinischen Daten vor, die für eine erneute Injektion der monatlichen Dosis in dieselbe Injektionsstelle sprechen (wahrscheinlich besteht kein Grund für Sicherheitsbedenken).
- Die Entscheidung, eine erneute Injektion an derselben Stelle vorzunehmen, sollte auch auf dem klinischen Urteil der behandelnden Ärzte basieren.
- Die Dosis sollte als Einzelinjektion und nicht geteilt angewendet werden.
- Die Dosis darf nicht intravaskulär (intravenös), intramuskulär oder intradermal (in die Haut) angewendet werden.
Wirkmechanismus
Buprenorphin ist der Wirkstoffklasse der Opioide zugehörig, unterscheidet sich aber im pharmakologischen Profil von anderen Opioiden. Als partieller Agonist am µ-Opioidrezeptor wirkt Buprenorphin unter anderem analgetisch, wobei die maximale analgetische Wirksamkeit von beispielsweise Morphin aufgrund des Partialagonismus auch bei weiterer Dosissteigerung nicht erreicht wird (Ceiling-Effekt).
µ-Opioidrezeptoren sind G-Protein-gekoppelte Rezeptoren (GPCR) vom Typ Gi/o, die nach Aktivierung durch (partielle) Agonisten eine Hemmung der zyklischen Adenylatzyklase bewirken, wodurch die Konzentration an zyklischem Adenosinmonophosphat (cAMP) abnimmt.
Folglich wird die nozizeptive Signalweiterleitung über diese Mechanismen inhibiert:
- Präsynaptisch: Hemmung der Transmitterfreisetzung (z.B. Glutamat) durch Reduktion der Öffnungswahrscheinlichkeit von Calciumkanälen
- Postsynaptisch: Hyperpolarisation der Neurone durch Erhöhung der Öffnungswahrscheinlichkeit von Kaliumkanälen (K+-Ausstrom)
Die Wirksamkeit in der Substitutionstherapie beruht auf der langsamen und reversiblen Bindung von Buprenorphin an µ-Opioidrezeptoren im Zentralnervensystem (ZNS), wodurch das Verlangen von Patienten mit Opioid-Abhängigkeit nach (illegalen) Opioiden über einen längeren Zeitraum auf ein Minimum beschränkt werden kann.
Buprenorphin bindet darüber hinaus als Antagonist an κ-Opioidrezeptoren.
Pharmakokinetik
Das pharmakokinetische Profil von Buprenorphin ist abhängig von der Darreichungsform.
Bei oraler Anwendung unterliegt Buprenorphin einem ausgeprägten First-Pass-Metabolismus, sodass die orale Applikation für diesen Wirkstoff ungeeignet ist.
Im Folgenden beziehen sich die pharmakokinetischen Daten, sofern nicht explizit auf andere Darreichungsformen verwiesen wird, auf die sublinguale Applikation.
Resorption
- Die Plasmaspitzenkonzentration wird 90 Minuten nach der sublingualen Applikation erreicht.
- Das Verhältnis von Dosis zu maximaler Plasmakonzentration ist im Dosisbereich zwischen 2 mg und 24 mg Buprenorphin (Sublingualtabletten) dosisabhängig, aber nicht dosisproportional.
- Das Verhältnis von Dosis zum Ausmaß der Bioverfügbarkeit (AUC) ist im Dosisbereich zwischen 2 mg und 16 mg Buprenorphin (Sublingualtabletten) dosisproportional, im Dosisbereich zwischen 16 und 24 mg dosisabhängig, aber nicht dosisproportional.
- Die relative Bioverfügbarkeit von Buprenorphin-Sublingualtabletten im Vergleich zu Buprenorphin-Lösung beträgt nach einer an 24 Probanden durchgeführten Bioverfügbarkeitsstudie etwa 70 %.
Verteilung
- Auf die Resorption von Buprenorphin folgt eine rasche Verteilungsphase.
- Die Halbwertszeit beträgt 2-5 Stunden.
- Das scheinbare Verteilungsvolumen von Buprenorphin nach wöchentlicher Depot-Injektion beträgt ca. 1900 L.
- Buprenorphin liegt nach wöchentlicher Depot-Injektion zu ca. 96% proteingebunden vor, primär an Alpha- und Betaglobulin.
Metabolismus
- Buprenorphin wird durch 14-N-Dealkylierung (primär CYP3A4) zu N-Dealkylbuprenorphin (Norbuprenorphin) sowie durch Glukuronidierung des Stammmoleküls und des dealkylierten Metaboliten metabolisiert.
- Norbuprenorphin ist ein μ-Opioidrezeptoragonist mit einer schwachen intrinsischen Aktivität.
Elimination
- Die Elimination von Buprenorphin verläuft mit einer langen terminalen Eliminationsphase von 20-25 Stunden bi- oder tri-exponentiell.
- Dies ist zum einen auf die Rückresorption von Buprenorphin nach der Hydrolyse des konjugierten Derivats im Darm und zum anderen auf den ausgeprägten lipophilen Charakter des Moleküls zurückzuführen.
- Buprenorphin wird nach biliärer Exkretion der glukuronidierten Metaboliten hauptsächlich (zu etwa 80%) über die Fäzes ausgeschieden, wobei der Rest renal eliminiert wird.
Dosierung
Schmerzbehandlung
Allgemein:
- Die Dosierung soll der individuellen Patientensituation (Schmerzstärke, Leidensdruck, individuelle Reaktion) angepasst werden.
- Es ist jeweils die niedrigste ausreichend schmerzlindernde Dosierung anzustreben.
Im Folgenden beziehen sich die Informationen auf die transdermale Applikation für eine 4-Tage-Anwendung, wobei sich das Prinzip der Dosierung bei den transdermalen Pflastern ähnelt.
Anfangsdosis:
- Bei Patienten ohne vorherige Anwendung von Analgetika soll die Behandlung mit der niedrigsten Stärke des transdermalen Pflasters (35 µg/h) begonnen werden.
- Bei Vorbehandlung mit einem Analgetikum der WHO-Stufe I (Nichtopioid) oder der WHO-Stufe II (schwach wirksames Opioid) soll ebenfalls zu Beginn Buprenorphin 35 µg/h gewählt werden.
- Gemäß den Empfehlungen der WHO kann abhängig von der medizinischen Gesamtsituation des Patienten die Einnahme eines Nichtopioid-Analgetikums beibehalten werden.
- Bei Umstellung von einem Analgetikum der WHO-Stufe III (stark wirksames Opioid) auf Buprenorphin empfiehlt es sich zur Minimierung einer Versorgungslücke, bei der Wahl der initialen Stärke des transdermalen Pflasters die Vorbehandlung nach Art des Wirkstoffs, Art der Anwendung und der durchschnittlichen Tagesdosierung zu berücksichtigen.
- Allgemein ist es empfehlenswert, die Dosis individuell zu titrieren, indem mit der kleinsten Pflasterstärke begonnen wird.
- Klinische Erfahrungen haben gezeigt, dass Patienten, die zuvor mit höheren Tagesdosen eines stark wirksamen Opioids behandelt wurden (in der Größenordnung von etwa 120 mg oral appliziertem Morphin), die Therapie auch mit der nächst höheren Pflasterstärke beginnen können.
- Um die individuelle Dosisfindung innerhalb einer angemessenen Zeit zu ermöglichen, sollten während der Dosistitration geeignete schnell freisetzende Analgetika verfügbar gemacht werden.
- Da die Buprenorphin-Konzentrationen im Serum sowohl bei nicht mit Analgetika vorbehandelten als auch bei derart vorbehandelten Patienten nach Applikation des ersten Buprenorphin transdermalen Pflasters langsam ansteigen, ist ein rascher Wirkungseintritt unwahrscheinlich.
- Eine erste Bewertung der schmerzlindernden Wirkung sollte aus diesem Grund erst nach 24 Stunden erfolgen.
- Das vorher angewendete Analgetikum (mit Ausnahme von transdermalen Opioiden) sollte nach Umstellung auf Buprenorphin über die ersten 12 Stunden in unveränderter Dosierung gegeben werden und geeignete Zusatzmedikation in den folgenden 12 Stunden bedarfsorientiert.
Dosistitration und Erhaltungsdosis:
- Buprenorphin sollte spätestens nach 96 Stunden (4 Tagen) ersetzt werden.
- Zur Vereinfachung der Anwendung kann der Pflasterwechsel zweimal in der Woche an festen Zeitpunkten, z.B. jeden Montagmorgen und jeden Donnerstagabend, durchgeführt werden.
- Die Dosistitrierung sollte individuell durchgeführt werden, bis die analgetische Wirkung erreicht ist.
- Ist die Analgesie am Ende des ersten Applikationszeitraums unzureichend, kann die Dosis erhöht werden, entweder, indem mehr als ein transdermales Pflaster der gleichen Stärke appliziert wird, oder, indem zur nächsthöheren Pflasterstärke übergegangen wird.
- Unabhängig von der Pflasterstärke sollten gleichzeitig nicht mehr als zwei transdermale Pflaster angewendet werden.
- Vor Applikation der nächsthöheren Pflasterstärke von Buprenorphin sollte die Gesamtmenge an Opioiden, die ggf. zusätzlich zu dem bisherigen transdermalen Pflaster verabreicht wurde, bedacht werden.
- Das heißt, die Gesamtmenge an benötigten Opioiden muss bedacht und die Dosierung muss entsprechend angepasst werden.
- Patienten, die während der Erhaltungstherapie eine zusätzliche Analgetikagabe benötigen (z.B. bei Schmerzspitzen), können alle 24 Stunden z.B. 0,2-0,4 mg Buprenorphin sublingual zusätzlich zu dem transdermalen Pflaster einnehmen.
- Bei regelmäßiger Notwendigkeit von zusätzlich 0,4-0,6 mg Buprenorphin sublingual sollte die nächsthöhere Pflasterstärke eingesetzt werden.
Anwendungsdauer:
- Buprenorphin sollte auf keinen Fall länger als therapeutisch unbedingt notwendig angewendet werden.
- Wenn entsprechend Art und Schwere der Erkrankung eine länger dauernde Schmerzbehandlung mit Buprenorphin erforderlich ist, sollte sorgfältig und in regelmäßigen Abständen überprüft werden (gegebenenfalls durch Einlegen von Anwendungspausen), ob und in welchem Umfang eine weitere Behandlung erforderlich ist.
Absetzen der Therapie:
- Nach Entfernen eines Pflasters fällt die Buprenorphin-Konzentration
im Serum kontinuierlich ab, wodurch die schmerzlindernde Wirkung noch über einen bestimmten Zeitraum erhalten bleibt.
- Dies muss bedacht werden, wenn nach Buprenorphin ein anderes Opioid angewendet werden soll.
- Allgemein gilt, dass ein nachfolgendes Opioid nicht innerhalb der nächsten 24 Stunden nach Absetzen angewendet werden darf.
- Derzeit liegen nur sehr wenige Informationen über die Initialdosis eines anderen Opioids nach Absetzen von Buprenorphin vor.
Substitutionstherapie bei Opioidabhängigkeit (sublinguale Applikation)
Allgemein:
- Die Dosierung orientiert sich am Auftreten von Entzugssymptomen und muss für jeden Patienten entsprechend der jeweiligen individuellen Situation und dem subjektiven Empfinden eingestellt werden.
- Generell gilt, dass nach Einstellung der Dosis die niedrigst mögliche Erhaltungsdosis anzustreben ist.
- 0,4 mg sind zur individuellen Feindosierung und Dosisanpassung insbesondere zu Behandlungsbeginn und Behandlungsende vorgesehen.
- 2 mg ist für die Dosierung zu Behandlungsbeginn sowie zur Anpassung
der Erhaltungsdosis vorgesehen.
- 8 mg sind für die höherdosierte Erhaltungsphase vorgesehen.
- Bei opioidabhängigen Patienten ohne vorherige Entzugsbehandlung sollte frühestens 4 Stunden nach der letzten Anwendung des Opioids oder bei den ersten Entzugserscheinungen eine Sublingualtablette verabreicht werden.
Anfangsdosis:
- 2-4 mg (entsprechend 1-2 Sublingualtabletten mit 2 mg) als tägliche Einzeldosis
Dosisanpassung und Erhaltungsdosis:
- Die Dosis ist entsprechend der klinischen Wirkung beim einzelnen Patienten zunehmend zu erhöhen und darf eine maximale tägliche Einzeldosis von 24 mg Buprenorphin entsprechend 3 Sublingualtabletten mit 8 mg nicht übersteigen.
- Eine Dosiseinstellung erfolgt auf Grundlage einer Neubewertung des klinischen und psychologischen Status des Patienten.
Alternierende Gabe:
- Aufgrund der pharmakokinetischen Eigenschaften von Buprenorphin kann die klinische Wirksamkeit abhängig von der Dosierung 48 bis 72 Stunden anhalten.
- Nach Erreichen einer stabilen Erhaltungsdosis kann dem Patienten alternierend die doppelte (für ein 2-Tagesintervall) oder dreifache (für ein 3-Tagesintervall) Tagesdosis von Buprenorphin unter Aufsicht verabreicht werden.
- Die Dosiseinstellung ist unter ärztlicher Aufsicht durchzuführen.
- Während der Einstellung auf die doppelte bzw. dreifache Dosis sollte der Patient 3-4 Stunden auf mögliche Überdosierungssymptome hin überwacht werden.
- Vor der Erhöhung der Buprenorphindosis muss der Beigebrauch von anderen zentral dämpfenden Stoffen (z.B. Benzodiazepinen) sicher ausgeschlossen werden.
- Individuell sind optimierte Dosierungen anzuwenden.
- In Einzelfällen können geringere Dosierungen ausreichend sein.
- In klinischen Studien wurde die Wirksamkeit und Sicherheit von Buprenorphin für die alternierende Gabe jeden 2. Tag in Dosen von 8 bis 34 mg/70 kg Körpergewicht Buprenorphinlösung sublingual bzw. bei alternierender Gabe für ein 3-Tagesintervall in Dosen von 12 bis 44 mg/70 kg Körpergewicht Buprenorphinlösung sublingual gezeigt.
Zeichen und Symptome einer übermäßigen Buprenorphin-Anwendung:
- Die Interaktionen zwischen der Ausbildung und dem Weiterbestehen der Opioidtoleranz und der Buprenorphin-Dosis können komplex sein.
- Eine Reduktion der Dosis wird in den Fällen empfohlen, in denen Patienten Zeichen und Symptome einer übermäßigen Buprenorphin-Wirkung zeigen, die durch Beschwerden wie „sich komisch fühlen“, schlechte Konzentrationsfähigkeit, Schläfrigkeit und möglicherweise Schwindelgefühl im Stehen gekennzeichnet ist.
Buprenorphin-Entzug:
- Falls die verordnete Buprenorphin-Dosis zu niedrig ist, kann es während des 24-Stunden Dosierungsintervalls zu Entzugssymptomen kommen (Kongestion der Nase, abdominale Symptome, Diarrhoe, Muskelschmerzen, Angstgefühle).
- Behandelnde Ärzte sollten sich des potenziellen Erfordernisses bewusst sein, die Dosis abzuändern, wenn Patienten über Entzugssymptome berichten.
Dosisreduktion und Beenden der Therapie:
- Nach Erreichen einer zufriedenstellenden Stabilisationsphase kann die Dosis allmählich auf eine niedrigere Erhaltungsdosis reduziert werden.
- Wenn es angemessen erscheint, kann die Therapie bei einigen Patienten beendet werden.
- Die zur Verfügung stehenden Dosierungsstärken von 0,4 mg, 2 mg und 8 mg Buprenorphin ermöglichen eine schrittweise Reduzierung der Dosis.
- Nach Beendigung der Buprenorphin-Therapie sind die Patienten zu über-
wachen, da die Möglichkeit eines Rückfalls besteht.
Umstellung von sublingualer Applikation auf Depot-Injektion:
- Patienten, die mit sublingualem Buprenorphin behandelt wurden, können direkt auf eine wöchentliche oder monatliche Depot-Injektion umgestellt werden, beginnend am Tag nach der letzten täglichen Behandlungsdosis mit sublingualem Buprenorphin.
- Patienten können beispielsweise von 26-32 mg sublingualem Buprenorphin direkt auf eine monatliche Dosis 160 mg Depot-Injektionslösung umgestellt werden (detailliertere Informationen sind der Fachinformation für die Depot-Injektionslösung zu entnehmen).
- Während des Dosierungszeitraums nach der Umstellung wird eine engmaschigere Überwachung der Patienten empfohlen.
Nebenwirkungen
µ-Opioidrezeptoren befinden sich nicht nur im ZNS, sondern auch in der Peripherie, weshalb die Nebenwirkungen der Opioide in der Regel vom pharmakologischen Wirkmechanismus abzuleiten sind.
Die häufigsten Nebenwirkungen unter einer Therapie mit Buprenorphin umfassen:
- Übelkeit und Erbrechen
- Obstipation
- Schwindel und Kopfschmerzen
- Schlaflosigkeit
- Schwitzen
- Asthenie
- Entzugssyndrom
- Angstgefühl
- Juckreiz
Wie auch bei anderen Opioiden sind Atemdepressionen möglich, die potenziell schwerwiegend sein können (insbesondere bei gleichzeitiger Anwendung von Benzodiazepinen).
Das Auftreten von Obstipationen sollte ebenfalls nicht vernachlässigt werden, denn Opioid-induzierte Obstipationen können in einem Laxanzienabusus münden (Circulus vitiosus Laxanzien).
Wechselwirkungen
Bei der gleichzeitigen Anwendung von Buprenorphin mit folgenden Substanzen ist Vorsicht geboten:
- Alkohol: Alkohol verstärkt die sedative Wirkung von Buprenorphin.
- Benzodiazepine: Benzodiazepine können eine zentral ausgelöste Atemdepression verstärken und zu Lebensgefahr führen.
- Weitere zentral dämpfende Wirkstoffe wie andere Opioide (Analgetika und Antitussiva), bestimmte Antidepressiva, sedative H1-Rezeptorantagonisten, Barbiturate, Anxiolytika, Neuroleptika, Clonidin und verwandte Substanzen: Die Kombination mit Buprenorphin verstärkt die zentral dämpfende Wirkung.
- Serotonerge Arzneimittel wie MAO-Hemmer, selektive Serotonin-Wiederaufnahmehemmer (SSRI), Serotonin-Noradrenalin-Wiederaufnahmehemmer (SNRI) oder trizyklische Antidepressiva: Die Kombination mit Buprenorphin erhöht das Risiko eines Serotoninsyndroms, das potenziell lebensbedrohlich sein kann.
- MAO-Hemmer: Ausgehend von der Erfahrung mit Morphin ist eine Wirkungssteigerung von Buprenorphin möglich.
- CYP3A4-Inhibitoren bzw. -Induktoren: CYP3A4-Inhibitoren können die Wirksamkeit von Buprenorphin verstärken, wohingegen CYP3A4-Induktoren die Wirksamkeit von Buprenorphin verringern können.
Kontraindikationen
Buprenorphin ist kontraindiziert bei:
- Überempfindlichkeit gegen den Wirkstoff oder sonstige Bestandteile des Arzneimittels
- Schwerer respiratorische Insuffizienz
- Schwerer Leberinsuffizienz
- Akutem Alkoholismus oder Delirium tremens
- Schweren Kopfverletzungen und erhöhtem Hirndruck wegen der atemdepressiven Wirkung von Opioiden und der Gefahr einer weiteren Erhöhung des zerebrospinalen Drucks
- Behandlung mit MAO-Hemmern
Schwangerschaft
Es liegen keine hinreichenden Daten für eine Verwendung von Buprenorphin bei Schwangeren vor. Tierexperimentelle Studien haben eine Reproduktionstoxizität gezeigt, wobei das potenzielle Risiko für den Menschen unbekannt ist.
Eine längerfristige Anwendung während der Schwangerschaft kann zur Gewöhnung und Abhängigkeit auch beim Kind sowie nach der Geburt zu Entzugserscheinungen beim Neugeborenen führen.
Gegen Ende der Schwangerschaft können hohe Dosen auch nach kurzer Anwendungsdauer eine Atemdepression beim Neugeborenen hervorrufen (diese Effekte wurden im Rahmen von Untersuchungen zur Substitutionstherapie bei Schwangeren beobachtet).
Buprenorphin zur Substitution darf während der Schwangerschaft nur angewendet werden, wenn es nach sorgfältiger Nutzen/Risiko-Analyse unbedingt erforderlich erscheint. Dabei muss eine engmaschige Überwachung der Schwangeren und des Fetus durch den Arzt erfolgen.
Stillzeit
Buprenorphin und seine Metabolite werden in die Muttermilch ausgeschieden. Zudem haben Studien an Ratten gezeigt, dass Buprenorphin die Laktation hemmen kann. Die Anwendung während der Stillzeit ist zu vermeiden.
Verkehrstüchtigkeit
Da die Anwendung von Buprenorphin Müdigkeit, Benommenheit, Schwindel und Entzugssymptome hervorrufen kann, sollten die Patienten kein Fahrzeug führen oder Maschinen bedienen, solange sie sich nicht auf eine Dosis stabilisiert haben. Nach Erreichen einer stabilen Dosis kann der Arzt darüber entscheiden, ob der Patient ein Fahrzeug führen oder eine Maschine bedienen kann.
Anwendungshinweise
Atemdepression
- Es wurden einige Todesfälle infolge einer Atemdepression beschrieben, insbesondere bei kombinierter Anwendung mit Benzodiazepinen oder wenn Buprenorphin nicht gemäß der Fach-/Gebrauchsinformation angewendet wurde.
- Sollte im Einzelfall im Rahmen der ärztlichen Therapiefreiheit eine Benzodiazepinbehandlung für indiziert gehalten werden, muss eine individuelle Dosiseinstellung vorgenommen und der Patient sorgfältig überwacht werden.
- Das Risiko des Arzneimittelmissbrauchs ist in Betracht zu ziehen.
Schlafbezogene Atmungsstörungen
- Opioide können schlafbezogene Atmungsstörungen einschließlich zentraler Schlafapnoe und schlafbezogener Hypoxämie verursachen.
- Die Anwendung von Opioiden geht mit einer dosisabhängigen Erhöhung des Risikos für eine zentrale Schlafapnoe einher.
- Bei Patienten mit zentraler Schlafapnoe sollte eine Verringerung der Opioidgesamtdosis in Betracht gezogen werden.
Hepatitis und hepatische Ereignisse
- Unter Buprenorphin wurden Lebernekrosen und Hepatitiden mit Ikterus beschrieben (die Ursache konnte nicht eindeutig festgestellt werden).
- Bei Verdacht auf ein hepatisches Ereignis und ungeklärter Ursache ist eine weitergehende Untersuchung erforderlich.
- Besteht der Verdacht, dass Buprenorphin die Ursache für die Lebernekrose oder den Ikterus darstellt, muss das Präparat entsprechend dem klinischen Zustand des Patienten so schnell wie möglich abgesetzt werden.
- Wird die Therapie fortgesetzt, ist die Leberfunktion zu überwachen.
- Schwerwiegende Fälle von akuten Leberschäden wurden auch im Zusammenhang mit nicht bestimmungsgemäßem Gebrauch berichtet, insbesondere wenn Buprenorphin i.v. injiziert wurde (sie wurden hauptsächlich bei den hohen Dosierungen beobachtet und können durch virale Infektionen, insbesondere chronische Hepatitis C, Alkoholmissbrauch, Anorexie und den gleichzeitigen Gebrauch anderer potenziell hepatotoxischer Substanzen begünstigt werden).
Entzugssymptome
- Vor Beginn der Behandlung mit Buprenorphin sollte das partiell agonistische Wirkungsprofil von Buprenorphin bekannt sein.
- Buprenorphin bindet an μ- und κ-Opioidrezeptoren und kann Opioid-Entzugssymptome hervorrufen, wenn es einem Suchtpatienten weniger als 4 Stunden nach der letzten Anwendung des Opioids verabreicht wird.
Zentral dämpfende Wirkung
- Während der Behandlung mit Buprenorphin dürfen keine alkoholischen Getränke oder alkoholhaltigen Arzneimittel eingenommen werden
Die gleichzeitige Anwendung von zentral dämpfenden Arzneimitteln wie anderen Opioiden (Analgetika und Antitussiva), bestimmten Antidepressiva, sedativen H1-Rezeptorantagonisten, Barbituraten, Anxiolytika, Neuroleptika, Clonidin und verwandten Substanzen erfordert ärztliche Überwachung.
Serotoninsyndrom
- Die gleichzeitige Anwendung von Buprenorphin mit anderen serotonergen Arzneimitteln wie MAO-Hemmern, SSRI, SNRI oder trizyklischen Antidepressiva kann zu einem Serotoninsyndrom führen.
- Wenn eine gleichzeitige Behandlung mit anderen serotonergen Arzneimitteln klinisch angezeigt ist, wird eine sorgfältige Beobachtung des Patienten empfohlen, insbesondere bei Behandlungsbeginn und Dosiserhöhungen.
- Die Symptome des Serotoninsyndroms umfassen unter anderem Veränderungen des Gemütszustandes, autonome Instabilität, neuromuskuläre Auffälligkeiten und/oder gastrointestinale Symptome.
- Wenn ein Serotoninsyndrom vermutet wird, sind je nach der Schwere der Symptome eine Dosisverringerung oder das Absetzen der Behandlung in Erwägung zu ziehen.
Klasseneffekte der Opioide
- Opioide können orthostatische Hypotonie verursachen.
- Opioide können zu einem erhöhten Liquordruck führen, der Krampfanfälle verursachen kann (daher sollten Opioide bei Patienten mit Kopfverletzungen, intrakraniellen Läsionen, anderen Zuständen mit möglicher Erhöhung des Liquordrucks oder Krampfanfällen in der Vorgeschichte mit Vorsicht angewendet werden).
- Vorsicht ist geboten, wenn Opioide bei Patienten mit Hypotonie, Prostatahypertrophie oder Urethralstenose angewendet werden.
- Eine durch Opioide verursachte Miosis, Veränderungen des Bewusstseinszustands oder Veränderungen der Schmerzwahrnehmung als Symptom einer Krankheit können die Patientenbeurteilung beeinträchtigen und die Diagnose oder den klinischen Verlauf einer Begleiterkrankung verschleiern.
- Opioide sollten bei Patienten mit Myxödem, Hypothyreose oder Nebenniereninsuffizienz (z.B. Morbus Addison) mit Vorsicht angewendet werden.
- Es hat sich gezeigt, dass Opioide den Druck im Gallengang erhöhen und bei Patienten mit Dysfunktion der Gallenwege mit Vorsicht angewendet werden sollten.
Kardiale Risiken
- Eine besonders sorgfältige ärztliche Überwachung ist erforderlich bei Patienten mit bekannter oder vermuteter EKG-Veränderung (Verlängerung des QT-Intervalls) oder Elektrolyt-Ungleichgewicht, insbesondere Kaliummangel (Hypokaliämie), klinisch signifikanter Verlangsamung der Herzfrequenz (Bradykardie) und Behandlung mit bestimmten Arzneimitteln gegen Herzrhythmusstörungen (Antiarrhythmika der Klasse I und III).
- Klinische Studien haben Hinweise erbracht, dass unter reinen μ-Opioidrezeptoragonisten sehr häufig eine Verlängerung des QT-Intervalls auftritt und folglich ein Risiko des Auftretens von polymorpher ventrikulärer Tachykardie (Torsade de Pointes) besteht.
- Bei der Behandlung mit Buprenorphin, einem partiellen μ-Opioidrezeptoragonisten, trat in klinischen Studien häufig eine Verlängerung des QT-Intervalls auf, deren Kausalität nicht eindeutig geklärt werden konnte.
- Bei Patienten, bei denen die potenziellen Vorteile einer Buprenorphinbehandlung das Tachykardierisiko übersteigen, sollte vor Therapieeinleitung und nach zwei Behandlungswochen ein EKG abgeleitet werden, um die Wirkung von Buprenorphin auf
das QT-Intervall nachzuweisen und zu quantifizieren.
- Entsprechend ist auch vor und nach einer Erhöhung der Dosis die Durchführung eines EKGs angeraten.
Alternativen
In Abhängigkeit vom Indikationsgebiet und patientenindividuellen Faktoren bieten sich unterschiedliche Wirkstoffe als Alternativen an.
Schmerzbehandlung:
- Andere Opioid-Analgetika wie Morphin, Tramadol oder Oxycodon
- Nicht-Opioid-Analgetika wie NSAR, Paracetamol oder Metamizol
- Co-Analgetika wie bestimmte Antidepressiva (Amitriptylin) oder Antikonvulsiva (Gabapentin, Pregabalin)
- Lokalanästhetika wie Lidocain
- Capsaicin
- Cannabinoide
- Ziconotid
Substitutionstherapie bei Opioidabhängigkeit:
- Methadon oder Levomethadon
- Codein oder Dihydrocodein
- Diamorphin
Weitere Informationen sind der jeweiligen Fachinformation zu entnehmen.
Wirkstoff-Informationen
- Glenmark: Fachinformation
- Neuraxpharm: Fachinformation
- Reckitt Benckiser: Fachinformation SUBUTEX®
- EMA: Buvidal
- Freissmuth et al., Pharmakologie und Toxikologie, 2020, Springer
- Mutschler et al., Mutschler Arzneimittelwirkungen, 2019, Wissenschaftliche Verlagsgesellschaft Stuttgart
- Betäubungsmittel-Verschreibungsverordnung (BtMVV)
-
TEMGESIC® Ampullen, 0,3 mg, Injektionslösung
Eumedica Pharmaceuticals GmbH
-
TEMGESIC® forte sublingual, 0,4 mg, Sublingualtablette
Eumedica Pharmaceuticals GmbH
-
TEMGESIC® sublingual, 0,2 mg, Sublingualtablette
Eumedica Pharmaceuticals GmbH
-
Transtec 35 Mikrogramm/h Allomedic transdermales Pflaster, 4 Tage
Allomedic GmbH
-
Transtec 35 Mikrogramm/h Emra transdermales Pflaster, 4 Tage
Emra-Med Arzneimittel GmbH
-
Transtec 35 Mikrogramm/h Eurim transdermales Pflaster, 4 Tage
Eurim-Pharm Arzneimittel GmbH
-
Transtec 35 Mikrogramm/h kohlpharma, transdermales Pflaster, 4 Tage
kohlpharma GmbH
-
Transtec 35 Mikrogramm/h Orifarm, transdermales Pflaster, 4 Tage
Orifarm GmbH
-
Transtec 35 Mikrogramm/h PB Pharma, transdermales Pflaster, 4 Tage
PB Pharma GmbH
-
Transtec 52,5 Mikrogramm/h Allomedic transdermales Pflaster, 4 Tage
Allomedic GmbH
-
Transtec 52,5 Mikrogramm/h Emra, transdermales Pflaster, 4 Tage
Emra-Med Arzneimittel GmbH
-
Transtec 52,5 Mikrogramm/h kohlpharma, transdermales Pflaster, 4 Tage
kohlpharma GmbH
-
Transtec 52,5 Mikrogramm/h Orifarm, transdermales Pflaster, 4 Tage
Orifarm GmbH
-
Transtec 52,5 Mikrogramm/h PB Pharma transdermales Pflaster, 4 Tage
PB Pharma GmbH
-
Transtec 70 Mikrogramm/h Allomedic transdermales Pflaster, 4 Tage
Allomedic GmbH
-
Transtec 70 Mikrogramm/h Emra, transdermales Pflaster, 4 Tage
Emra-Med Arzneimittel GmbH
-
Transtec 70 Mikrogramm/h kohlpharma, transdermales Pflaster, 4 Tage
kohlpharma GmbH
-
Transtec 70 Mikrogramm/h Orifarm, transdermales Pflaster, 4 Tage
Orifarm GmbH
-
Transtec 70 Mikrogramm/h PB Pharma, transdermales Pflaster, 4 Tage
PB Pharma GmbH
-
Transtec Pro 35 Mikrogramm/h Candoro ethics transdermales Pflaster, 4 Tage
Candoro ethics GmbH
-
Transtec PRO® 35 Mikrogramm/h, transdermales Pflaster, 4 Tage
Grünenthal GmbH
-
Transtec Pro 52,5 Mikrogramm/h Candoro ethics transdermales Pflaster, 4 Tage
Candoro ethics GmbH
-
Transtec PRO® 52,5 Mikrogramm/h, transdermales Pflaster, 4 Tage
Grünenthal GmbH
-
Transtec Pro 70 Mikrogramm/h Candoro ethics transdermales Pflaster, 4 Tage
Candoro ethics GmbH
-
Transtec PRO® 70 Mikrogramm/h, transdermales Pflaster, 4 Tage
Grünenthal GmbH
-
Zubsolv 1,4 mg/0,36 mg Sublingualtabletten
Accord Healthcare GmbH
-
Zubsolv 2,9 mg/0,71 mg Sublingualtabletten
Accord Healthcare GmbH
-
Zubsolv 5,7 mg/1,4 mg Sublingualtabletten
Accord Healthcare GmbH
-
Zubsolv 8,6 mg/2,1 mg Sublingualtabletten
Accord Healthcare GmbH
-
Zubsolv 11,4 mg/2,9 mg Sublingualtabletten
Accord Healthcare GmbH













