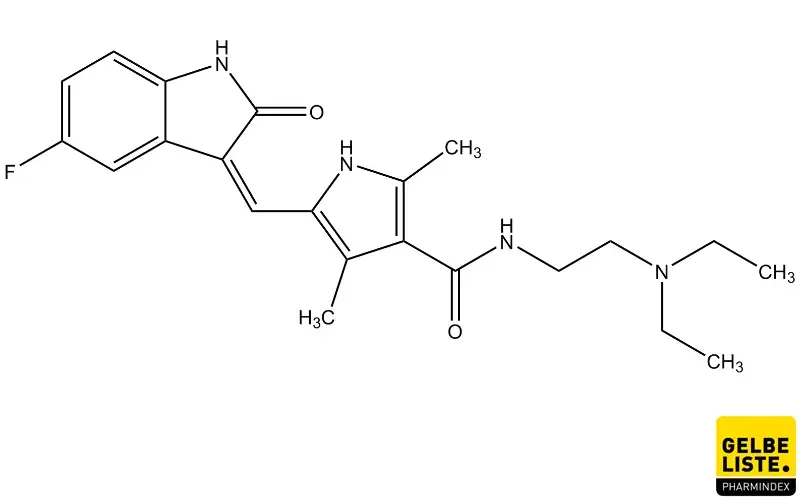
Sunitinib
Sunitinib ist ein antineoplastisches Therapeutikum und wird zur Behandlung Erwachsener mit malignen gastrointestinalen Stromatumoren (GIST), metastasierten Nierenzellkarzinomen (mRCC) und pankreatischen neuroendokrinen Tumoren (pNET) eingesetzt. Der Wirkstoff gehört zur pharmakotherapeutischen Gruppe der Proteinkinase-Inhibitoren, Rezeptor-Tyrosinkinase-Hemmer (ATC L01XE04).
Sunitinib: Übersicht
Anwendung
Der Wirkstoff wird bei erwachsenen Patienten mit folgenden Indikationen angewandt:
- nicht resezierbare und/oder metastasierte maligne gastrointestinale Stromatumoren (GIST), wenn eine Behandlung mit Imatinib wegen Resistenz oder Unverträglichkeit fehlgeschlagen ist
- fortgeschrittene und/oder metastasierte Nierenzellkarzinome (mRCC)
- nicht resezierbare oder metastasierte, gut differenzierte pankreatische neuroendokrine Tumoren (pNET) mit Krankheitsprogression.
Wirkmechanismus
Der Wirkmechanismus von Sunitinib beruht auf der Hemmung von Rezeptortyrosinkinasen (RTKs), die am Tumorwachstum, der Angioneogenese und der Entwicklung von Metastasen bei Krebserkrankungen beteiligt sind. Im Detail inhibiert Sunitinib folgende Tyrosinkinasen:
- platelet-derived growth factor-Rezeptoren (PDGFR) α und β
- vascular endothelial growth factor-Rezeptoren (VEGFR) 1–3
- Stammzellfaktor-Rezeptoren (KITR)
- Fms-like tyrosine kinase3-Rezeptoren (FLT3-R)
- makrophagenkoloniestimulierende Faktor-Rezeptoren (CSF-1-R)
- rearranged during transfection-Rezeptoren (RETR).
Der primäre Metabolit entwickelte in biochemischen und zellulären Versuchsreihen eine mit Sunitinib vergleichbare Wirkstärke.
Pharmakokinetik
Die Pharmakokinetik von Sunitinib wurde bislang an 135 gesunden Probanden und 266 Patienten mit soliden Tumoren untersucht. Die Pharmakokinetik war bei allen Probanden vergleichbar.
AUC und Cmax erhöhen sich im Dosisbereich von 25 bis 100 mg dosisproportional. Sunitinib kumuliert bei wiederholter täglicher Gabe auf das 3- bis 4-Fache und sein primärer aktiver Metabolit auf das 7- bis 10-Fache. Die jeweiligen Steady-State-Konzentrationen werden innerhalb von 10 bis 14 Tagen erreicht. An Tag 14 liegen die kombinierten Plasmakonzentrationen von Sunitinib und seinem aktiven Metaboliten im Bereich von 62,9 bis 101 ng/ml. Die Angaben beziehen sich auf die in präklinischen Untersuchungen gefundenen Zielkonzentrationen zur in-vitro-Hemmung der Rezeptorphosphorylierung. Das führte in-vivo zu Verzögerung oder Stillstand des Tumorwachstums.
Der Anteil des primären aktiven Metaboliten liegt bei 23 bis 37 Prozent der Gesamtexposition. Bei den untersuchten Dosisbereichen zeigten sich weder nach der wiederholten täglichen Gabe noch nach wiederkehrenden Behandlungszyklen signifikante Veränderungen in der Pharmakokinetik von Sunitinib oder seinem primären aktiven Metaboliten.
Sunitinib erreicht die Cmax nach der oralen Aufnahme im Allgemeinen 6 bis 12 Stunden (Zeitpunkt der maximalen Plasmakonzentration, tmax) später. Die Einnahme zusammen mit einer Mahlzeit hat keinen Einfluss auf die Bioverfügbarkeit von Sunitinib.
Nebenwirkungen
Sehr häufige Nebenwirkungen:
- Neutropenie, Thrombozytopenie, Anämie, Leukopenie
- Hypothyreose
- verminderter Appetit
- Schlaflosigkeit
- Schwindelgefühl
- Kopfschmerzen
- Beeinträchtigung des Geschmackssinns
- Hypertonie
- Dyspnoe
- Nasenbluten
- Husten
- Stomatitis
- Abdominalschmerzen
- Nausea, Emesis
- Diarrhoe, Obstipation
- Dyspepsie
- Hautverfärbung, Hautausschlag, trockene Haut
- Palmar-plantares Erythrodysästhesie- Syndrom
- Änderungen der Haarfarbe
- Schmerzen in einer Extremität
- Arthralgie
- Rückenschmerzen
- Mucositis
- Erschöpfung
- Ödem
- Fieber.
Häufige Nebenwirkungen:
- Virusinfektionen, Atemwegsinfektionen, Pilzinfektionen, Harnwegsinfektionen, Hautinfektionen
- Abszess
- Sepsis
- Lymphopenie
- Dehydratation
- Hypoglykämie
- Depression
- periphere Neuropathie
- Parästhesie, Hypästhesie, Hyperästhesie
- Periorbitalödem, Lidödem
- verstärkte Tränensekretion
- myokardiale Ischämie
- verringerte Ejektionsfraktion
- tiefe Venenthrombose
- Hitzewallung, Hitzegefühl
- Lungenembolie
- Pleuraerguss
- Hämoptyse
- Belastungsdyspnoe
- Schmerzen im Oropharynx
- Nasenverstopfung, trockene Nasenschleimhaut
- gastroösophageale Refluxerkrankung
- Dysphagie
- Gastrointestinalblutung
- Ösophagitis
- Meteorismus, abdominale Beschwerden, Flatulenz
- Rektalblutung, Proktalgie
- Hämorrhoiden
- Zahnfleischbluten, Mundulzeration
- Cheilitis
- Glossodynie
- Mundschmerzen, Mundtrockenheit, orale Beschwerden
- Aufstoßen
- Exfoliation der Haut, Hautreaktion, Hautläsion, Hauthyperpigmentierung
- Erythem, Ekzem, Blasenbildung
- Alopezie
- Akne
- Juckreiz
- Hyperkeratose
- Dermatitis
- Nagelerkrankung
- Schmerzen des Muskel- und Skelettsystems
- Muskelspasmen, Myalgie, Muskelschwäche
- Nierenversagen (auch akut)
- Chromurie, Proteinurie
- Schmerzen im Brustkorb
- allgemeine Schmerzen
- grippeähnliche Erkrankung
- Schüttelfrost
- vermindertes Körpergewicht
- Leukozytenzahl erniedrigt, Lipaseerhöhung, verminderte Thrombozytenzahl Hämoglobin erniedrigt
- Amylase erhöht, Aspartat-Aminotransferase erhöht, Alanin-Aminotransferase erhöht
- Kreatinin im Blut erhöht, Harnsäure im Blut erhöht
- erhöhte Blutdruckwerte.
Gelegentliche Nebenwirkungen:
- nekrotisierende Fasziitis
- bakterielle Infektionen
- Panzytopenie
- Überempfindlichkeit
- Hyperthyreose
- Hirnblutung
- Schlaganfall, transitorische ischämische Attacke
- kongestive Herzinsuffizienz, Myokardinfarkt
- Herzinsuffizienz, Kardiomyopathie
- Perikarderguss
- Verlängerung des QT-Intervalls im EKG
- Tumorblutung
- Lungenblutung
- respiratorische Insuffizienz
- gastrointestinale Perforation
- Pankreatitis
- Analfistel
- abnormale Leberfunktion, Leberversagen
- Cholezystitis
- Osteonekrose des Kiefers
- Fistel
- Harnwegsblutung
- verzögerte Wundheilung
- erhöhte Kreatinkinase im Blut, erhöhtes Thyreotropin im Blut.
Seltene Nebenwirkungen:
- thrombotische Mikroangiopathie
- Angioödem
- Thyroiditis
- Tumorlyse-Syndrom
- posteriores reversibles Enzephalopathie-Syndrom
- Linksherzinsuffizienz
- Torsade de pointes
- Hepatitis
- Erythema multiforme, Stevens-Johnson- Syndrom, Pyoderma gangraenosum, toxisch-epidermale Nekrolyse
- Rhabdomyolyse
- Myopathie
- nephrotisches Syndrom.
Die Patienten müssen darüber aufgeklärt werden, dass während der Behandlung mit Sunitinib eine Depigmentierung der Haare und der Haut auftreten kann. Mitunter kommt es auch zu Trockenheit, Verdickung oder Rissbildung der Haut, Blasenbildung oder Ausschlag an der Handfläche oder den Fußsohlen. Die oben genannten Nebenwirkungen traten nicht kumulativ auf, waren in den meisten Fällen reversibel und führten im Allgemeinen nicht zum Therapieabbruch. Darüber hinaus gibt es Berichte über Pyoderma gangraenosum (generell reversibel nach Absetzen von Sunitinib).
In Studien im Zuge der Marktüberwachung kam es bei Probanden zu hämorrhagischen Ereignissen, zum Teil mit letalem Ausgang. Diese schlossen Blutungen des Gastrointestinaltrakts, der Atemwege, der Harnwege und des Gehirns ein. Die häufigste hämorrhagische Nebenwirkung war Nasenbluten. Dies betraf rund die Hälfte der hämorrhagischen Ereignisse bei Patienten mit soliden Tumoren. Einige dieser Ereignisse von Nasenbluten wurden als schwer eingestuft, verliefen aber nur selten tödlich.
Es gibt Berichte über Tumorhämorrhagie, einige Male in Verbindung mit Tumornekrose. Einige dieser hämorrhagischen Ereignisse verliefen tödlich. Eine Tumorhämorrhagie kann plötzlich auftreten und sich im Falle von pulmonalen Tumoren als schwere, lebensbedrohliche Hämoptyse oder pulmonale Hämorrhagie manifestieren. In klinischen Studien und aus Erfahrungen nach Markteinführung sind Fälle von pulmonaler Hämorrhagie (einige mit letalem Ausgang) bei Patienten bekannt, die Sunitinib zur Therapie von mRCC und GIST sowie Lungenkarzinom erhielten. Für die Anwendung bei Patienten mit Lungenkrebs ist Sunitinib jedoch nicht zugelassen.
Die am häufigsten berichteten gastrointestinalen Nebenwirkungen waren Diarrhoe, Nausea und Emesis, Abdominalschmerzen, Dyspepsie, Stomatitis sowie Schmerzen im Mundbereich. Ausgeprägte gastrointestinale Nebenwirkungen können mit Antiemetika, Antidiarrhoika oder Antazida behandelt werden.
Bei Patienten, die wegen intraabdominaler Malignome mit Sunitinib behandelt wurden, sind schwerwiegende gastrointestinale Komplikationen, einschließlich gastrointestinaler Perforationen, bekannt. Diese verliefen mitunter auch letal.
Wechselwirkungen
Sunitinib wird hauptsächlich über die CYP-Isoform des Enzyms CYP3A4 metabolisiert. Dabei entsteht Desethyl-Sunitinib, ein erster aktiver Metabolit, der dann durch das gleiche Isoenzym weiter abgebaut wird. Deshalb sind Interaktionen mit Wirkstoffen, die CYP3A4 beeinflussen, wahrscheinlich.
Bislang wurden Arzneimittelinteraktionen nur in Studien mit Erwachsenen untersucht.
Arzneimittel, die die Plasmakonzentration von Sunitinib erhöhen können
Die gleichzeitige Gabe einer Einzeldosis Sunitinib mit dem stark wirksamen CYP3A4-Hemmer Ketoconazol erhöhte in Studien bei gesunden Probanden die gemeinsame Maximalkonzentration (Cmax) von Sunitinib und seinem primären Metaboliten um 49 Prozent und die Fläche unter der Kurve (AUC0-∞) um 51 Prozent.
Die kombinierte Gabe von Sunitinib zusammen mit stark wirksamen CYP3A4-Hemmern kann die Konzentrationen von Sunitinib erhöhen. Dazu gehören unter anderem:
- Ritonavir
- Itraconazol
- Erythromycin
- Clarithromycin
- Grapefruitsaft.
Deshalb sollte Sunitinib nicht zusammen mit CYP3A4-Hemmern gegeben werden. Eine alternative Komedikation sollte kein oder nur ein geringes Potenzial für eine CYP3A4-Hemmung aufweisen. Ist eine Umstellung nicht möglich, muss die Dosis von Sunitinib unter Umständen bis zu einem Minimum von 37,5 mg täglich bei GIST und mRCC oder 25 mg täglich bei pNET verringert werden. Dabei ist die individuelle Verträglichkeit engmaschig und sorgfältiger zu kontrollieren.
Auswirkungen von Breast Cancer Resistance Protein-Hemmern (BCRP-Inhibitoren)
Derzeit gibt es nur begrenzte Daten zu Wechselwirkungen zwischen Sunitinib und anderen BCRP-Inhibitoren. Wechselwirkungen können deshalb nicht ausgeschlossen werden.
Arzneimittel, die die Plasmakonzentration von Sunitinib verringern können
Die gleichzeitige Gabe einer Einzeldosis Sunitinib zusammen mit dem CYP3A4-Induktor Rifampicin verringerte in Studien mit gesunden Probanden die gemeinsame Cmax von Sunitinib und seinem primären Metaboliten um 23 Prozent und die AUC0-∞um 46 Prozent.
Bei gemeinsamer Gabe von Sunitinib und stark wirksamen CYP3A4-Induktoren kann sich die Konzentration von Sunitinib verringern. Stark wirksame CYP3A4-Induktoren sind unter anderem:
- Dexamethason
- Phenytoin
- Carbamazepin
- Rifampicin
- Phenobarbital
- Johanniskraut (Hypericum perforatum).
Die Kombination mit CYP3A4-Induktoren muss daher vermieden werden. Alternativ ist eine Komedikation zu erwägen, die mit keinem oder nur geringem Potenzial für eine CYP3A4-Induktion assoziiert ist. Sofern das nicht möglich ist, muss die Dosierung von Sunitinib mitunter in 12,5-mg-Schritten bis zu 87,5 mg pro Tag bei GIST und mRCC oder 62,5 mg pro Tag bei pNET erhöht werden. Die individuelle Verträglichkeit ist dabei engmaschig und sorgfältiger zu überwachen.
Kontraindikationen
Sunitinib darf nicht bei Überempfindlichkeit gegen den Wirkstoff eingenommen werden.
Die gleichzeitige Gabe mit stark wirksamen CYP3A4-Induktoren oder mit stark wirksamen CYP3A4-Hemmern wird nicht empfohlen und sollte nur in Ausnahmefällen erfolgen.
Bei mit Sunitinib behandelten Patienten wurden Verlängerungen des QT-Intervalls und Torsade de pointes beobachtet. Eine Verlängerung des QT-Intervalls geht mit einem erhöhten Risiko für ventrikuläre Arrhythmien, einschließlich Torsade de pointes, einher. In folgenden Situationen sollte Sunitinib nur mit Vorsicht angewendet werden:
- anamnestisch bekannte Verlängerung des QT-Intervalls
- Einnahme von Antiarrhythmika oder andere Arzneimittel, die potentiell das QT-Intervall verlängern
- gravierende kardiovaskuläre Vorerkrankungen in der Anamnese
- Bradykardie oder Elektrolytstörungen
- allgemein erhöhtes Risiko für kardiovaskuläre Ereignisse.
Abbruch der Behandlung
Bei Patienten, die eine thrombotische Mikroangiopathie (TMA) entwickeln, sollte die Sunitinib-Therapie abgebrochen werden. Gleichzeitig ist eine Behandlung der TMA unmittelbar einzuleiten. Nach Therapieabbruch kam es zur Aufhebung der Effekte der TMA.
Während der Therapie mit Sunitinib kam es zu schwerwiegenden Pankreas-Ereignissen mit zum Teil tödlichem Verlauf. Bei Symptomen einer Pankreatitis muss Sunitinib abgesetzt werden. Zudem ist eine angemessene medizinische Behandlung einzuleiten.
Bei Anzeichen oder Symptomen eines Leberversagens, muss Sunitinib abgesetzt und eine angemessene medizinische Behandlung eingeleitet werden. Während der Behandlung mit Sunitinib kam es zu hepatotoxischen Reaktionen. Fälle von Leberversagen, einige mit letalem Verlauf, wurden bei weniger als 1 Prozent der Patienten mit soliden Tumoren beobachtet, die mit Sunitinib behandelt wurden. Deshalb sind vor Behandlungsbeginn, während jedes Therapiezyklus und wenn klinisch erforderlich, Leberfunktionstests (Alanin-Aminotransferase, Aspartat-Aminotransferase, Bilirubinspiegel) indiziert.
Bei Patienten mit nephrotischem Syndrom ist Sunitinib abzusetzen. Der Hersteller empfiehlt vor Behandlungsbeginn eine Urinanalyse. Zudem sollten die Patienten hinsichtlich des Auftretens oder der Verschlechterung einer Proteinurie überwacht werden.
Bei Patienten, die eine nekrotisierende Fasziitis entwickeln, sollte die Sunitinib-Therapie abgebrochen und unverzüglich eine geeignete Behandlung eingeleitet werden. Es sind Fälle von nekrotisierender Fasziitis, mit Beteiligung des Perineums und tödlichem Ausgang sowie letale Verläufe von anderen schweren Infektionen, mit oder ohne Neutropenie, bekannt.
Mitunter kam es in Studien zu Hautreaktionen, einschließlich Fällen von Erythema multiforme (EM) sowie Krankheitsverläufe, die auf Stevens-Johnson-Syndrom (SJS) und toxisch-epidermale Nekrolyse (TEN) hindeuten. Einige dieser Fälle verliefen letal. Bei Anzeichen oder Symptomen von SJS, TEN oder EM (zum Beispiel progredienter Hautausschlag, oft einhergehend mit Blasenbildung oder Schleimhautläsionen), muss die Behandlung mit Sunitinib sofort beendet werden. Bei bestätigter Diagnose von SJS oder TEN darf die Behandlung nicht wieder aufgenommen werden. In einigen Verdachtsfällen von EM vertrugen die Patienten nach Abklingen der Reaktion die Wiederaufnahme der Sunitinib-Behandlung mit einer geringeren Dosis. Einige dieser Patienten erhielten zusätzlich Kortikosteroide oder Antihistaminika.
Beim klinischen Anzeichen einer dekompensierten Herzinsuffizienz wird empfohlen, Sunitinib abzusetzen.
Unterbrechung der Behandlung
Bei Patienten ohne klinische Zeichen einer dekompensierten Herzinsuffizienz, aber mit einer Ejektionsfraktion von weniger als 50 Prozent und einer Abnahme über 20 Prozent unter den Ausgangswert, muss die Gabe von Sunitinib unterbrochen und/ oder die Dosis reduziert werden.
Beim Auftreten von Fisteln sollte die Therapie mit Sunitinib unterbrochen werden. Bislang gibt es nur begrenzte Erfahrungen über die fortgeführte Anwendung von Sunitinib bei Patienten mit Fisteln.
Während der Sunitinib-Therapie sind Berichte von eingeschränkter Wundheilung bekannt. Formale klinische Studien zum Effekt von Sunitinib auf die Wundheilung gibt es jedoch nicht. Bei einem geplanten größeren chirurgischen Eingriff wird als Vorsichtsmaßnahme eine zeitweise Unterbrechung der Sunitinib-Behandlung empfohlen. Über den Zeitpunkt der Wiederaufnahme der Therapie nach einem solchen Eingriff stehen bislang nur begrenzte klinische Erfahrungen zur Verfügung. Die Entscheidung darüber sollte individuell anhand der klinischen Bewertung der Erholung vom chirurgischen Eingriff erfolgen.
Bei Auftreten von Angioödemen durch Überempfindlichkeit sollte die Sunitinib-Therapie unterbrochen werden. Zudem ist eine Behandlung nach den gängigen medizinischen Standards einzuleiten.
In klinischen Studien und aus Erfahrungen nach Markteinführung von Sunitinib liegen Berichte über epileptische Anfälle vor. In diesen Fällen wird ein vorübergehendes Absetzen der Sunitinib-Behandlung empfohlen. Die Behandlung sollte nach Ermessen des behandelnden Arztes und individuellem Patientenzustand wieder aufgenommen werden.
Im Falle einer symptomatischen Hypoglykämie sollte die Sunitinib-Behandlung vorübergehend unterbrochen werden. Bei Diabetes-Patienten sind die Blutzuckerspiegel regelmäßig zu überwachen. Eine engmaschige Kontrolle und entsprechende Anpassung der Antidiabetika-Dosierung minimiert das Risikos von Hypoglykämien. Es gab bereits Fälle von Hypoglykämien, die einen Krankenhausaufenthalt aufgrund von Bewusstseinsverlust erforderlich machten.
Während der Sunitinib-Behandlung sind Blutdruckerhöhungen, einschließlich schwerer Hypertonie mit Werten über 200 mmHg systolisch oder 110 mmHg diastolisch, möglich. Bei schwerer, nicht ausreichend medikamentös eingestellter Hypertonie, wird ein vorübergehendes Aussetzen der Behandlung empfohlen. Sobald der Blutdruck angemessen unter Kontrolle ist, kann die Behandlung wieder aufgenommen werden.
Schwangerschaft/Stillzeit
Frauen im gebärfähigen Alter sollten während der Behandlung mit Sunitinib ausreichend verhüten. Es liegen keine Studien mit Sunitinib in der Schwangerschaft vor. Tierexperimentelle Studien zeigte jedoch eine Reproduktionstoxizität, einschließlich fetaler Missbildungen.
Sunitinib darf während der Schwangerschaft oder bei Frauen ohne ausreichende Kontrazeption nicht angewendet werden - es sei denn, der mögliche Nutzen rechtfertigt ein eventuelles Risiko für den Fetus. Wird Sunitinib schwangeren Frauen gegeben oder wird die Patientin während der Therapie mit Sunitinib schwanger, ist eine Aufklärung über das mögliche Risiko für den Fetus erforderlich.
Sunitinib und/oder seine Metaboliten werden bei Ratten in der Milch ausgeschieden. Es ist jedoch nicht bekannt, ob Sunitinib oder sein primärer aktiver Metabolit auch bei Frauen in die Muttermilch übergeht. Wirkstoffe werden jedoch häufig in die Muttermilch ausgeschieden. Wegen des Potenzials schwerer Nebenwirkungen beim gestillten Säugling dürfen Frauen nicht stillen, solange sie Sunitinib einnehmen.
Aufgrund präklinischer Daten ist es denkbar, dass Sunitinib die männliche und weibliche Fruchtbarkeit beeinträchtigt.
Anwendungshinweise
In Verbindung mit Sunitinib gibt es Berichte über Neutropenie und Thrombozytopenie. Diese Erscheinungen traten nicht kumulativ auf und waren typischerweise reversibel. Ein Therapieabbruch war im Allgemeinen nicht erforderlich. Keines dieser Ereignisse verlief letal. Im Zuge der Marktüberwachung wurden jedoch seltene Fälle von hämatologischen Ereignissen mit tödlichem Ausgang beobachtet, einschließlich mit Thrombozytopenie und neutropenischen Infektionen assoziierten Blutungen.
Während der Behandlung mit Sunitinib wurde zu jedem Zeitpunkt das Auftreten einer Anämie beobachtet. Bei Patienten, die mit Sunitinib behandelt werden, muss zu Beginn jedes Behandlungszyklus ein Differenzialblutbild erhoben werden.
Bei Patienten, die mit Antikoagulantien wie Warfarin und Acenocoumarol behandelt werden, sollten regelmäßig Differenzialblutbild (Thrombozyten) und Gerinnungsfaktoren (PT/ INR) bestimmt werden. Zudem sollte eine körperliche Untersuchung erfolgen.
Patienten sollten während der Sunitinib-Gabe routinemäßig auf Blutungsereignisse untersucht werden, inklusive Differenzialblutbild sowie körperlicher Untersuchung.
Von allen klinischen Studien mit Sunitinib waren Patienten ausgeschlossen, bei denen es während der letzten 12 Monate zu kardialen Ereignissen gekommen war. Diese umfassten:
- Myokardinfarkt (einschließlich schwerer/ instabiler Angina pectoris)
- Bypass-Operationen an den Koronararterien oder peripheren Arterien
- symptomatische dekompensierte Herzinsuffizienz
- Schlaganfall oder transitorische ischämische Attacke
- Lungenembolie.
Es ist nicht bekannt, ob bei diesen Begleit-Beschwerden ein höheres Risiko für eine Sunitinib-bezogene linksventrikuläre Dysfunktion besteht. Vor der Gabe von Sunitinib sollte das Risiko gegen den möglichen Nutzen abgewogen werden. Während der Sunitinib-Therapie ist eine engmaschige Überwachung auf Anzeichen und Symptome einer dekompensierten Herzinsuffizienz erforderlich. Dies gilt insbesondere bei kardialen Risikofaktoren und/oder einer Erkrankung der Koronararterien. Während der Sunitinib-Behandlung muss darüber hinaus zu Behandlungsbeginn und in regelmäßigen Abständen die Messung der LVEF erwogen werden. Bei Patienten ohne kardiale Risikofaktoren ist zu Behandlungsbeginn eine Bestimmung der Ejektionsfraktion zu erwägen.
Bei Patienten, die Sunitinib erhielten, wurden behandlungsbedingte venöse thromboembolische Ereignisse beobachtet, einschließlich tiefer Venenthrombosen und Lungenembolien und tödlichem Ausgang.
Bei mit Sunitinib behandelten Patienten gab es Fälle arterieller thromboembolischer Ereignisse (ATE), gelegentlich mit letalem Ausgang. Zu den häufigsten Ereignissen zählten Schlaganfall, transitorische ischämische Attacke und zerebraler Infarkt.
Bei allen Patienten wird vor Behandlungsbeginn eine Eingangsuntersuchung der Schilddrüsenfunktion empfohlen. Eine vorbestehende Hypothyreose oder Hyperthyreose muss vor Behandlungsbeginn mit Sunitinib nach den gängigen medizinischen Standards behandelt werden. Während der Behandlung mit Sunitinib ist die Schilddrüsenfunktion regelmäßig alle 3 Monate zu überwachen. Zudem sollte während der Behandlung mit Sunitinib engmaschig auf Anzeichen und Symptome einer Schilddrüsendysfunktion geachtet werden. Bei Anzeichen und/oder Symptomen, die auf eine Schilddrüsendysfunktion hinweisen, sind die Laborwerte zur Schilddrüsenfunktion zu kontrollieren. Patienten, die eine Schilddrüsendysfunktion entwickeln, sollten nach den gängigen medizinischen Standards behandelt werden. Eine Hypothyreose kann sowohl früh als auch im späten Verlauf der Behandlung mit Sunitinib auftreten.
Sunitinib kann die Nierenfunktion einschränken. Es gab bereits Fälle von Nierenversagen und/oder akuter Niereninsuffizienz mit letalem Verlauf.
Während der Behandlung mit Sunitinib wurden Fälle von Osteonekrose des Kiefers bekannt. In der Mehrzahl wurde von Patienten berichtet, die zuvor oder begleitend eine Behandlung mit intravenösen Bisphosphonaten erhielten. Daher ist besondere Vorsicht geboten, wenn Sunitinib und intravenöse Bisphosphonate gleichzeitig oder aufeinanderfolgend gegeben werden. Invasive dentale Eingriffe sind ebenfalls als Risikofaktor für Osteonekrose des Kiefers identifiziert. Vor der Behandlung mit Sunitinib sollte deshalb der Zahnstatus untersucht werden. Bei Bedarf sind entsprechende präventive Zahnheilkundemaßnahmen zu erwägen und einzuleiten. Bei Patienten, die zuvor oder aktuell intravenöse Bisphosphonate erhalten, sind invasive dentale Eingriffe nach Möglichkeit zu vermeiden.
Während der Behandlung mit Sunitinib gab es Fälle von Tumorlyse-Syndrom (TLS), einige davon verliefen tödlich. Patienten mit Risikofaktoren wie hohe Tumorlast, vorbestehende chronische Niereninsuffizienz, Oligurie, Dehydratation, Hypotonie und Azidurie sollten engmaschig überwacht und bei Bedarf behandelt werden. Zudem ist eine prophylaktische Hydratation zu erwägen.
Patienten mit epileptischen Anfällen und Anzeichen oder Symptomen, die auf ein posteriores reversibles Enzephalopathie-Syndrom (PRES) hindeuten, müssen medizinisch überwacht werden (einschließlich der Kontrolle von Bluthochdruck). Hinweisgebend sind unter anderem:
- Hypertonie
- Kopfschmerzen
- verminderte Aufmerksamkeit
- veränderte mentale Funktionen
- Verlust des Sehvermögens, einschließlich kortikaler Blindheit.
Weitere Details zu diesem Wirkstoff können Sie der vorliegenden Fachinformation entnehmen.
Wirkstoff-Informationen
Fachinformation Sutent, European Medicines Agency
-
SuniTAD® 12,5 mg Hartkapseln
TAD Pharma GmbH
-
SuniTAD® 25 mg Hartkapseln
TAD Pharma GmbH
-
SuniTAD® 50 mg Hartkapseln
TAD Pharma GmbH
-
Sunitinib Accord 12,5 mg Hartkapseln
Accord Healthcare GmbH
-
Sunitinib Accord 25 mg Hartkapseln
Accord Healthcare GmbH
-
Sunitinib Accord 50 mg Hartkapseln
Accord Healthcare GmbH
-
Sunitinib AL 12,5 mg Hartkapseln
ALIUD PHARMA® GmbH
-
Sunitinib AL 25 mg Hartkapseln
ALIUD PHARMA® GmbH
-
Sunitinib AL 37,5 mg Hartkapseln
ALIUD PHARMA® GmbH
-
Sunitinib AL 50 mg Hartkapseln
ALIUD PHARMA® GmbH
-
Sunitinib AqVida 12,5 mg Hartkapseln
AqVida GmbH
-
Sunitinib AqVida 25 mg Hartkapseln
AqVida GmbH
-
Sunitinib AqVida 37,5 mg Hartkapseln
AqVida GmbH
-
Sunitinib AqVida 50 mg Hartkapseln
AqVida GmbH
-
Sunitinib beta 12,5 mg Hartkapseln
betapharm Arzneimittel GmbH
-
Sunitinib beta 25 mg Hartkapseln
betapharm Arzneimittel GmbH
-
Sunitinib beta 37,5 mg Hartkapseln
betapharm Arzneimittel GmbH
-
Sunitinib beta 50 mg Hartkapseln
betapharm Arzneimittel GmbH
-
Sunitinib Bluefish 12,5 mg Hartkapseln
Bluefish Pharma GmbH
-
Sunitinib Bluefish 25 mg Hartkapseln
Bluefish Pharma GmbH
-
Sunitinib Bluefish 50 mg Hartkapseln
Bluefish Pharma GmbH
-
Sunitinib Denk 12,5 mg Hartkapseln
Denk Pharma GmbH & Co. KG
-
Sunitinib Denk 25 mg Hartkapseln
Denk Pharma GmbH & Co. KG
-
Sunitinib Denk 50 mg Hartkapseln
Denk Pharma GmbH & Co. KG
-
Sunitinib Glenmark 12,5 mg Hartkapseln
Glenmark Arzneimittel GmbH
-
Sunitinib Glenmark 25 mg Hartkapseln
Glenmark Arzneimittel GmbH
-
Sunitinib Glenmark 50 mg Hartkapseln
Glenmark Arzneimittel GmbH
-
Sunitinib Heumann 12,5 mg Hartkapseln
Heumann Pharma GmbH & Co. Generica KG
-
Sunitinib Heumann 25 mg Hartkapseln
Heumann Pharma GmbH & Co. Generica KG
-
Sunitinib Heumann 50 mg Hartkapseln
Heumann Pharma GmbH & Co. Generica KG
-
Sunitinib HEXAL® 12,5 mg Hartkapseln
Hexal AG
-
Sunitinib HEXAL® 25 mg Hartkapseln
Hexal AG
-
Sunitinib HEXAL® 37,5 mg Hartkapseln
Hexal AG
-
Sunitinib HEXAL® 50 mg Hartkapseln
Hexal AG
-
Sunitinib Holsten 12,5 mg Hartkapseln
Holsten Pharma GmbH
-
Sunitinib Holsten 25 mg Hartkapseln
Holsten Pharma GmbH
-
Sunitinib Holsten 50 mg Hartkapseln
Holsten Pharma GmbH
-
Sunitinib-ratiopharm® 12,5 mg Hartkapseln
ratiopharm GmbH
-
Sunitinib-ratiopharm® 25 mg Hartkapseln
ratiopharm GmbH
-
Sunitinib-ratiopharm® 50 mg Hartkapseln
ratiopharm GmbH
-
Sunitinib STADA 12,5 mg Hartkapseln
STADAPHARM GmbH
-
Sunitinib STADA 25 mg Hartkapseln
STADAPHARM GmbH
-
Sunitinib STADA 50 mg Hartkapseln
STADAPHARM GmbH
-
Sunitinib Vivanta 12,5 mg Hartkapseln
Vivanta Generics s.r.o
-
Sunitinib Vivanta 25 mg Hartkapseln
Vivanta Generics s.r.o
-
Sunitinib Vivanta 37,5 mg Hartkapseln
Vivanta Generics s.r.o
-
Sunitinib Vivanta 50 mg Hartkapseln
Vivanta Generics s.r.o
-
Sunitinib Zentiva 12,5 mg Hartkapseln
Zentiva Pharma GmbH
-
Sunitinib Zentiva 25 mg Hartkapseln
Zentiva Pharma GmbH
-
Sunitinib Zentiva 50 mg Hartkapseln
Zentiva Pharma GmbH














