Trastuzumab
Trastuzumab ist ein rekombinanter humanisierter monoklonaler IgG1-Antikörper, der gegen den menschlichen epidermalen Wachstumsfaktorrezeptor 2 (HER2) gerichtet ist und zur Behandlung von Brustkrebs angewendet wird.
Trastuzumab: Übersicht
Anwendung
Der monoklonale Antikörper Trastuzumab (Herceptin) wurde im Jahr 2020 als erste zielgerichtete Therapie bei HER2-positivem Brustkrebs und metastasiertem HER2-positivem Magenkarzinom zugelassen und wird als intravenöse Infusion angewendet.
Metastasierter Brustkrebs
Bei der Behandlung von HER2-positivem metastasiertem Brustkrebs kann Trastuzumab als Monotherapie angewendet werden, wenn die Patienten zuvor mindestens zwei Chemotherapieregime erhalten haben. Diese muss mindestens ein Anthrazyklin und ein Taxan enthalten haben, es sei denn, diese Behandlung ist für die Patienten nicht geeignet. Bei Patienten mit positivem Hormonrezeptor-Status muss ferner eine Hormonbehandlung erfolglos gewesen sein, es sei denn, diese Behandlung ist für die Patienten nicht geeignet.
Haben Patienten mit HER2-positivem metastasiertem Brustkrebs noch keine Chemotherapie erhalten kann Trastuzumab angewendet werden:
- in Kombination mit Paclitaxel, wenn für sie ein Anthrazyklin ungeeignet ist oder
- in Kombination mit Docetaxel
Zur Behandlung von postmenopausalen Patienten mit Hormonrezeptor-positivem metastasiertem Brustkrebs kann Trastuzumab in Kombination mit einem Aromatasehemmer angewendet werden
Brustkrebs im Frühstadium
Bei Brustkrebs im Frühstadium darf Trastuzumab nur dann angewendet werden, wenn die Tumore entweder eine HER2-Überexpression oder eine HER2-Genamplifikation aufweisen, die durch eine genaue und validierte Untersuchung ermittelt wurde.
Trastuzumab kann angewendet werden:
- nach einer Operation, Chemotherapie (neoadjuvant oder adjuvant) und Strahlentherapie
- nach adjuvanter Chemotherapie mit Doxorubicin und Cyclophosphamid, in Kombination mit Paclitaxel oder Docetaxel
- in Kombination mit adjuvanter Chemotherapie mit Docetaxel und Carboplatin
- in Kombination mit neoadjuvanter Chemotherapie, gefolgt von adjuvanter Therapie mit Trastuzumab, bei lokal fortgeschrittenem (einschließlich entzündlichem) Brustkrebs oder Tumoren > 2 cm im Durchmesser
Metastasiertes Magenkarzinom
Trastuzumab in Kombination mit Capecitabin oder 5-Fluorouracil und Cisplatin kann ferner auch zur Behandlung von HER2-positivem metastasiertem Adenokarzinom des Magens oder des gastroösophagealen Übergangs angewendet werden, wenn die Patienten bisher keine Krebstherapie gegen ihre metastasierte Erkrankung erhalten haben.
Wirkmechanismus
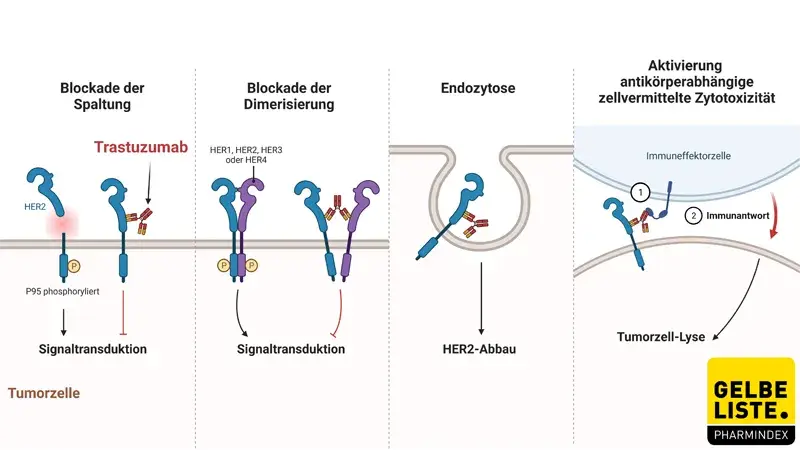
Trastuzumab ist ein rekombinanter humanisierter monoklonaler IgG1-Antikörper, der gegen die extrazelluläre Domäne des HER-2-Rezeptors (ErbB-2) gerichtet ist. Der HER-2-Rezeptor besteht aus einer extrazellulären Ligandenbindungsdomäne, einer Transmembranregion und einer intrazellulären oder zytoplasmatischen Tyrosinkinasedomäne. Trastuzumab bindet an die extrazelluläre Domäne von HER-2 und verhindert so die Spaltung der extrazellulären Domäne von HER-2 und dadurch die Aktivierung des Rezeptors; Darüber hinaus blockiert der Antikörper die Dimerisierung von HER-2 und vermittelt die Aktivierung von antikörperabhängiger zellvermittelter Zytotoxizität (ADCC), was zur Lyse von Tumorzellen führt und fördert die Internalisierung von HER-2.
Pharmakokinetik
Trastuzumab wird zu Peptiden und Aminosäuren metabolisiert. Die Elimination verläuft über einen vielschichtigen Prozess, der spezifisch durch Epithelzellen vermittelt wird. Trastuzumab bindet an HER-2 und wird intrazellulär metabolisiert. Die Folge der intrazellulären Bindung erklärt eine dosisabhängige (nichtlineare) Elimination. Die Elimination von Antikörpern aus dem Plasma ist komplex und hängt von Faktoren wie der Genetik und dem klinischen Zustand des Patienten ab. Die Halbwertszeit von Trastuzumab beträgt etwa 28 Tage. Die Auswaschphase beträgt bis zu 24 Wochen nach Beendigung der Trastuzumab-Behandlung. Die renale Ausscheidung von Trastuzumab ist sehr gering.
Dosierung
Trastuzumab kann bei der Behandlung von Brustkrebs als dreiwöchentliche oder als wöchentliche Anwendung verabreicht werden. Beim metastasierten Magenkarzinom kommt nur die dreiwöchentliche Gabe zum Einsatz.
Bei metastasiertem Brustkrebs und Brustkrebs im Frühstadium beträgt die empfohlene Initialdosis bei der dreiwöchentlichen Anwendung 8 mg/kg Körpergewicht und geht dann drei Wochen nach der Initialdosis in eine Erhaltungsdosis von 6 mg/kg Körpergewicht über. Bei wöchentlicher Anwendung beläuft sich die Initialdosis auf 4 mg/kg Körpergewicht und geht dann eine Woche nach der Initialdosis in die wöchentliche Erhaltungsdosis von 2 mg/kg Körpergewicht über.
Die Therapie des metastasierten Magenkarzinoms wird mit einer Initialdosis von 8 mg/kg Körpergewicht Trastuzumab eingeleitet und geht dann drei Wochen nach der Initialdosis in eine Erhaltungsdosis mit dreiwöchentlichen Intervallen von 6 mg/kg Körpergewicht über.
Versäumte Dosis
Wird eine Dosis um eine Woche oder weniger versäumt hat, sollte die übliche Erhaltungsdosis (wöchentliche Anwendung: 2 mg/kg; dreiwöchentliche Anwendung: 6 mg/kg) sobald wie möglich nachgeholt werden. Die nachfolgenden Erhaltungsdosen werden dann entweder 7 Tage oder 21 Tage später verabreicht.
Wird eine Dosis um mehr als eine Woche versäumt, sollte sobald wie möglich eine weitere Initialdosis über ungefähr 90 Minuten verabreicht werden (wöchentliche Anwendung: 4 mg/kg; dreiwöchentliche Anwendung: 8 mg/kg). Die nachfolgenden Erhaltungsdosen werden dann entweder 7 Tage oder 21 Tage später verabreicht.
Nebenwirkungen
Sehr häufige Nebenwirkungen sind:
- kardiale Dysfunktion
- Infusionsreaktionen
- Hämatotoxizität (insbesondere Neutropenie)
- Infektionen
- Nasopharyngitis
- Gewichtsverlust
- Diarrhö, Erbrechen, Übelkeit
- Husten, Epistaxis, Rhinorrhoe
- Erkrankungen der Haut wie Erythem
- Arthralgie, Myalgie
- Asthenie, Schmerzen im Brustkorb, Schüttelfrost, grippeähnliche Symptome
- peripheres Ödem
Wechselwirkungen
Es wurden keine klinisch signifikanten Wechselwirkungen zwischen Trastuzumab und den in klinischen Studien gleichzeitig angewendeten Arzneimitteln beobachtet.
Kontraindikationen
Trastuzumab darf nicht angewendet werden bei bekannter Überempfindlichkeit gegen den Antikörper oder Mausproteine sowie bei schwerer Ruhedyspnoe.
Schwangerschaft
Die Datenlage zum Einfluss einer Trastuzumab-Behandlung auf die Entwicklung des menschlichen Fötus ist begrenzt. Bei schwangeren Frauen, die mit Trastuzumab behandelt wurden, gibt es Berichte einiger Fälle von Oligohydramnion während des zweiten und dritten Trimesters und reversiblem tödlichem Nierenversagen [3]. Eine Behandlung mit Trastuzumab ist nur dann angezeigt, wenn der potenzielle Nutzen für die Mutter das potenzielle Risiko für den Fötus überwiegt, der Fötus muss jedoch streng überwacht werden.
Stillzeit
Während der Behandlung mit Trastuzumab und für sechs Monate nach der letzten Anwendung von Trastuzumab sollte das Stillen vermieden werden.
Verkehrstüchtigkeit
Da es während der Behandlung mit Trastuzumab zu Schwindelgefühl und Somnolenz kommen kann, hat die Behandlung Einfluss auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen. Patienten mit diesen Symptomen sollten angewiesen werden, nicht aktiv am Straßenverkehr teilzunehmen oder Maschinen zu bedienen, bis die Symptome abgeklungen sind.
Wirkstoff-Informationen
- EMA: Fachinformation Herceptin
- Boekhout AH, Beijnen JH, Schellens JH. Trastuzumab. Oncologist. 2011;16(6):800-810. doi:10.1634/theoncologist.2010-0035
- Bader AA, Schlembach D, Tamussino KF, Pristauz G, Petru E. Anhydramnios associated with administration of trastuzumab and paclitaxel for metastatic breast cancer during pregnancy. Lancet Oncol. 2007 Jan; 8(1):79-81. doi: 10.1016/S1470-2045(06)71014-2
Abbildung
Adapted from „4 Mechanisms of Action of Trastuzumab”, by BioRender.com
-
Herceptin 150 mg Aaston Pulver zur Herstellung eines Infusionslösungskonzentrats
Aaston Healthcare GmbH
-
Herceptin 150 mg Abacus Pulver zur Herstellung eines Infusionslösungskonzentrats
Abacus Medicine A/S
-
Herceptin 150 mg axicorp Pulver zur Herstellung eines Infusionslösungskonzentrats
axicorp Pharma B.V.
-
Herceptin 150 mg Canoma Pulver zur Herstellung eines Infusionslösungskonzentrats
Canoma Pharma GmbH
-
Herceptin 150 mg CC-Pharma Pulver zur Herstellung eines Infusionslösungskonzentrats
CC Pharma GmbH
-
Herceptin 150 mg Eurim Pulver zur Herstellung eines Infusionslösungskonzentrats
Eurim-Pharm Arzneimittel GmbH
-
Herceptin 150 mg Haemato-Pharm Pulver zur Herstellung eines Infusionslösungskonzentrats
HAEMATO PHARM GmbH
-
Herceptin 150 mg hvd Pulver zur Herstellung eines Infusionslösungskonzentrats
hvd medical GmbH
-
Herceptin 150 mg Inopha Pulver zur Herstellung eines Infusionslösungskonzentrats
Inopha GmbH
-
Herceptin 150 mg kohlpharma Pulver zur Herstellung eines Infusionslösungskonzentrats
kohlpharma GmbH
-
Herceptin 150 mg Medicopharm Pulver zur Herstellung eines Infusionslösungskonzentrats
Medicopharm AG
-
Herceptin 150 mg Orifarm Pulver zur Herstellung eines Infusionslösungskonzentrats
Orifarm GmbH
-
Herceptin 150 mg Paranova Pulver zur Herstellung eines Infusionslösungskonzentrats
Paranova Pack A/S
-
Herceptin® 150 mg Pulver zur Herstellung eines Infusionslösungskonzentrats
Roche Pharma AG
-
Herceptin 150 mg SynCo pharma Pulver zur Herstellung eines Infusionslösungskonzentrats
SynCo pharma B.V.
-
Herceptin 150mg Nmg Pharma Pulver zur Herstellung eines Infusionslösungskonzentrats
NMG Pharma GmbH
-
Herceptin 600 mg Abacus Injektionslösung in einer Durchstechflasche
Abacus Medicine A/S
-
Herceptin 600 mg ACA Injektionslösung in einer Durchstechflasche
A.C.A. Müller ADAG Pharma AG
-
Herceptin 600 mg Allomedic Injektionslösung in einer Durchstechflasche
Allomedic GmbH
-
Herceptin 600 mg axicorp Injektionslösung in einer Durchstechflasche
axicorp Pharma GmbH
-
Herceptin 600 mg Canoma Injektionslösung in einer Durchstechflasche
Canoma Pharma GmbH
-
Herceptin 600 mg CC Pharma Injektionslösung in einer Durchstechflasche
CC Pharma GmbH
-
Herceptin 600 mg Eurim Injektionslösung in einer Durchstechflasche
Eurim-Pharm Arzneimittel GmbH
-
Herceptin 600 mg FD Pharma Injektionslösung in einer Durchstechflasche
FD Pharma GmbH
-
Herceptin 600 mg Haemato-Pharm Injektionslösung in einer Durchstechflasche
HAEMATO PHARM GmbH
-
Herceptin 600 mg hvd Injektionslösung in einer Durchstechflasche
hvd medical GmbH
-
Herceptin® 600 mg Injektionslösung in einer Durchstechflasche
Roche Pharma AG
-
Herceptin 600 mg kohlpharma Injektionslösung in einer Durchstechflasche
kohlpharma GmbH
-
Herceptin 600 mg Medicopharm Injektionslösung in einer Durchstechflasche
Medicopharm AG
-
Herceptin 600 mg Nmg Pharma Injektionslösung in einer Durchstechflasche
NMG Pharma GmbH
-
Herceptin 600 mg Orifarm Injektionslösung in einer Durchstechflasche
Orifarm GmbH
-
Herceptin 600 mg Originalis Injektionslösung in einer Durchstechflasche
Originalis B.V.
-
Herceptin 600 mg Paranova Injektionslösung in einer Durchstechflasche
Paranova Pack A/S
-
Herceptin 600 mg SynCo pharma Injektionslösung in einer Durchstechflasche
SynCo pharma B.V.
-
Herzuma 150 mg Abacus Pulver für ein Konzentrat zur Herstellung einer Infusionslösung
Abacus Medicine A/S
-
Herzuma 150 mg BB Farma Pulver für ein Konzentrat zur Herstellung einer Infusionslösung
BB Farma S.R.L.
-
Herzuma 150 mg CC Pharma Pulver für ein Konzentrat zur Herstellung einer Infusionslösung
CC Pharma GmbH
-
Herzuma 150 mg European Pulver für ein Konzentrat zur Herstellung einer Infusionslösung
European Pharma B.V.
-
Herzuma 150 mg FD Pharma Pulver für ein Konzentrat zur Herstellung einer Infusionslösung
FD Pharma GmbH
-
Herzuma 150 mg Medicopharm Pulver für ein Konzentrat zur Herstellung einer Infusionslösung
Medicopharm AG
-
Herzuma 150 mg Orifarm Pulver für ein Konzentrat zur Herstellung einer Infusionslösung
Orifarm GmbH
-
Herzuma® 150 mg Pulver für ein Konzentrat zur Herstellung einer Infusionslösung
Celltrion Healthcare Deutschland GmbH
-
Herzuma 150 mg Synco Pharma Pulver für ein Konzentrat zur Herstellung einer Infusionslösung
SynCo pharma B.V.
-
Herzuma 150mg Emra Pulver für ein Konzentrat zur Herstellung einer Infusionslösung
Emra-Med Arzneimittel GmbH
-
Herzuma 420 mg Abacus Pulver für ein Konzentrat zur Herstellung einer Infusionslösung
Abacus Medicine A/S
-
Herzuma 420 mg ACA Pharm Pulver für ein Konzentrat zur Herstellung einer Infusionslösung
A.C.A. Müller ADAG Pharma AG
-
Herzuma 420 mg CC Pharma Pulver für ein Konzentrat zur Herstellung einer Infusionslösung
CC Pharma GmbH
-
Herzuma 420 mg Emra Pulver für ein Konzentrat zur Herstellung einer Infusionslösung
Emra-Med Arzneimittel GmbH
-
Herzuma 420 mg Eurim Pulver für ein Konzentrat zur Herstellung einer Infusionslösung
Eurim-Pharm Arzneimittel GmbH
-
Herzuma 420 mg Haemato Pharm Pulver für ein Konzentrat zur Herstellung einer Infusionslösung
HAEMATO PHARM GmbH