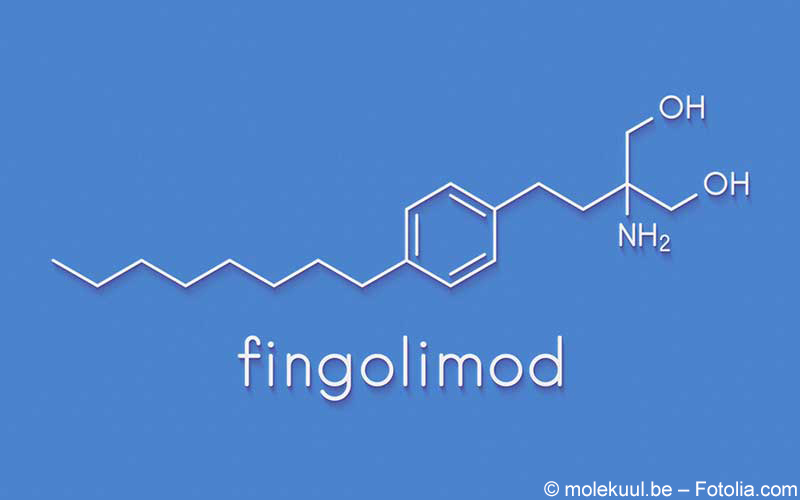
Die Zunahme der Beeinträchtigung bei Abbruch der Fingolimod-Therapie sei so schwerwiegend, dass sie zu einer dauerhaften Invalidität führen kann, so die amerikanische Lebensmittelüberwachungs- und Arzneimittelbehörde (FDA). Fingolimod von Novartis ist eines von mehreren Medikamenten, die zur Behandlung einer schubförmig-remittierend verlaufenden Multiplen Sklerose (MS) indiziert sind. Das Medikament wurde 2010 in den USA und 2011 in der EU zugelassen.
Empfehlungen der FDA an Ärzte
Die FDA empfiehlt Ärzten:
- Patienten vor Behandlungsbeginn mit Fingolimod über das potenzielle Risiko einer schwerwiegenden Verschlechterung der MS nach Beendigung der Therapie zu informieren.
- Patienten bei Beendigung der Fingolimod-Therapie sorgfältig auf Anzeichen einer Exazerbation ihrer Erkrankung zu beobachten und entsprechend zu behandeln.
- Patienten anzuraten, sofort einen Arzt aufzusuchen, wenn nach dem Absetzen von Fingolimod neue oder stärkere Symptome der MS auftreten, zum Beispiel Schwäche, Schwierigkeiten beim Bewegen von Armen oder Beinen, Veränderungen im Denken, beim Sehen oder beim Gleichgewicht.
- bei einer Verschlechterung der Erkrankung eine Magnetresonanztomographie (MRT) durchzuführen, um ggf. neue bzw. vergrößerte Läsionen zu detektieren und bei Bedarf mit einer geeigneten Behandlung zu beginnen.
- Patienten zu ermutigen, den Medikamentenleitfaden zu lesen, den sie mit ihrer Fingolimod-Verordnung erhalten haben und in dem Nutzen und Risiken des Medikamentes erklärt werden.
35 Exazerbationen in 8 Jahren
Seit Markteinführung im September 2010 bis Februar 2018 wurden der FDA 35 Fälle von stark erhöhter Krankheitsaktivität bekannt, die 2 bis 24 Wochen nach Beendigung der Fingolimod-Therapie auftraten und mit mehreren, im MRT sichtbaren, neuen Läsionen einhergingen. Möglicherweise könnte es weitere Fälle geben, die bisher nicht gemeldet wurden, vermutet die FDA.
Die Patienten waren zuvor 7 bis 96 Monate lang mit Fingolimod behandelt worden. Die häufigsten Gründe für den Therapieabbruch waren geplante bzw. eingetretene Schwangerschaft, außerdem mangelnde Wirksamkeit, Lymphopenie, Infektionen oder Krebs.
Bei 29 Patienten trat die Verschlechterung in den ersten 12 Wochen nach dem Absetzen auf. Dabei nahm die MS-Symptomatik sehr viel stärker zu als bei einem typischen MS-Schub. Mehrere Patienten, die zuvor ohne Hilfe gehen konnten, waren nach dem Absetzen auf einen Rollstuhl angewiesen oder wurden sogar dauerhaft bettlägerig. Nur ein Teil der Patienten erholte sich vollständig von dem Rückfall: sechs Patienten kehrten wieder auf das Niveau der Behinderung zurück, das sie vor oder während der Fingolimod-Therapie hatten. 17 Patienten erholten sich nur teilweise, acht Patienten erlebten eine dauerhafte Invalidität bzw. keine Genesung.
Behandlung der verstärkten MS-Symptomatik
Zur Eindämmung der Exazerbation wurden von den Ärzten unterschiedliche Maßnahmen ergriffen, wobei allen 35 Patienten zunächst Kortikosteroide verabreicht wurden. Von den sechs Patienten, die sich vollständig erholten hatten, erhielten drei intravenös Methylprednisolon. Die drei anderen wurden einer Plasmapherese unterzogen, mit intrathekaler Triamcinolon-Gabe oder wieder mit Fingolimod behandelt. Bei anderen Patienten wurden zur Behandlung der verstärkten MS-Symptomatik Natalizumab, Cyclophosphamid, Rituximab, Dimethylfumarat, Glatirameracetat, Methotrexat oder ebenfalls Plasmapherese und Fingolimod angewandt. Die FDA kann daher keine Empfehlung für eine Behandlungsstrategie geben, die bei Auftreten einer Exazerbation nach Therapieabbruch am besten wirksam wäre.
Ergänzung der Fach- und Gebrauchsinformationen
Die FDA hat jedoch die Fach- und Gebrauchsinformation um eine Warnung vor diesem Risiko ergänzt. In der gültigen deutschen Fachinformation von Gilenya® (Stand Juli 2018) wird bereits auf die Rückkehr von Krankheitsaktivität (Rebound) hingewiesen: „Nach Beendigung von Fingolimod wurde bei einigen Patienten in seltenen Fällen eine schwerwiegende Krankheitsverschlimmerung in der Postmarketing-Phase beobachtet. Die Möglichkeit eines erneuten Auftretens einer außergewöhnlich hohen Krankheitsaktivität sollte berücksichtigt werden…. Wenn das Absetzen von Gilenya erforderlich ist, sollten Patienten während dieser Zeit auf maßgebliche Anzeichen eines möglichen Rebounds überwacht werden“.