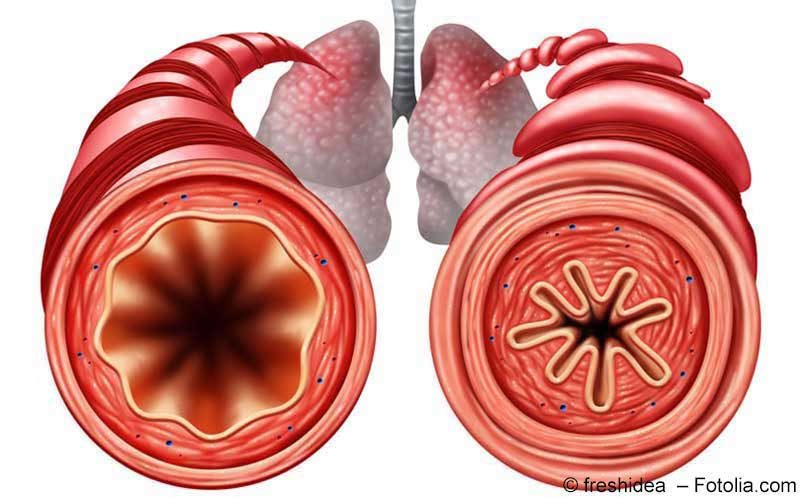
Dupixent ist ein humaner monoklonaler Antikörper, der die in den Atemwegen beobachtete Entzündung durch Hemmung der Signalgebung zweier Schlüsselproteine (Interleukin-4 und Interleukin-13) reduziert. Beide Proteine spielen eine zentrale Rolle bei der Typ-2-Inflammation, die bestimmten Asthmaformen und anderen allergischen Erkrankungen zugrunde liegt, Die Wirkung von Dupilumab ist mit einer Senkung der Konzentration von Biomarkern der Typ-2-Inflammation, wie fraktioniertes exhaliertes Stickstoffmonoxid (FeNO), Immunglobulin E (IgE) und Eotaxin-3 (CCL26) assoziiert. Dies stellt einen neuen Wirkmechanismus für die verfügbaren therapeutischen Optionen bei Patienten mit schwerem Asthma dar.
Dupilumab ist in der Europäischen Union bereits für erwachsene Patienten mit atopischer Dermatitis zugelassen, die sich für eine systemische Therapie eignen. Zulassungsinhaber ist die Sanofi-Aventis Deutschland GmbH.
Neues Indikationsgebiet für Dupixent
Der Ausschuss für Humanarzneimittel (CHMP) der Europäischen Arzneimittelagentur (EMA) hat am 28. Februar eine positive Empfehlung zum Zulassungsantrag für Dupilumab (Dupixent) bei schwerem Asthma ausgesprochen. In der Stellungnahme empfiehlt der CHMP die Zulassung zur Anwendung bei Erwachsenen und Jugendlichen ab 12 Jahren als Add-on Erhaltungstherapie für schweres Asthma mit Typ-2-Inflammation, gekennzeichnet durch eine erhöhte Anzahl Eosinophiler im Blut und/oder erhöhtes FeNO, das trotz hochdosierter inhalativer Kortikosteroide (ICS) plus einem weiteren zur Erhaltungstherapie angewendeten Arzneimittel unzureichend kontrolliert ist.
Die therapeutischen Optionen sind für Patienten mit schwerem Asthma begrenzt, deren Symptome mit den verfügbaren Behandlungen wie hochdosierten inhalierten Kortikosteroiden nicht kontrolliert werden können.
Studienlage Dupixent bei Asthma
Der Nutzen und die Sicherheit von Dupixent wurden in drei Zulassungsstudien mit insgesamt 2.888 Patienten untersucht. In den durchgeführten klinischen Studien zeigte Dupixent einen Nutzen für die Patienten, indem es schwere Asthma-Exazerbationen reduzierte und die Lungenfunktion verbesserte.
Nebenwirkungen von Dupixent
Die häufigsten Nebenwirkungen von Dupixent sind
- Infektionen
- Augenerkrankungen (Konjunktivitis und verwandte Zustände)
- Reaktionen an der Injektionsstelle
Zulassung steht noch aus
Die vom CHMP auf seiner Sitzung im Februar 2019 verabschiedete Stellungnahme ist ein Zwischenschritt auf dem Weg von Dupixent zum Zugang der Patienten zu dieser neuen Indikation. Die Stellungnahme des CHMP wird nun der Europäischen Kommission zur Annahme einer Entscheidung über eine EU-weite Genehmigung für das Inverkehrbringen übermittelt.
Dupilumab-Entwicklungsprogramm läuft weiter
Das in einer Kooperation von Regeneron und Sanofi entwickelte Dupilumab wird außerdem in verschiedenen weiteren klinischen Entwicklungsprogrammen bei Erkrankungen, denen eine Typ-2-Inflammation zugrunde liegt. Dazu gehören:
- chronische Rhinosinusitis mit Nsenpolypen (Phase II ist abgeschlossen)
- pädiatrische (6 bis 11 Jahre) atopische Dermatitis (Phase III)
- pädiatrische (6 Monate bis 5 Jahre) atopische Dermatitis (Phase II/III)
- adoleszente (12 bis 17 Jahre) atopische Dermatitis (Phase III abgeschlossen)
- pädiatrisches (6 bis 11 Jahre) Asthma (Phase III)
- eosinophile Ösophagitis (Phase II/III)
- Lebensmittel- und Pollenallergien (Phase II)
Eine Studie für chronisch obstruktive Lungenerkrankung (COPD) ist geplant. Dupilumab wird zudem in Kombination mit REGN-3500 untersucht, das auf IL-33 abzielt. Diese möglichen Anwendungen werden derzeit noch erforscht. Ihre Sicherheit und Wirksamkeit wurde von Aufsichtsbehörden bisher nicht beurteilt.