Das vollständige Genom von SARS-CoV-2 steht Wissenschaftlern seit Januar 2020 zur Verfügung. Forscher haben seither verschiedene Mikroskopietechniken eingesetzt, um die 3D-Struktur der Virusproteine detailliert abzubilden. Zusammen ermöglichen diese Informationen Wissenschaftlern die Suche nach neuen Medikamenten zur Behandlung von COVID-19, die speziell seine Struktur und Funktionen adressieren.
In einer neuen Studie suchte ein Forscherteam unter der Leitung von Dr. Tracey Rouault vom Eunice Kennedy Shriver National Institute of Child Health and Human Development (NICHD) des NIH nach neuen Wegen, um auf ein von SARS-CoV-2 produziertes Enzym namens RNA-abhängige RNA Polymerase (RdRp) abzuzielen.
Neues Target RdRp
Sobald SARS-CoV-2 in menschliche Zellen eingedrungen ist benötigt es RdRp, um sein genetisches Material zu kopieren. Das Abschalten von RdRp könnte somit möglicherweise die Virusreplikation stoppen und das Fortschreiten der Krankheit verhindern. Die Ergebnisse wurden am 3. Juni 2021 in Science veröffentlicht.
Frühere Studien zur SARS-CoV-2-RdRp-Struktur legten nahe, dass dieses Zink für seine Funktion benötigt. Allerdings können weniger stabile Cluster aus Eisen und Schwefel (Fe-S) die gleiche strukturelle Rolle übernehmen. Das Team analysierte die Sequenz von RdRp, um zwei potenzielle Lokalisationen für solche Fe-S-Cluster zu identifizieren. Sie zeigten dann, dass an diesen Stellen Eisen und Schwefel und nicht Zink benötigt werden, damit das Protein optimal funktioniert. Als die Forscher Fe-S-Cluster aus RdRp eliminierten, war die Fähigkeit des Enzyms, das genetische Virusmaterial zu kopieren, beeinträchtigt.
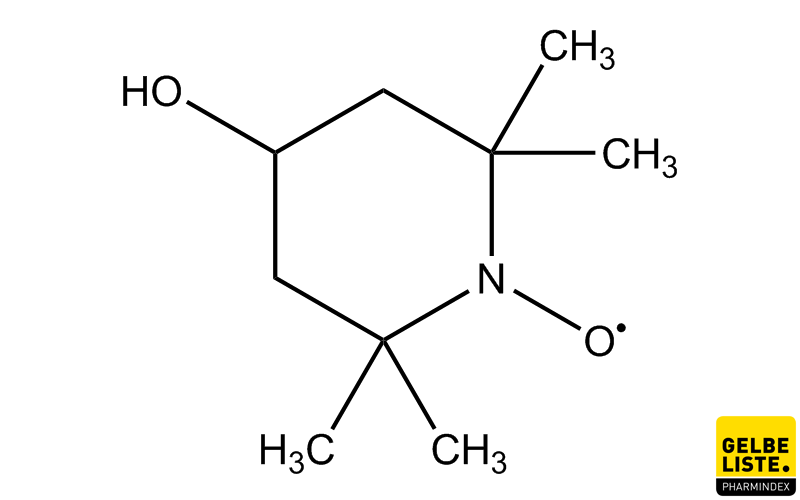
Neue Hoffnung TEMPOL?
Da Fe-S-Cluster fragil sind, testeten die Forscher als nächstes, ob diese durch Medikamente abgebaut werden könnten. Das Team konzentrierte sich auf ein Medikament namens TEMPOL, das Fe-S-Cluster aufbrechen kann. TEMPOL wurde zuvor für andere Anwendungen bei Menschen getestet und scheint keine schwerwiegenden Nebenwirkungen zu haben.