
Die Zulassungsinhaber von Azacitidin 25 mg/ml Pulver zur Herstellung einer Injektionssuspension möchten Sie in Abstimmung mit dem Bundesinstitut für Arzneimittel und Medizinprodukte (BfArM) über Folgendes informieren:
Zusammenfassung
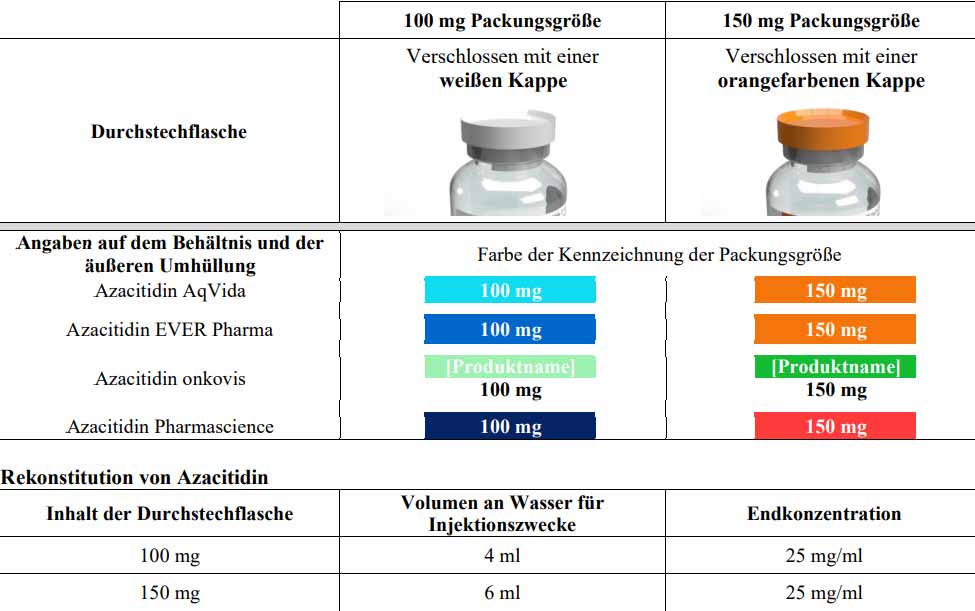
Seit über 10 Jahren ist nur die 100 mg Azacitidin-Packungsgröße auf dem Markt verfügbar. Ab sofort wird aber zusätzlich auch eine Packungsgröße von 150 mg Azacitidin angeboten.Die Einführung dieser zusätzlichen Packungsgröße birgt ein potenzielles Risiko für Medikationsfehler.
Deshalb weisen die Zulassungsinhaber hiermit in Hinblick auf die Rekonstitution auf folgendes Vorgehen hin:
- Das 100 mg Produkt wird mit 4 ml Wasser für Injektionszwecke rekonstituiert.
- Das 150 mg Produkt wird mit 6 ml Wasser für Injektionszwecke rekonstituiert.
- Bitte beachten Sie, dass die Endkonzentration der rekonstituierten Suspension 25 mg/ml beträgt, unabhängig von der Packungsgröße.
Hintergrund zu den Sicherheitsbedenken
Bei der Zubereitung des Arzneimittels sollte sich das medizinische Fachpersonal des potenziellen Risikos eines Medikationsfehlers bewusst sein und die Anweisungen in der Fachinformation des Arzneimittels sogfältig befolgen.
Verpackungsmerkmale
Hier finden Sie weitere Informationen zu den Verpackungsmerkmalen von Azacitidin 25 mg/ml Pulver zur Herstellung einer Injektionssuspension.
 Rote-Hand-Brief Azacitidin
Rote-Hand-Brief Azacitidin








