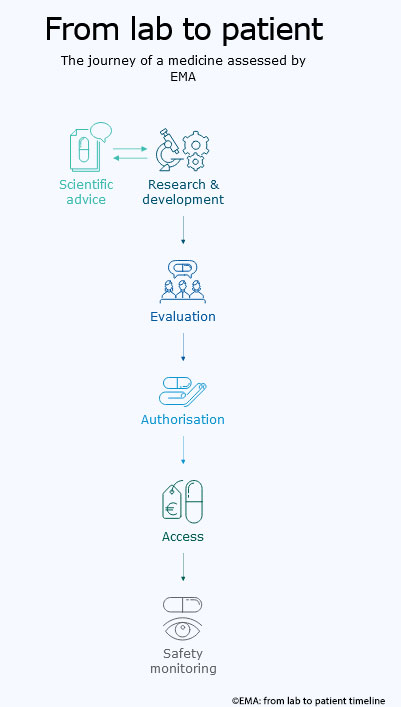
Die EMA gewährleistet die wissenschaftliche Evaluierung, Überwachung und Sicherheitsüberprüfung von Human- und Tierarzneimitteln in der EU. Ihre wichtigsten Aufgaben sind die Zulassung und Überwachung von Arzneimitteln in der EU. Unternehmen beantragen bei ihr die Zulassung für das Inverkehrbringen, die dann von der Europäischen Kommission ausgestellt wird. Wird die Genehmigung erteilt, kann das Arzneimittel in der gesamten EU und im EWR vertrieben werden. Angesichts des breiten Anwendungsbereichs des zentralisierten Verfahrens werden die meisten in Europa vermarkteten Arzneimittel von der EMA zugelassen. Aktuelle Direktorin der EMA ist die irische Pharmazeutin Emer Cooke.
Struktur
Die EMA wird von einem 36-köpfigen Verwaltungsrat geleitet. Die Mitglieder vertreten keinerlei Regierung, Organisation oder Branche. Der Verwaltungsrat beschließt den EMA-Haushalt und verabschiedet ihr Jahresarbeitsprogramm. Der geschäftsführende Direktor der Agentur ist für den laufenden Betrieb, Personalfragen und den Entwurf des Jahresarbeitsprogramms zuständig. Die EMA hat sieben wissenschaftliche Ausschüsseen und mehrere Arbeitsgruppen, an denen sich Tausende von Experten aus ganz Europa beteiligen.
Arbeitsweise
Die EMA arbeitet eng mit den nationalen Regulierungsbehördenen in den EU-Ländern und mit der Generaldirektion Gesundheit der EU-Kommission zusammen. Diese Partnerschaft bildet das Europäische Netzwerk der Arzneimittelzulassungen. Sie steht im Dialog mit Patienten, Beschäftigten im Gesundheitswesen und Universitäten. Außerdem arbeitet sie mit ihren Schwesteragenturen zusammen, darunter dem Europäischen Zentrum für die Prävention und die Kontrolle von Krankheiten (ECDC) und der Europäischen Behörde für Lebensmittelsicherheit (EFSA).
Ihre wissenschaftlichen Ausschüsse erstellen unabhängige Empfehlungen zu Human- und Tierarzneimitteln auf der Grundlage einer umfassenden wissenschaftlichen Auswertung von Daten. Die Agentur veröffentlicht klare und unparteiische Informationen über Arzneimittelen und ihre zugelassenen Anwendungen.