Die monoklonalen Antikörper Casirivimab und Imdevimab (REGN-COV2) dürfen nun zur Behandlung von leichtem bis mittelschwerem COVID-19 bei Erwachsenen und pädiatrischen Patienten (≥12 Jahre mit einem Gewicht von mindestens 40 kg) angewendet werden, die ein hohes Risiko für schwere Verläufe haben wie bspw. Pateinten ab 65 Jahren oder Patienten mit bestimmten chronischen Vorerkrankungen. Die Antikörper müssen zusammen durch intravenöse Infusion verabreicht werden und sind nicht zugelassen für hospitalisierte Patienten oder Patienten die aufgrund von COVID-19 eine Sauerstofftherapie benötigen, da hierfür kein Nutzen nachgewiesen wurde.
Wie wirkt die Antikörper-Kombination?
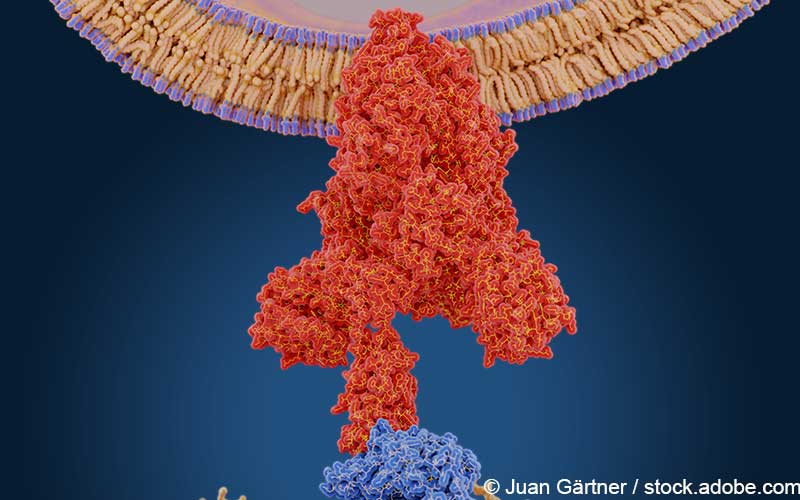
Casirivimab und Imdevimab binden an zwei Regionen der Spike-Protein-Rezeptor-Bindungsdomäne (RBD) von SARS-CoV-2, wodurch das Virus daran gehindert wird an Zellen anzudocken und in sie einzudringen. Die Kombination aus zwei Antikörpern soll nach Angaben des Herstellers das Risiko reduzieren, dass die Therapie durch Escape-Mutationen, die die Konformation des Ziel-Proteins verändern, unwirksam wird.
Studienlage
Die Daten, die der Notfallzulassung zugrunde liegen, basieren auf der randomisierten, doppelblinden, placebokontrollierten Phase-I/II-Studie R10933-10987-COV-2067 (NCT04425629) an 799 Probanden. Die Behandlung mit Casirivimab und Imdevimab wurde innerhalb von 3 Tagen nach positivem SARS-CoV-2-Test begonnen. Die Probanden wurden 1:1:1 randomisiert und erhielten entweder eine einzelne intravenöse Infusion von 2.400 mg Casirivimab und Imdevimab (jeweils 1.200 mg) (n=266) oder 8.000 mg Casirivimab und Imdevimab (4.000 mg) (n=267) oder Placebo (n=266). Das Durchschnittsalter betrug 42 Jahre, 7% der Probanden waren 65 Jahre oder älter, 53% der Probanden waren weiblich und 34% wurden als Hochrisikopatienten eingestuft. Der vorab festgelegte primäre Endpunkt war die zeitgewichtete durchschnittliche Änderung (TWA) gegenüber dem Ausgangswert in der Viruslast, gemessen durch RT-qPCR in Nasopharynxabstrichproben.
Ergebnisse
Patienten, die mit Casirivimab und Imdevimab behandelt wurden zeigten eine größere Reduktion der Viruslast als Patienten, die Placebo erhielten. Demnach war die Antikörper-Kombination im primären Endpunkt Placebo überlegen. Der wichtigste Beweis für die Wirksamkeit, war jedoch der vordefinierte sekundäre Endpunkt: Patienten mit einem hohen Risiko für eine Verschlechterung der COVID-19-Symptomatik mussten innerhalb von 28 Tagen nach Verabreichung der Antikörper in 3% der Fälle einen Arzt, ein Krankenhaus oder eine Notaufnahme aufsuchen und in 9% der Fälle, wenn sie Placebo erhalten hatten. Die unterschiedlichen Dosierungen der beiden Antikörper führten hierbei zu ähnlichen Ergebnissen.
Aussicht
Nach Angaben der New York Times erhielt Regeneron von der US-Regierung mehr als 500 Millionen Dollar für die Entwicklung des Medikaments. Die ersten 300.000 Dosen sollen angeblich von der Regierung kostenlos zur Verfügung gestellt werden. Der Arzneimittelhersteller teilte allerdings in einer Erklärung mit, dass die Patienten möglicherweise Kosten an Gesundheitseinrichtungen zahlen müssten, um das Medikament zu bekommen. Das Arzneimittel von Regeneron ist das zweite Antikörper-Medikament mit einer Notfallzulassung für die Behandlung von COVID-19. Bereits am 9. November hatte der US-Pharmaherstellers Eli Lilly für den monoklonalen Antikörper Bamlanivimab eine Notfallzulassung erhalten.














