Bei den zugrundeliegenden Ergebnissen handelt es sich um eine Zwischenanalyse der randomisierten, doppelblinden klinischen Phase-II/III-Studie EPIC-HR (Evaluation of Protease Inhibition for COVID-19 in High-Risk Patients) an 3000 nicht hospitalisierten erwachsenen Risikopatienten mit COVID-19.
Die Patienten bekamen innerhalb von drei Tagen nach Einsetzen der Symptome für fünf Tage alle 12 Stunden entweder Paxlovid oder Placebo. Die primäre Analyse basiert auf Daten von 1219 Erwachsenen, die bis zum 29. September 2021 in die Studie aufgenommen wurden.
Ergebnisse
Nach Angaben von Pfizer mussten gerade einmal 0,8 Prozent (3/389) der Patienten, die Paxlovid erhielten, bis zum 28. Tag nach der Randomisierung ins Krankenhaus eingeliefert werden, verglichen mit 7,0 Prozent der Patienten unter Placebo (27/385). Darüber hinaus kam es in der Kohorte der Probanden, die Paxlovid erhielten zu keinen Todesfällen, im Vergleich zu 10 Todesfällen bei Patienten, die Placebo bekamen.
Behandlungsbedingte Nebenwirkungen waren zwischen Paxlovid (19%) und Placebo (21%) vergleichbar; die meisten waren von leichter Intensität.
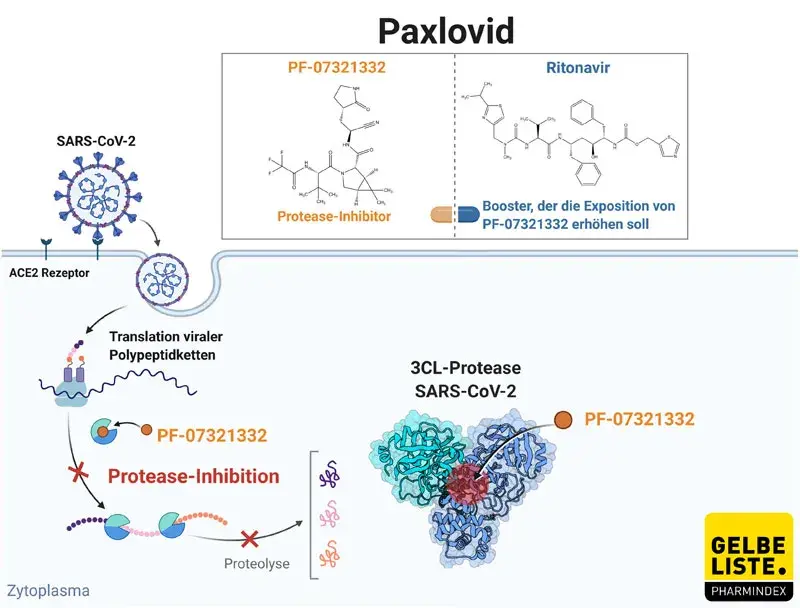
Wie wirkt Paxlovid?
Paxlovid (PF-07321332; Ritonavir) ist eine antivirale Therapie, die aus dem SARS-CoV-2-Cystein-Protease-Inhibitor PF-07321332 und einer niedrigen Dosis Ritonavir besteht. PF-07321332 hemmt die virale Protease-3CL, indem es mit dieser interagiert und so das Schneiden von Polypeptiden verhindert. Da keine bekannte humane Cysteinprotease nach Gln wie PF-07321332 schneidet, bietet dies eine Selektivität für das virale Target gegenüber dem humanen Proteom.
Ritonavir soll dazu beitragen den Abbau von PF-07321332 zu verlangsamen, damit es für längere Zeit im Körper aktiv bleiben kann.