-
Home
-
Krankheiten
Leukämie bezeichnet eine Gruppe von Krebserkrankungen des blutbildenden Systems. Leukämien sind im Vergleich zu anderen Krebserkrankungen eher selten.

Definition
Leukämie bezeichnet eine Gruppe von Krebserkrankungen des blutbildenden Systems, die sich bezüglich Häufigkeit, Ursachen, Behandlungsmöglichkeiten und Heilungsaussichten zum Teil stark voneinander unterscheiden.
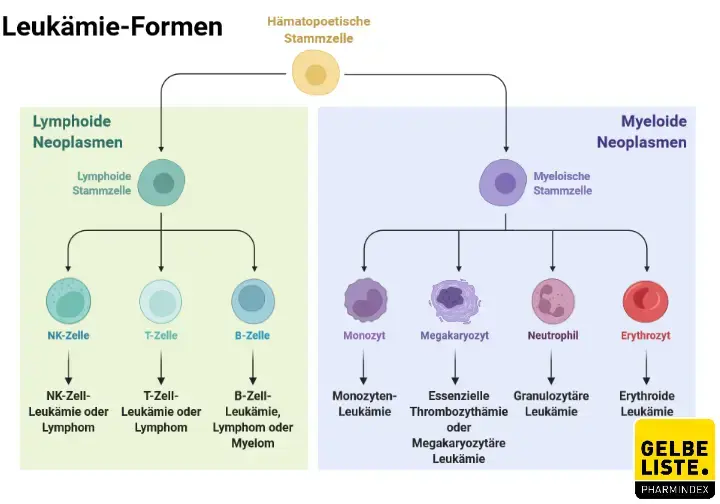
Bösartig entartete Zellen teilen und klonen sich unkontrolliert und führen somit zum Ausbruch von Leukämie. Entartete unreife weiße Blutzellen verdrängen andere Blutbestandteile. Ein Teil der Patienten weist eine stark erhöhte Zahl Leukozyten im Blut auf, die Leukozytenzahl kann bei der Diagnose jedoch auch normal oder sogar erniedrigt sein. Je nach Art der Leukozyten, aus denen die Leukämiezellen hervorgehen, unterscheidet man myeloische und lymphatische Leukämien. Myeloische Leukämien gehen von den Vorstufen der Erythrozyten, Thrombozyten, Granulozyten und Monozyten aus, lymphatische Leukämien von Vorläuferzellen der Lymphozyten.
Von beiden Leukämiearten gibt es im Wesentlichen jeweils eine akut und eine chronisch verlaufende Form. Akute Leukämien können in jedem Lebensalter auftreten. Sie entwickeln sich sehr rasch, gehen in der Regel mit schweren Krankheitssymptomen einher und müssen deshalb umgehend behandelt werden. Eine Behandlung kann die Erkrankung heilen. Chronische Leukämien sind dagegen schleichende Erkrankungen, die oft über einen längeren Zeitraum unbemerkt bleiben. Eine Heilung ist häufig nicht möglich.
Im Wesentlichen unterscheidet man demnach folgende vier Leukämiearten:
Die chronisch lymphatische Leukämie (CLL) wird – ebenso wie die sehr seltene Haarzell-Leukämie – aufgrund Ihres Krankheitsverlaufs zu den Leukämien gezählt. Im Grunde handelt es sich bei diesen Erkrankungen jedoch um Sonderformen der malignen Lymphome. Darüber hinaus gibt es die myelodysplastischen Syndrome (MDS) als Leukämievorstufen, die in eine akute Leukämie übergehen können.
Im Folgenden konzentrieren sich die Informationen im Wesentlichen auf die akute myeloische Leukämie (AML).
Die AML ist in der Regel durch einen Knochenmarkbefall von 20% oder mehr charakterisiert. Die Erkrankung kann in verschiedene Subtypen eingeteilt werden. Dabei stützt sich die FAB-Klassifikation auf morphologische Eigenschaften, die WHO-Klassifikation auf morphologische, zyto- und molekulargenetische Merkmale.
Epidemiologie
Leukämien sind im Vergleich zu anderen Krebserkrankungen eher selten: in Deutschland machen sie etwa 2,7% der Tumorerkrankungen bei Frauen und 3,1% der Tumorerkrankungen bei Männern aus. Jährlich erkranken in Deutschland 19,4 von 100.000 Männern und 14,1 von 100.000 Frauen an Leukämie. Die Mehrzahl davon (96%) sind Erwachsene, 4% sind Kinder unter 15 Jahren. Das mittlere Erkrankungsalter liegt für Männer bei 71, bei Frauen bei 73 Jahren. Das Erkrankungsrisiko sinkt bei Kindern mit zunehmendem Alter und nimmt etwa ab dem 30. Lebensjahr wieder kontinuierlich zu. Die Altersgruppenverteilung ist je nach Leukämieform unterschiedlich.
Von den insgesamt 13.700 Menschen, die 2014 an einer Leukämie erkrankt sind, entfielen etwa 10 % auf die CML, 50 % auf die CLL und 40 % auf die akuten Formen ALL und AML.
Mit über 80 % ist die akute myeloische Leukämie (AML) die häufigste Form akuter Leukämien des Erwachsenen, im Kindesalter bis 15 Jahre macht sie jedoch nur etwa ein Fünftel der Fälle aus. Mit einem medianen Alter von ca. 65 Jahren bei Diagnosestellung gilt AML als Erkrankung des älteren Menschen. Die Häufigkeit der AML beträgt etwa 3,7 Erkrankungen pro 100.000 Einwohner pro Jahr und steigt mit bei Patienten im Alter über 70 Jahre auf über 100 Fälle pro 100.000 Einwohner an.
Ursachen
Leukämien bilden sich wie andere Krebsarten infolge von Genmutationen. Diese Veränderungen sind bei Leukämien wahrscheinlich nicht erblich bedingt, sondern entstehen zufällig, aufgrund bestimmter Veranlagungen oder Umwelteinflüsse.
Als Risikofaktoren für die Entstehung der AML gelten Exposition gegenüber ionisierender Strahlung, Benzolen, Tabak, Mineralölprodukten, Farben, Äthylenoxyden, Herbiziden und Pestiziden. Zytostatika wie Alkylantien und Topoisomerase II-Hemmer (Anthrazykline, Anthrachinone, Epipodophylotoxine) zählen zu den wichtigsten Verursachern. Nach der Anwendung von Alkylantien wird ein Leukämiebeginn nach 4-6 Jahre und Aberrationen an den Chromosomen 5 und/oder 7 beobachtet, nach der Anwendung von Topoisomerase II-Hemmern ein Leukämie-Beginn nach 1-3 Jahren und häufig assoziierte Aberrationen von Chromosom 11 Bande q23, aber auch der balancierten Translokation t(1,17). Weiterhin besteht ein um 40% erhöhtes Erkrankungsrisiko bei aktiven Rauchern.
Die AML zeigt nicht selten Beziehungen zum myelodysplastischen Syndrom (MDS), etwa durch ein MDS in der Vorgeschichte oder MDS-typische Morphologie bzw. Zytogenetik.
Pathogenese
Ursprung der AML ist die pathologische Proliferation klonaler myeloischer Zellen, die meist dem hochproliferativen Progenitorpool (d. h. CD34+/CD38+) oder seltener dem Stammzellpool (d. h. CD34+/CD38-) angehören. Dieser proliferierende Klon überwächst das gesunde Knochenmark und führt zur Depletion der gesunden Hämatopoese mit den daraus resultierenden klinischen Konsequenzen einer Granulozytopenie, Thrombozytopenie und Anämie. Es können verschiedene zytogenetische Aberrationen beobachtet werden: Neben Gentranslokationen wie den Translokationen t(8;21), t(15;17) oder der Inversion inv(16) finden sich auch numerische Veränderungen wie Trisomie 8, Monosomie 7 oder komplexe Veränderungen mit mehr als drei rekurrenten chromosomalen Aberrationen in einem Klon. Auch innerhalb eines Patienten kann die Erkrankung aus genetisch verschiedenen Subklonen bestehen, dabei kann sich der Anteil der Klone über den Krankheitsverlauf ändern.
Symptome
Die Symptome der AML entwickeln sich meist rasch innerhalb weniger Wochen. Viele Patienten fühlen sich kurze Zeit zuvor weitgehend oder ganz gesund. Manche Patienten haben kaum Beschwerden und die Leukämie wird zufällig während einer routinemäßigen Blutuntersuchung entdeckt.
Sehr häufige Symptome
- Anämiebedingte Blässe, Müdigkeit, Abgeschlagenheit, verminderte Leistungsfähigkeit, Kurzatmigkeit, allgemeine Schwäche und Unwohlsein
- Leukopeniebedingtes Fieber und/oder erhöhte Infektanfälligkeit
- Bauchschmerzen und Appetitlosigkeit durch Organbefall von Milz und/oder Leber
- Leukozytose durch die Überproduktion lymphatischer Blasten
Häufige Symptome
- Thrombopeniebedingte Blutungen wie Petechien, Hämatome, Epistaxis, verlängerte Blutungen z. B. nach Zahnarztbesuch oder nach Verletzungen, verlängerte Regelblutungen bei Frauen, selten auch Hirnblutungen.
- Lymphknotenschwellungen am Hals, in den Achselhöhlen oder in der Leiste
- Gelenk- und Knochenschmerzen durch die Ausbreitung der Blasten in den Knochen
Seltene Symptome
- Befall des Gehirns, des Rückenmarks oder der Hirnhaut mit neurologische Veränderungen wie Kopfschmerzen, Sehstörungen, Erbrechen oder Nervenlähmungen
- Hautveränderungen und Chlorome (Einlagerungen von Blasten z. B. in der Haut oder im Knochenmark)
- Atemnot
Bei etwa 60% der Patienten zeigen sich eine Leukozytose, und unabhängig von der Leukozytenzahl leukämische Blasten. Bei einer Leukozytose über 100.000/µl, besteht die Gefahr der Leukostase mit Hypoxie, pulmonalen Verschattungen, retinalen Einblutungen und neurologischen Symptomen (hämatologischer Notfall). Seltener sind aleukämische Verläufe mit normaler oder sogar erniedrigter Leukozytenzahl zu beobachten, die gehäuft bei der sekundären oder therapieassoziierten AML und bei älteren Patienten vorkommen. Bei der myelomonozytär/monoblastär differenzierten AML werden überdurchschnittlich häufig extramedulläre Manifestationen wie Hautinfiltrate, Meningeosis leukaemica, Gingivahyperplasie und Infiltration von Milz und Leber beobachtet.
Diagnostik
Bei Verdacht auf AML sind umfangreiche Untersuchungen des Blutes und Knochenmarks notwendig, um die Diagnose zu sichern. Krankheitsdefinierend ist ein Blastenanteil von ≥20% im peripheren Blut oder im Knochenmark, vor allem in der Abgrenzung gegenüber dem myelodysplastischen Syndrom.
Untersuchungen zur Diagnosesicherung:
- Anamnese und körperlicher Untersuchungsbefund
- Blutbild und Differenzialblutbild
- Knochenmarkzytologie und –zytochemie
- Knochenmarkbiopsie (zwingend notwendig bei punctio sicca)
- Immunphänotypisierung
- Zytogenetik
- FISH; wenn die zytogenetische Analyse nicht erfolgreich ist: Nachweis von Translokationen wie RUNX1-RUNX1T1, CBFB-MYH11, KMT2A (MLL) und EVI1; oder Verlust von Chromosom 5q, 7q oder 17p
- Molekulargenetik (Mutationen):
NPM1
CEBPA
RUNX1
FLT3 (interne Tandemduplikationen (ITD), Mutant-Wildtyp-Quotient)
TKD (Kodon D853 und I836)
TP53
ASXL1 - Molekulargenetik (Genumlagerungen):
PML-RARA
CBFB-MYH11
RUNX1-RUNX1T1
BCR-ABL1
Ergänzende Untersuchungen/Maßnahmen:
- Allgemeinzustand (ECOG/WHO Score)
- Evaluierung der Komorbiditäten (z.B. HCT-CI Score)
- Klinische Chemie, Gerinnung, Urinanalyse
- Schwangerschaftstest
- HLA-Typisierung (ggf. auch der Geschwister) + CMV-Status (bei für die allogene Stammzelltransplantation geeigneten Patienten)
- Hepatitis- und HIV-Serologie
- Röntgen-Thorax
- EKG
- Herz-Echo, Lungenfunktion
- Fertilitätserhaltende Maßnahmen (Kryokonservierung von Spermien) bei Männern mit nicht abgeschlossener Familienplanung
Durch die Kombination aus Morphologie, Zytochemie, Immunphänotypisierung, Zyto- und Molekulargenetik ist die Diagnose AML in der Regel zweifelsfrei zu stellen
Mögliche Differentialdiagnosen sind:
- Akute lymphatische Leukämie
- Akute Leukämie unklarer Linienzugehörigkeit
- Virusinfektionen (z. B. Parvovirus B19, EBV, CMV oder HIV)
- Myelodysplastische Syndrome
- Vitamin B12/Folsäure – Mangelanämie
- Aplastische Anämie
- Leukämisch verlaufende Lymphome
- Myeloproliferative Syndrome
WHO-Klassifikation
In die aktuelle WHO Klassifikation wurden mehrere balancierte Translokationen bzw. Inversionen als eigene Entitäten [t(15;17), t(8;21), inv(16), t(9;11), inv(3)/t(3;3), t(6;9), t(1;22)] sowie zwei molekulargenetisch definierte Entitäten (AML mit NPM1-Mutation und AML mit biallelischer CEBPA-Mutation) aufgenommen. Daneben ist eine weitere Subgruppe der AML über genetische Veränderungen definiert (AML mit Myelodysplasie-assoziierten zytogenetischen Veränderungen). Basierend auf dieser Einteilung sind mittlerweile weit über 50% der Patienten mit AML durch zytogenetische und molekulargenetische Charakteristika klassifizierbar. Damit bietet die neue Klassifikation im Vergleich zur bisher verwendeten FAB-Klassifikation einen deutlichen Fortschritt an Objektivität und Reproduzierbarkeit.
Therapie
Die Therapie der AML sollte an einem hämatologisch-onkologischen Zentrum und im Rahmen einer Therapiestudie durchgeführt werden. Für Zentren, die nicht in eine AML-Studiengruppe integriert sind, wird eine Therapie in Anlehnung an ein gültiges Studienprotokoll empfohlen.
Bei morphologischem Verdacht bzw. zytogenetischem (t(15;17)) oder molekularbiologischem (PML-RARA) Nachweis einer akuten Promyelozytenleukämie (APL, FAB M3) muss umgehend eine Therapie mit All-trans-Retinolsäure (ATRA) eingeleitet werden, gefolgt von einer APL-spezifischen zytostatischen Therapie.
Allgemein gliedert sich die intensive kurativ intendierte Therapie der AML in die Induktionstherapie mit dem Ziel der kompletten Remission (CR) und die Postremissionstherapie zur Erhaltung der CR. Die Chance für das Erreichen einer CR liegt bei jüngeren Patienten bis 50 Jahre bei 70-80%, sinkt bei den über 50 bis 75-Jährigen auf 50-60% und liegt über 75 Jahren nur noch zwischen 30 und 40%. Älteren Patienten mit einem biologischen Alter jenseits 75 Jahren und/oder mit signifikanten Komorbiditäten sollte angesichts hoher Toxizität und Frühsterblichkeit bei einer Chance von nur etwa 10% auf eine Langzeitremission keine intensive, kurativ intendierte Therapie angeboten werden. Ziel einer Therapie ist die Lebensverlängerung mit möglichst guter Lebensqualität. Die Grundlage bildet hierbei die supportive Therapie (Best Suppportive Care, BSC), ggf. unter Hinzunahme einer potentiell lebensverlängernden zytostatischen Behandlung.
Erstlinientherapie
Die Standard-Induktionstherapie (3+7 Schema) bei jüngeren Patienten mit einem biologischen Alter unter 60-65 Jahre und keinen oder wenigen Komorbiditäten beinhaltet die Kombination aus der dreitägigen Gabe eines Anthrazyklins/Anthracendions (z. B. Daunorubicin 60 mg/m², Idarubicin 10-12 mg/m², oder Mitoxantron 10-12mg/m²) und 7 Tage Cytarabin (100-200mg/m² kontinuierlich). Die Induktionschemotherapie sollte sobald als möglich nach Diagnosesicherung beginnen. Patienten, die eine CR erreichen, benötigen eine Konsolidierungstherapie, da ansonsten ein schnelles Rezidiv der AML zu erwarten ist. Die Konsolidierungstherapie kann mit hoch dosiertem Cytarabin oder einer allogenen Blutstammzelltransplantation erfolgen. Die myeloablative Hochdosischemotherapie mit autologer Transplantation weist eine ähnlich niedrige therapieassoziierte Mortalität auf wie hochdosiertes Cytarabin und wird vereinzelt als alternative Konsolidierungsoption eingesetzt.
Bei älteren fitten Patienten mit einem biologischen Alter über 65 Jahren und keinen oder wenigen Komorbiditäten muss beachtet werden, dass sowohl Remissionsraten als auch Langzeitremissionen mit zunehmendem Alter abnehmen und gleichzeitig das Risiko therapieassoziierter Komplikationen steigt. Daher müssen Chancen und Risiken in der Altersgruppe besonders gründlich abgewogen und mit dem Patienten besprochen werden.
Bei Patienten mit einem biologischen Alter über 75 Jahre oder mit signifikanten Komorbiditäten wie diabetischem Spätsyndrom, Leber- oder Nierenerkrankungen, Herzinsuffizienz (EF <30%), ECOG ≥3 oder geringen Heilungschancen auf Grund ungünstiger Zytogenetik (unfit, fragil oder frail) besteht das therapeutische Ziel in einer Lebensverlängerung bei möglichst hoher Lebensqualität.
Rezidivtherapie
Es gibt keine prospektiven, kontrollierten Studien zur Überlegenheit einer definierten Therapiestrategie im Rezidiv der AML. Allgemeiner Konsens ist jedoch die Durchführung einer remissionsinduzierenden Reinduktionstherapie, die intermediär oder hoch dosiertes Ara-C einschließt. Für die Konsolidierung ist die allogene Stammzelltransplantation die Therapie der Wahl.
Nachsorge
AML Patienten sollten klinisch und hämatologisch nachgesorgt werden, um ein Rezidiv möglichst frühzeitig zu entdecken (regelmäßige klinische Vorstellungen, Blutbild- und Knochenmarkskontrollen). Bei klinischem Verdacht auf ein Rezidiv oder auffälligem Blutbild muss eine Knochenmarkuntersuchung erfolgen. Da der größte Teil der Rezidive innerhalb von 18-24 Monaten nach Erreichen der Remission auftritt, werden Blutbildkontrollen aller 1-3 Monate innerhalb der ersten zwei Jahre empfohlen, danach alle 3-6 Monate für die Jahre 3-5.
Prognose
Das Lebensalter und molekulare bzw. zytogenetische Veränderungen haben den stärksten Einfluss auf die Prognose. Mit steigendem Alter sinkt die Chance des Erreichens einer kompletten Remission, gleichzeitig steigt das Rezidivrisiko. Die 5-Jahres-Überlebensraten bei Patienten unter 30 Jahren beträgt 60%, bei Patienten zwischen 45 und 54 Jahren 43%, zwischen 55 und 64 Jahren 23% und sinkt im höheren Alter weiter deutlich ab. Die molekular-zytogenetischen Veränderungen bei Erstdiagnose wurden nach der ELN-Klassifikation von 2010 in vier prognostische Gruppen und nach der aktuellsten Klassifikation von 2016 in drei Gruppen eingeteilt.
Prophylaxe
Es gibt keinen Nachweis für wirksame Maßnahmen zur Vorbeugung und Früherkennung.