Der Start des beschleunigten Zulassungsverfahrens basiert nach Angaben der Arzneimittelbehörde auf vorläufigen Ergebnissen aus Laborstudien (nicht-klinischen Daten) und frühen klinischen Studien mit Erwachsenen. Diese konnten zeigen, dass der Corona-Impfstoff VLA2001 eine Antikörperbildung gegen SARS-CoV-2 auslöst und so potenziell vor COVID-19 schützen kann.
Die EU hat mit Valneva bereits einen Vertrag über die Lieferung von 60 Millionen Impfdosen VLA2001 unterzeichnet.
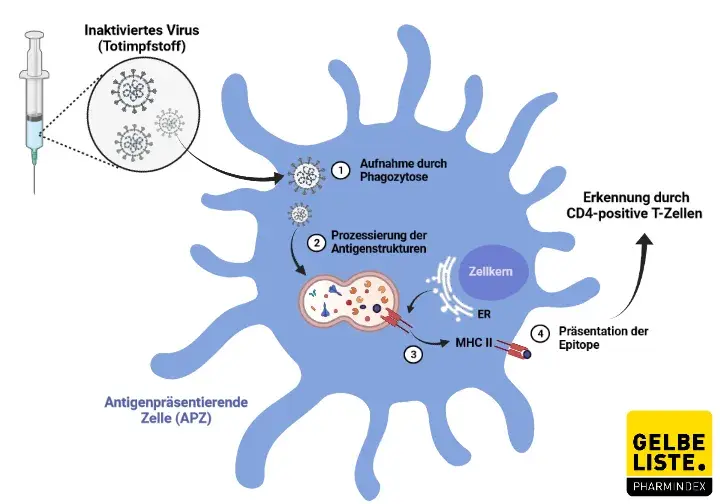
Über VLA2001
VLA2001 ist derzeit der einzige adjuvantierte, inaktivierte Ganzvirus-Impfstoff in Europa. Der Impfstoff besteht aus inaktivierten ganzen Sars-CoV-2-Viruspartikeln mit hoher Spike-Protein-Dichte, in Kombination mit zwei Adjuvantien, Alum und CpG 1018. Die Kombination der beiden Adjuvanzien induzierte in präklinischen Studien höhere Antikörperspiegel als reine Alum-Formulierungen und eine Verschiebung der Immunantwort in Richtung Th1. Nach Angaben von Valneva kann VLA2001 aller Voraussicht nach bei 2 bis 8°C transportiert und gelagert werden.