Aktuelles
Was ist mRNA-1273 und wofür wird es angewendet?
Der Corona-Impfstoff mRNA-1273 wurde von Moderna und dem US-National Institute of Allergy and Infectious Diseases (NIAID) entwickelt. Es handelt sich um einen durch Lipidnanopartikel verkapselten Impfstoff auf mRNA-Basis, der für ein präfusionsstabilisiertes Spike (S)-Protein von SARS-CoV-2 in voller Länge kodiert.
Der Impfstoff wird in Mehrfachdosis-Durchstechflaschen mit 10 Dosen als weiße bis cremefarbene, sterile, konservierungsmittelfreie gefrorene Suspension zur intramuskulären Injektion bereitgestellt. Nach dem Auftauen können maximal 10 Dosen (jeweils 0,5 ml) aus jeder Durchstechflasche entnommen werden.
Wie wird mRNA-1273 angewendet?
- Die Vakzine mRNA-1273 ist eine gefrorene Suspension, die vor der intramuskulären Applikation unter gekühlten Bedingungen zwischen 2°C und 8°C für zweieinhalb Stunden aufgetaut werden muss.
- Vor der Verabreichung sollten die Fläschchen, nachdem sie aufgetaut wurden, 15 Minuten bei Raumtemperatur stehen.
- Alternativ kann der Impfstoff auch eine Stunde lang bei Raumtemperatur zwischen 15°C und 25°C auftauen.
- Nach dem Auftauen und zwischen jeder Entnahme sollen die Fläschchen vorsichtig geschwenkt aber nicht geschüttelt werden.
- Wurde der Impfstoff einmal aufgetaut, darf er nicht wieder eingefroren werden.
CAVE: Anders als bei BNT162b2 wird mRNA-1273 nicht verdünnt.
Lagerung
Die Fläschchen können vor dem ersten Gebrauch bis zu 30 Tage im Kühlschrank zwischen 2°C und 8°C gelagert werden. Nicht durchstochene Fläschchen können für bis zu 12 Stunden zwischen 8°C und 25°C gelagert werden. Nach Entnahme der ersten Dosis sollte die Durchstechflasche zwischen 2°C und 25°C aufbewahrt und nach 6 Stunden verworfen werden.
Dosierung
mRNA-1273 (100 μg) wird intramuskulär im Abstand von 28 Tagen als Serie von zwei Dosen mit jeweils 0,5 ml verabreicht.
Es liegen keine Daten zur Austauschbarkeit von mRNA-1273 mit anderen COVID-19-Impfstoffen vor, um die Impfserie zu vervollständigen. Personen, die eine Dosis des Moderna-Impfstoffs erhalten haben, sollten deshalb auch die zweite Dosis von Moderna erhalten, um die Impfserie abzuschließen.
Wie wirkt mRNA-1273?
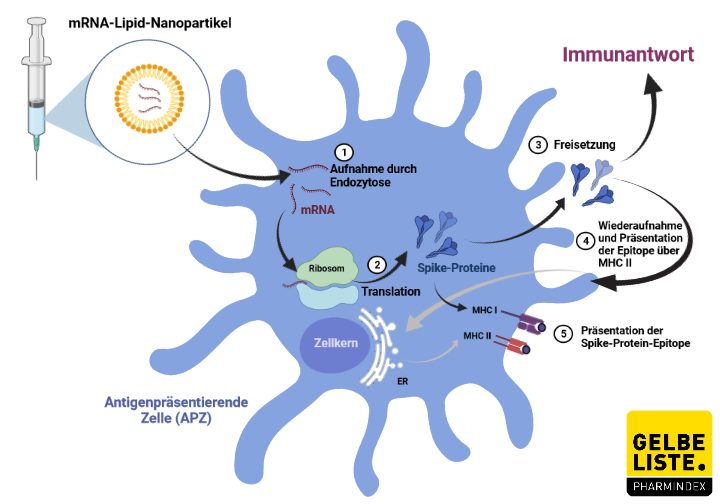
Die Nucleosid-modifizierte mRNA ist in Lipidpartikeln formuliert, die die Abgabe der Nucleosid-modifizierten mRNA in Wirtszellen ermöglicht, wo schließlich das SARS-CoV-2 S-Antigen exprimiert werden kann. Der Impfstoff kodiert für eine Version des Spike-Proteins mit einer Modifikation namens 2P, bei der das Protein zwei stabilisierende Mutationen enthält, bei denen die ursprünglichen Aminosäuren durch Proline ersetzt werden. Sobald das Protein aus der Zelle ausgeschleust wurde, wird es schließlich vom Immunsystem erkannt, das mit der Bildung von Antikörpern beginnt.
Gegenanzeigen
mRNA-1273 soll nicht angewendet werden bei bekannter Vorgeschichte einer schweren allergischen Reaktion (z. B. Anaphylaxie) auf eine Komponente des Impfstoffs.
Folgende Hilfsstoffe sind enthalten:
- das proprietäre, ionisierbare Lipid SM-102
- 1,2-Dimyristoyl-rac-glycero-3-methoxypolyethylenglycol-2000 [PEG2000-DMG]
- Cholesterol
- 1,2-Distearoyl-sn-glycero-3-phosphocholin [DSPC]
- Tromethamin
- Tromethaminhydrochlorid
- Essigsäure
- Natriumacetat
- Saccharose
Nebenwirkungen
Nebenwirkungen, die in der klinischen Studie berichtet wurden, umfassen (Angaben gegenüber Placebo):
- Schmerzen an der Injektionsstelle (83.7% vs. 19.8%)
- Müdigkeit (68,5% vs. 36,1%)
- Kopfschmerzen (63,0% vs. 36,5%)
- Myalgie (59,6% vs. 20,1%)
- Arthralgie (44,8% vs. 17,2%)
- Schüttelfrost (43,4% vs. 9,5%)
- Übelkeit / Erbrechen (21,3% vs. 7,3%)
- Axilläre Lymphadenopathie (10,2% vs. 4,8%)
- Fieber (14,8% vs. 0,6%)
- Schwellung und Erythem an der Injektionsstelle (0.7% vs. <0,1%)
Über lokale Nebenwirkungen, die innerhalb von sieben Tagen nach jeder Dosis auftraten, berichteten 84,2% (nach der ersten Dosis) beziehungsweise 88,8% (nach der zweiten Dosis) der Impfstoffgruppe. In der Placebogruppe berichteten 19,8% beziehungsweise 18,8% über lokale Nebenwirkungen.
Lokale Nebenwirkungen, die länger als sieben Tage nach jeder Dosis anhielten, wurden sowohl von Impfstoffempfängern als auch Personen der Placebogruppe berichtet (3,7% vs. 1,3%). Häufige lokale Reaktionen, die in der jüngeren Alterskohorte bei Impfstoff- vs. Placebo-Empfängern über sieben Tage anhielten, waren Schmerzen (1,5% vs. 0,6%) und axilläre Lymphadenopathie (2,5% vs. 0,7%) sowie in der älteren Alterskohorte Schmerzen (1,2% vs.0,6%) und Erythem (0,7% vs. <0,1%).
Zu den häufigsten systemischen Nebenwirkungen in der Impfstoffgruppe gegenüber der Placebogruppe zählten Kopfschmerzen (63,0% vs. 36,5%), Myalgie (59,6% vs. 20,1%), Arthralgie (44,8% vs. 17,2%) und Schüttelfrost (43,4% vs. 9,5%).
Die am häufigsten berichteten systemischen Nebenwirkungen, die über sieben Tage anhielten, waren in der Impfstoffgruppe gegenüber der Placebogruppe im Alter von 18 bis 64 Jahren Müdigkeit (5,7% vs. 5,0%), Kopfschmerzen (4,8% vs. 4,0%), Myalgie (2,7% vs. 2,7%) und Arthralgie (2,6% vs. 2,8%); in der älteren Kohorte waren es Müdigkeit (5,8% vs. 4,5%), Arthralgie (3,7% vs. 3,8%), Myalgie (2,9% vs. 2,7%) und Kopfschmerzen (2,8% vs. 2,7%).
Wechselwirkungen
Es liegen keine Daten zur Beurteilung der gleichzeitigen Anwendung von mRNA-1273 mit anderen Impfstoffen vor.
Studienlage
Grundlage der Zulassung bildet die klinische Phase-III-Studie mRNA-1273-P3018 (NCT04470427), in der 30.351 Teilnehmer mit negativem SARS-CoV-2-Status zu Studienbeginn im Verhältnis 1:1 randomisiert wurden und entweder intramuskuläre Injektionen von 100 µg des mRNA-1273-Impfstoffs (n=15.181) oder Placebo (n=15.166) an den Tagen 1 und 29 erhielten.
Das Durchschnittsalter betrug 52 Jahre (Bereich 18-95); 22.831 (75,2%) der Teilnehmer waren zwischen18 und 64 Jahre alt und 7.520 (24,8%) der Teilnehmer waren 65 Jahre und älter.
Die demografischen Merkmale der Probanden in der mRNA-1273-Gruppe und der Placebogruppe waren vergleichbar.
Die Randomisierung erfolgte nach Alter und Gesundheitsrisiko:
- 18 bis <65 Jahre ohne Komorbiditäten (kein Risiko für schweren COVID-19-Verlauf),
- 18 bis <65 Jahre mit Komorbiditäten (Risiko für schweren COVID-19-Verlauf)
- ≥ 65 Jahre mit oder ohne Komorbiditäten
Teilnehmer, die immunkomprimiert waren und Teilnehmer mit einer bekannten SARS-CoV-2-Infektion in der Vorgeschichte wurden von der Studie ausgeschlossen.
Die Studie ermöglichte außerdem die Einbeziehung von Teilnehmern mit stabilen vorbestehenden Erkrankungen (keine signifikante Therapieänderung, Verschlechterung der Erkrankung oder Krankenhauseinweisung 3 Monate vor Aufnahme), sowie von Teilnehmern mit stabiler HIV-Infektion.
Insgesamt wurden 24.907 (82,1%) Teilnehmer aufgenommen, die ein erhöhtes berufliches Risiko für eine SARS-CoV-2-Infektion aufwiesen. 7613 Personen (25,1%) waren hiervon im Gesundheitswesen tätig.
Primärer Endpunkt
Der primäre Endpunkt wurde definiert als Wirksamkeit des Impfstoffs zur Verhinderung von protokolldefiniertem COVID-19 bis mindestens 14 Tage nach der zweiten Dosis. Für die Wirksamkeitsanalyse waren nach Studiendesign 151 COVID-19-Fälle vorgesehen.
Wirksamkeit von 94 Prozent
Ein erster Zwischenanalysezeitpunkt erfolgte bei 53 COVID-19-Fällen und ein zweiter bei 106 COVID-19-Fällen. Aus den Daten ließ sich eine Impfstoffwirksamkeit, die mindestens 14 Tage nach der zweiten Dosis auftrat, von 94,1% (95%-Konfidenzintervall von 89,3% bis 96,8%) ableiten. In der Impfstoffgruppe wurden 11 COVID-19-Fälle gemeldet, wohingegen es in der Placebogruppe 185 Fälle waren.