
Die Firma Bristol Myers Squibb informiert in Abstimmung mit der Europäischen Arzneimittelagentur (EMA) und dem Bundesinstitut für Arzneimittel und Medizinprodukte (BfArM) über Folgendes.
Der Hersteller informiert über das Risiko von Medikationsfehlern bei der Anwendung von Nulojix (Belatacept) aufgrund einer Änderung der Erhaltungsdosis.

Die Firma Bristol Myers Squibb informiert in Abstimmung mit der Europäischen Arzneimittelagentur (EMA) und dem Bundesinstitut für Arzneimittel und Medizinprodukte (BfArM) über Folgendes.
Nulojix ist in Kombination mit Kortikosteroiden und einer Mycophenolsäure (MPA) für die Prophylaxe der Transplantatabstoßung bei erwachsenen Empfängern eines Nierentransplantats angezeigt.
Das Herstellungsverfahren für den Wirkstoff von Nulojix (Belatacept) wurde geändert. Dabei handelt es sich um einen Wechsel von Prozess C (derzeitiger Prozess) zu Prozess E (neuer Prozess).
Die Elimination von Belatacept, das nach Verfahren E hergestellt wird, erfolgt schneller als bei Verfahren C. Es wird erwartet, dass die schnellere Elimination zu einer niedrigeren Minimalkonzentration (Cmin) von Belatacept während der Erhaltungsphase führt, wenn Patienten Belatacept aus dem Prozess E verabreicht wird, verglichen mit dem Prozess C in der gleichen Dosierung.
Um der schnelleren Elimination von Belatacept mit Prozess E Rechnung zu tragen, wurde die Erhaltungsdosis von 5mg/kg (Prozess C) auf 6 mg/kg erhöht. Die Erhaltungsdosis bei Prozess E, die 6 mg/kg beträgt, soll alle 4 Wochen (± 3 Tage) per intravenöser Infusion verabreicht werden, beginnend am Ende von Woche 16 nach der Transplantation.
Etwa ein bis zwei Monate lang werden sich Nulojix nach Prozess C und nach Prozess E gleichzeitig auf dem Markt befinden. Eine Verwechslung der Produkte kann zu Medikationsfehlern führen, die eine Über- oder Unterdosierung von Belatacept zur Folge haben. Deshalb ist es wichtig, dass das medizinische Fachpersonal die Dosierung für das jeweilige Produkt, welches verabreicht werden soll, überprüft, um die entsprechenden Dosisanpassungen für gewichtsbasierte Dosisberechnungen vorzunehmen.
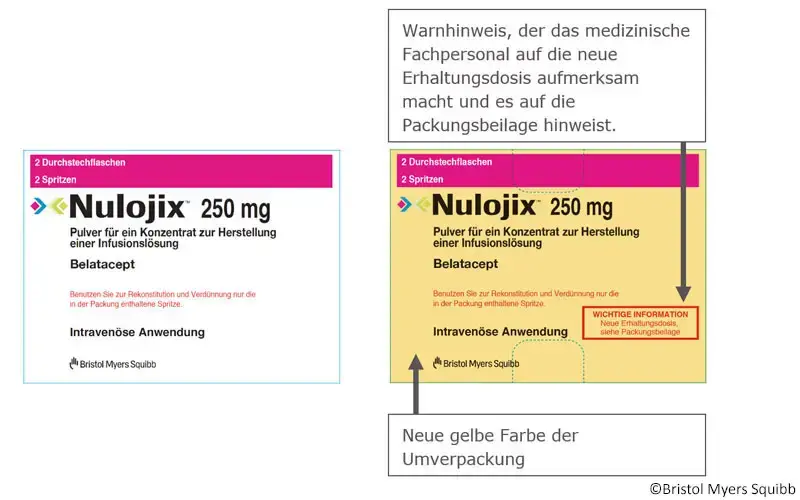
Um das medizinische Fachpersonal auf die Änderung der Dosierung aufmerksam zu machen und das Risiko von Dosierungsfehlern während der Übergangsphase zu verringern, werden die folgenden Änderungen an der Verpackung des Fertigprodukts Nulojix (Prozess E) vorgenommen.
N1-Packung Nulojix (1 Flasche, 1 Spritze): Aktuelle vs. neue Umverpackung

N2-Packung Nulojix (2 Flaschen, 2 Spritzen): Aktuelle vs. neue Umverpackung
Nulojix-Flaschen: Aktuelles vs. neues Etikett

Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert jeden Verdachtsfall einer Nebenwirkung an den Hersteller, das Bundesinstitut für Arzneimittel und Medizinprodukte (BfArM) oder die entsprechende Arzneimittelkommission zu melden.
Bristol Myers Squibb: Rote-Hand-Brief zu Nulojix