Das Medikament erfuhr bereits Anfang Oktober große Aufmerksamkeit, nachdem MSD positive Studiendaten der klinischen Phase-III-Studie MOVe-OUT seines Wirkstoffkandidaten Molnupiravir vorgelegt hatte. Hierbei senkte der Wirkstoff das Risiko einer Hospitalisierung oder eines Todesfalls um etwa 50 Prozent, wenn das Medikament in der Frühphase einer COVID-19-Infektion eingenommen wurde.
Was ist Molnupiravir und wofür wird es angewendet?
Molnupiravir ist ein Ribonukleosid-Analogon, das die virale RNA-abhängige RNA Polymerase targetiert. Der Wirkstoff wurde von Drug Innovations at Emory (DRIVE), einem gemeinnützigen Biotechnologieunternehmen, das sich vollständig im Besitz der Emory University befindet, entdeckt und dann von Merck in Zusammenarbeit mit Ridgeback Biotherapeutics entwickelt.
Molnupiravir (Lagevrio) ist indiziert zur Behandlung von Erwachsenen mit leichten bis mittelschweren Verläufen einer SARS-Coronavirus-2-Infektion, wenn diese mindestens einen Risikofaktor für die Entwicklung eines schweren Krankheitsverlaufes aufweisen. Zu den Risikofaktoren gehören Adipositas, Alter über 60 Jahre, Diabetes mellitus und Erkrankungen des Herzens.
Wie wird Molnupiravir angewendet?
Molnupiravir sollte nach der Diagnose von COVID-19 so schnell wie möglich und innerhalb von fünf Tagen nach Auftreten der Symptome angewendet werden. Der Wirkstoff wird hierbei oral angewendet.
Dosierung
Die empfohlene Dosis beträgt 800 mg (vier 200-mg-Kapseln) oral alle 12 Stunden für 5 Tage.
Wie wirkt Molnupiravir?
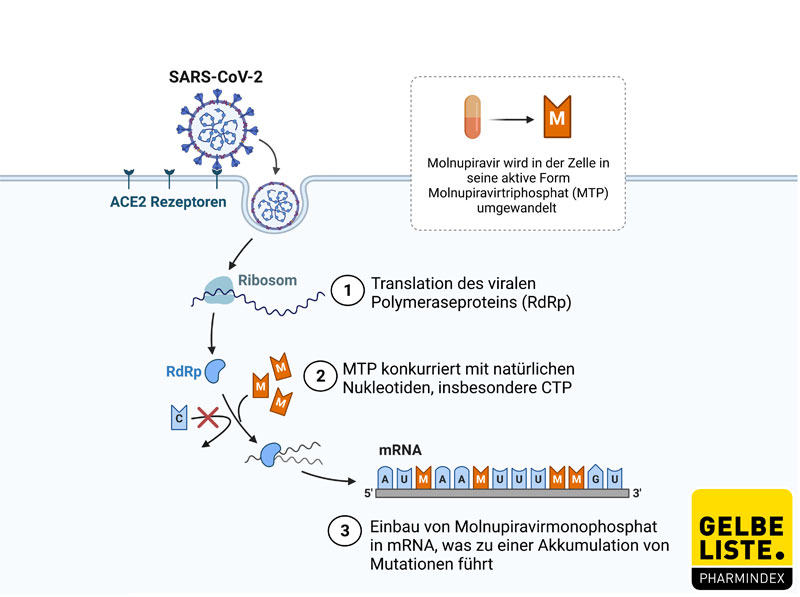
Viren nutzen Zellen des infizierten Organismus, um die Replikation ihres Genoms sicherzustellen und neue infektiöse Viruspartikel zu generieren. Dabei sorgen virale RNA Polymerasen für eine korrekt ablaufende Transkription des viralen Genoms mit den zur Verfügung stehenden Nukleosiden bzw. Nukleotiden der Wirtszelle.
Das Prodrug Molnupiravir wird im Plasma zu β-D-N4-Hydroxycytidin (NHC) gespalten und anschließend von wirtseigenen Kinasen zum aktiven Molnupiravir-5‘-Triphosphat (MTP) phosphoryliert.
MTP ist ein Nukleotidanalogon von Cytidintriphosphat (CTP) und in seiner tautomeren Form unter anderem auch von Uridintriphosphat (UTP). Somit konkurriert MTP als Substrat der (SARS-CoV-2-)RNA-abhängigen RNA Polymerase vorwiegend mit CTP aber auch mit UTP und führt zu C zu U Mutationen, sowie G zu A Mutationen. Die Replikation des viralen Genoms wird dabei nicht inhibiert. Vielmehr bedingt eine steigende Mutationslast das Ende der Virusreplikation und unterbricht die Generierung weiterer Viruspartikel. Klinisch wird infolgedessen die Viruslast gesenkt.
Gegenanzeigen
Molnupiravir darf nicht bei bekannter Überempfindlichkeit gegen den Wirkstoff oder gegen einen der sonstigen Bestandteile des Arzneimittels angewendet werden
Nebenwirkungen
In einer Zwischenanalyse einer Phase-III-Studie mit Patienten mit leichtem bis mittelschwerem COVID-19, die mit Molnupiravir (n=386) behandelt wurden, waren die häufigsten Nebenwirkungen (≥1% der Patienten) während der Behandlung und 14 Tage nach der letzten Dosis:
- Durchfall (3%)
- Übelkeit (2%)
- Schwindel (1%)
- Kopfschmerzen (1%)
Wechselwirkungen
Nach Angaben der Fachinformation konnten aufgrund der begrenzten verfügbaren Daten keine Arzneimittelwechselwirkungen identifiziert werden. Es wurden keine klinischen Wechselwirkungsstudien mit Molnupiravir durchgeführt. Da der Metabolit NHC kein Substrat wichtiger arzneimittelmetabolisierender Enzyme oder Transporter ist, wird die Möglichkeit einer Wechselwirkung von Molnupiravir oder NHC mit Begleitmedikationen als unwahrscheinlich erachtet.
Studienlage
- Das Nukleosidanalogon NHC zeigt bei Mäusen, Meerschweinchen, Frettchen und in menschlichen Atemwegsepithelorganoiden eine starke Aktivität gegen Influenzaviren.
- In den USA laufen mehrere klinische Studien, darunter auch eine Phase-II/III-Studie (NCT04575584).
- In Nature Microbiology wurden erste Daten an Untersuchungen mit Tieren veröffentlicht, die zeigten, dass Molnupiravir bei mit SARS-CoV-2-infizierten Frettchen die Menge an ausgeschiedenem Virus so stark reduzierte, dass die Tiere nicht mehr ansteckend waren.
- Am 9. Februar 2021 wurden weitere Daten in Nature publiziert, die zeigen, dass Molnupiravir bei immundefizienten Mäusen mit transplantiertem menschlichen Lungengewebe die Virusreplikation im Lungengewebe und eine Infektion verhindern konnte.
- Am 15. April 2021 gaben die Unternehmen Merck und Ridgeback Biotherapeutics bekannt, dass der ambulante Teil der Phase-III-Studie (MOVe-OUT) mit nicht hospitalisierten COVID-19-Patienten fortgesetzt, die Studie an stationär behandelten Patienten (MOVe-IN) dagegen nicht weitergeführt wird (Daten von MOVe-IN würden darauf hinweisen, dass Molnupiravir bei Krankenhauspatienten keinen klinischen Nutzen zeige).
- Anfang Oktober 2021 legte der US-Pharmakonzern MSD positive Studiendaten vor, wonach Molnupiravir bei früher ambulanter Therapie zu einer Halbierung der Hospitalisierungs- und Sterberate führte.
Aussicht
Am 25. Oktober 2021 gab die Europäische-Arzneimittelagentur bekannt, dass der Ausschuss für Humanarzneimittel (CHMP) mit dem Zulassungsverfahren von Molnupiravir zur Behandlung erwachsener Patienten mit COVID-19 begonnen habe. Wie lange es dauern wird bis Molnupiravir auch in Europa eine Zulassung erhält, kann zum jetzigen Zeitpunkt noch nicht abgeschätzt werden.