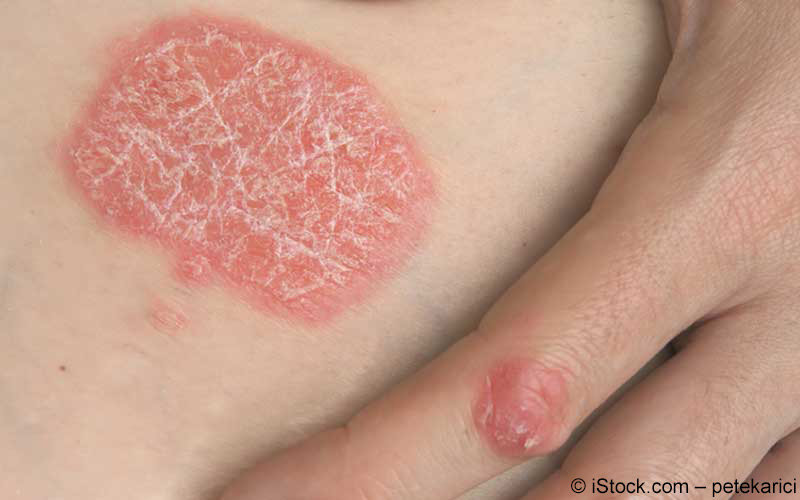
Der monoklonale Antikörper Ixekizumab wurde im April 2016 von der EMA zugelassen und wird nun von Lilly Deutschland GmbH als Fertigspritze und Fertigpen unter dem Handelsnamen Taltz® auf den deutschen Markt gebracht. Die Anwendung von Taltz® ist für die Behandlung von mäßiger bis schwerer Plaque-Psoriasis bei Erwachsenen indiziert.
Wie wirkt das neue Biological?
Der monoklonale Antikörper Ixekizumab bindet das proinflammatorische Interleukin-17A (IL-17A), welches ein Schlüsselzytokin im Krankheitsbild der Psoriasis ist. Diese Bindung bewirkt, dass IL-17A nicht mehr wirken kann. Als Folge werden eine Reihe anti-inflammatorischer Effekte ausgelöst. Diese Entzündungshemmung beruht vor allem auf einer Proliferationshemmung und Aktivierung von Keratinozyten.
Rund 300.000 Betroffene dürfen sich freuen
An der Autoimmunerkrankung Psoriasis leiden rund 2 bis 3% der Bevölkerung in Mitteleuropa. Ixecizumab ist ein Nachfolger von Secukinumab (Cosentyx®), welcher im Januar 2015 von Novartis Pharma GmbH auf den Markt gebracht wurde. Insgesamt gibt es nun drei neue Biopharmazeutika, die sich gegen IL-17A richten:
- Brodalumab
- Secukinumab
- Ixekizumab
Wie wird Taltz® angewendet?
Der monoklonale Antikörper Ixekizumab kann von Patienten selbst injiziert werden. Taltz® kommt als Fertigspritze und als Fertigpen mit je 80 mg Wirkstoff auf den Markt. Die Therapie wird mit 160 mg eingeleitet und im zweiwöchigen Abstand mit 80 mg fortgesetzt.
Ixekizumab erreicht nach subkutaner Injektion nach 4 bis 7 Tagen eine mittlere maximale Plasmakonzentration und hat eine durchschnittliche Bioverfügbarkeit von 54 bis 90 Prozent. Die mittlere Eliminationshalbwertszeit von Taltz® beträgt 13 Tage. Bei Ansprechen auf die Therapie genügt eine vierwöchige Applikation des Arzneimittels. Die Therapiedauer wird mit insgesamt 12 Wochen angegeben.
Verbesserung der Lebensqualität
Nach 12 Wochen Ixekizumab-Behandlung sprachen innerhalb einer Studie 89,7 Prozent der Patienten positiv auf die Therapie an, unter Etanercept 41,8 Prozent. Eine völlige bis fast vollständige Abheilung trat innerhalb der durchgeführten Studien unter Ixekizumab häufiger auf als unter einer Vergleichstherapie und Placebo-Behandlung. Innerhalb der Zulassungsstudien hatten 40 Prozent der Psoriasis-Patienten nach 12 Wochen Ixekizumab-Anwendung eine völlig erscheinungsfreie Haut. Taltz® war nach zwölfwöchiger Therapie außerdem mit einer statistisch signifikanten Verbesserung der gesundheitsbezogenen Lebensqualität verbunden.
Nebenwirkungen
Die am häufigsten berichteten Nebenwirkungen (≥ 1/10) unter Taltz®-Behandlung waren Infektionen der oberen Atemwege und Reaktionen an der Einstichstelle. Als häufig auftretende Nebenwirkungen (≥ 1/100, < 1/10) werden oropharyngeale Schmerzen, Tinea-Infektion und Übelkeit angegeben. Die meisten unerwünschten Reaktionen waren jedoch von milder bis mäßiger Schwere.
Ab 1. März 2017 verordnungsfähig
Taltz® wird aller Voraussicht nach erst zum 1. April 2017 in der ärztlichen Praxis-Software zu finden sein, da diese nur quartalsweise aktualisiert wird. Das Arzneimittel kann jedoch ab dem 1. März 2017 verordnet werden.














