Molnupiravir befindet sich seit dem 25. Oktober 2021 im Rolling-Review-Verfahren der EMA. In Großbritannien wurde das Corona-Medikament bereits Anfang November zugelassen. Vergangene Woche hatte der Ausschuss für Humanarzneimittel (CHMP) eine Empfehlung zur Anwendung von Molnupiravir vorgelegt, wonach das Medikament zur Behandlung von erwachsenen Risikopatienten mit COVID-19 angewendet werden kann, wenn diese keinen zusätzlichen Sauerstoff benötigen.
Wichtig sei, dass die Anwendung von Lagevrio so schnell wie möglich nach der Diagnose und innerhalb von fünf Tagen nach Symptombeginn erfolge. Molnupiravir ist in Form von Kapseln erhältlich und soll fünf Tage lang zweimal täglich eingenommen werden.
Lagevrio wird während der Schwangerschaft und bei Frauen, die keine wirksame Empfängnisverhütung anwenden, nicht empfohlen. Der Ausschuss gibt an, dass Frauen, während der Behandlung und für vier Tage nach der letzten Dosis von Lagevrio eine wirksame Verhütungsmethode anwenden müssen. Auch sollte das Stillen während der Behandlung und für vier Tage nach der Behandlung unterbrochen werden.
Wie wirkt Molnupiravir?
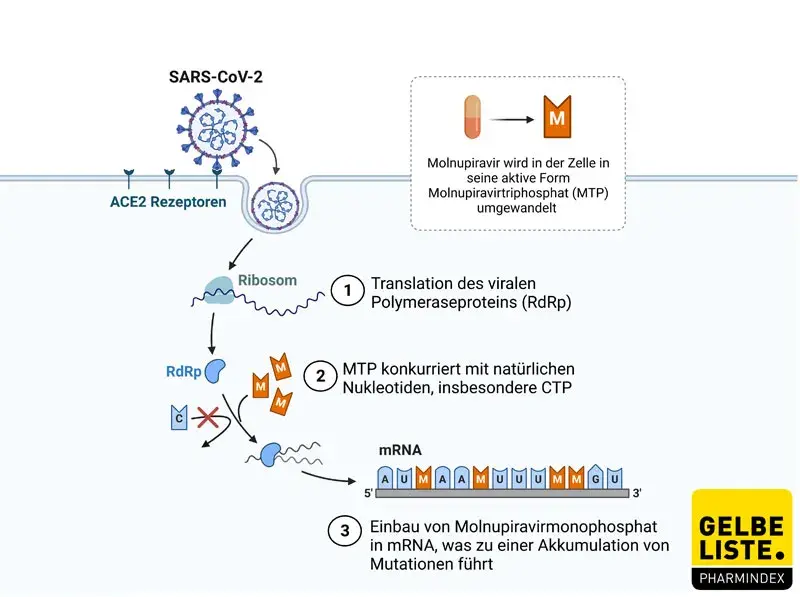
Das Prodrug Molnupiravir wird im Plasma zu β-D-N4-Hydroxycytidin (NHC) gespalten und anschließend von wirtseigenen Kinasen zum aktiven Molnupiravir-5‘-Triphosphat (MTP) phosphoryliert. MTP ist ein Nukleotidanalogon von Cytidintriphosphat (CTP) und in seiner tautomeren Form unter anderem auch von Uridintriphosphat (UTP). Somit konkurriert MTP als Substrat der (SARS-CoV-2-)RNA-abhängigen RNA Polymerase vorwiegend mit CTP aber auch mit UTP und führt zu C zu U Mutationen, sowie G zu A Mutationen. Die Replikation des viralen Genoms wird dabei nicht inhibiert. Vielmehr bedingt eine steigende Mutationslast das Ende der Virusreplikation und unterbricht die Generierung weiterer Viruspartikel. Klinisch wird infolgedessen die Viruslast gesenkt.