Paxlovid (150 mg Nirmatrelvir [PF-07321332] plus 100 mg Ritonavir Filmtabletten) ist zugelassen zur Behandlung einer Covid-19-Erkrankung bei Erwachsenen, die keine zusätzliche Sauerstoffzufuhr benötigen und ein erhöhtes Risiko für einen schweren Covid-19-Verlauf haben [1]. Gemäß Robert Koch-Institut (RKI) trifft dies auf Menschen ohne vollständige Immunisierung gegen Covid-19 sowie Patienten mit vollständiger Immunisierung und Immunkompetenz, aber komplexen Risikofaktoren zu [2]. Ein stark erhöhtes Risiko für einen schweren Krankheitsverlauf besteht ab einem Alter ≥65 Jahren, Diabetes mellitus, chronischen Nierenbeschwerden und Adipositas mit BMI ≥40 kg/m2 [3].
Aufgrund der ungewöhnlichen Verblisterung und den teilweise verwirrenden Angaben auf der Packung sowie in den Fach- und Gebrauchsinformationen kam es in den USA und einigen europäischen Ländern bereits zu Dosierungsfehlern. Jetzt informiert auch die Arzneimittelkommission der deutschen Ärzteschaft (AkdÄ) über zwei gemeldete Fälle einer inkorrekten Paxlovid-Anwendung [4].
Fall 1
Im ersten Fall beschwerte sich ein stationär behandelter Patient, dass er am ersten Abend der Einnahme nur zwei rosa Tabletten bekam und seine komplette letzte morgendliche Gabe fehlte. Grund war ein Missverständnis der in der Kurve eingetragenen Dosierung >>Paxlovid 300/100 mg 1–0–1<<. So sei nicht ersichtlich gewesen, dass zu jedem Einnahmezeitpunkt drei Tabletten gestellt werden müssen [4].
Fall 2
Im zweiten Fall fiel im Rahmen einer Routinekontrolle eine Packung Paxlovid™ auf, die zu diesem Zeitpunkt aufgebraucht hätte sein müssen. Diese enthielt jedoch sowohl vollständige Blister als auch einzelne Tabletten. Gründe dafür konnten nicht abschließend eruiert werden. Anzunehmen sei eine mangelnde Kommunikation und Nichtbeachtung der schriftlichen Anwendungsinformationen zu Paxlovid [4].
Pro Dosis drei Tabletten
Die vom Hersteller Pfizer empfohlene Dosierung beträgt 300 mg Nirmatrelvir und 100 mg Ritonavir. Diese sollte gleichzeitig alle zwölf Stunden über einen Zeitraum von fünf Tagen eingenommen werden. Das sind pro Dosis drei Filmtabletten.
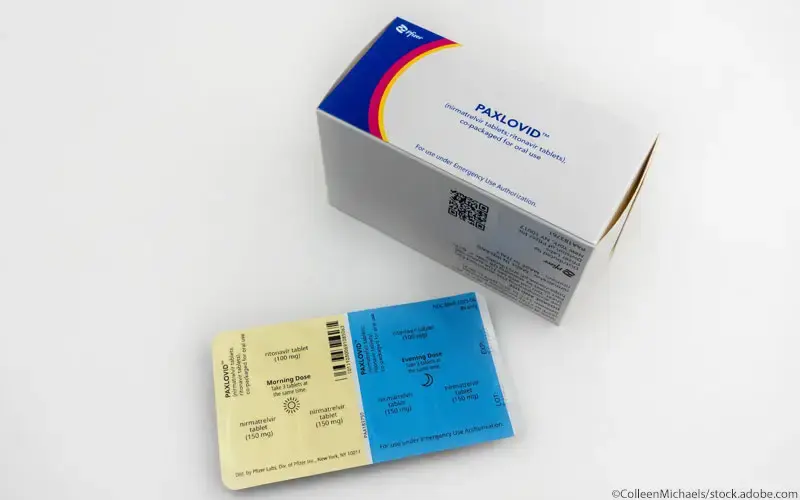
Verblisterung
Eine Paxlovid-Packung beinhaltet fünf Blister in unterschiedlichen Farben: jeweils einen Blister pro Einnahmetag. Je Blister gibt es zwei Abschnitte. Der Bereich mit der Dosis für die morgendliche Einnahme ist golden und mit einem Sonnensymbol versehen, ggf. auch mit der Aufschrift „Morning Dose“. Die abendliche Dosis ist blau und mit einem Halbmondsymbol gekennzeichnet, ggf. auch mit der Aufschrift „Evening Dose“.
Jede Unterteilung beinhaltet drei Filmtabletten:
- zwei rosafarbene, ovale Tabletten mit der Prägung „PFE“ auf einer und „3CL“ auf der anderen Seite (Nirmatrelvir) und
- eine weiße bis cremefarbene, kapselförmige Tablette mit der Prägung „H“ auf einer und „R9“ auf der anderen Seite (Ritonavir) [1,4].
Anwendung
Für eine korrekte Dosierung muss der Patient also morgens zwei rosafarbene und eine weiße Tablette und abends zwei rosafarbene und eine weiße Tablette einnehmen.
Bei mäßig eingeschränkter Nierenfunktion (eGFR ≥30 bis <60 ml/min) empfiehlt der Hersteller 150 mg Nirmatrelvir und 100 mg Ritonavir alle zwölf Stunden über fünf Tage [1]. Dies entspricht der Einnahme von einer rosafarbenen und einer weißen Tablette morgens und einer rosafarbenen und einer weißen Tablette abends [1,4].
Probleme bei der Dosierung
Gemäß der AkdÄ könnten folgende Punkte einen Fehlgebrauch von Paxlovid begünstigen und zu Medikationsfehlern führen [4]:
- Laut dem Bundesinstitut für Arzneimittel und Medizinprodukte (BfArM) wird Paxlovid in Deutschland übergangsweise mit einer englischen Verpackung und ohne Gebrauchsinformation vertrieben [5]. Erste Lieferungen von Paxlovid mit deutschsprachiger Aufmachung und deutschsprachiger Produktinformation sind hierzulande bereits verfügbar und werden sich nach und nach im Markt zeigen.
- Hausärzte, die Paxlovid direkt an die Patienten abgeben, sollen das Arzneimittel mit der aktuellen Gebrauchsinformation in deutscher Sprache aushändigen. Dies gilt auch bei der Abgabe von Paxlovid in Apotheken. Dabei handelt es sich um ein siebenseitiges Dokument, das seit der erstmaligen Zulassung mehrmals aktualisiert wurde [6].
- Sowohl in der Fachinformation als auch in der Gebrauchsinformation wird Nirmatrelvir kein einziges Mal namentlich erwähnt, sondern ausschließlich als PF-07321332 bezeichnet. In der Fachinformation steht die komplette chemische Bezeichnung: (1R,2S,5S)-N-((1S)-1-Cyano-2-((3S)-2-oxopyrrolidin-3-yl)ethyl)-3-((2S)-3,3-dime- thyl-2-(2,2,2-trifluoracetamido)butanoyl)-6,6-dimethyl-3-azabicyclo[3.1.0]hexan-2-carboxamid. Auf dem Blister und dem Umkarton werden die enthaltenen Wirkstoffe als PF-07321332 und Ritonavir angegeben. Dass PF-07321332 Nirmatrelvir entspricht, ist vermutlich nicht mal für Ärzte und Apotheker sofort erkennbar, für Patienten gleich gar nicht.
- Die ungewöhnliche Verblisterung und die Dosisabgabe mit mehreren Tabletten könnten Patienten und Pflegepersonal irritieren. In der Regel werden Wirkstoffe, die obligat zusammen eingenommen werden müssen, als Fixkombinationen mit zwei oder drei Wirkstoffen in einer einzelnen Tablette bzw. Kapsel vermarktet.
- Die Beschriftung mit „Morning Dose“ und „Evening Dose“ (USA-Blister) bzw. die Piktogramme „Sonne“ und „Halbmond“ könnten Unter- bzw. Überdosierungen begünstigen, wenn eine Einnahme vergessen wurde und nachgeholt werden soll wie in der Produktinformation empfohlen. Zum Beispiel darf keine Einnahme der vergessenen abendlichen Dosis am Morgen danach erfolgen. Hier gilt eine 8-Stunden-Frist, um eine vergessene Dosis nachzuholen.
- Paxlovid wird vor allem bei Risikopatienten zum Einsatz kommen. Die überwiegende Mehrheit dieser Klientel ist älter, multimorbide und mit einer Mehrfachmedikation versorgt, sodass möglicherweise das komplexe Einnahmeschema nicht befolgt werden kann.
- Patienten und Pflegepersonal, die kein Englisch sprechen bzw. verstehen, könnten Schwierigkeiten mit der richtigen Einnahme des Arzneimittels haben.
- Das ungewöhnliche Dosierungsregime mit den damit verbundenen nicht einfach umzusetzenden Dosierungsangaben auf Rezepten oder Patientenkurven birgt per se ein beträchtliches Risiko für Fehldosierungen, und zwar in beiden Richtungen – sowohl für Unter- als auch für Überdosierungen.
- Besondere Aufmerksamkeit ist auf Patienten mit mäßiger Nierenfunktionsstörung zu legen, weil sich hier das Dosierungsregime ändert. Dieser Umstand kann ebenso Medikationsfehler bedingen.
EudraVigilance-Datenbank
In der Europäischen Datenbank gemeldeter Verdachtsfälle von Arzneimittelnebenwirkungen (EudraVigilance-Datenbank) sind bereits verschiedenste Probleme bzw. mögliche Medikationsfehler unter der Behandlung mit Paxlovid beschrieben, etwa:
- versehentliche Über- oder Unterdosierung
- zusätzlich verabreichte Dosis
- unangebrachter Zeitplan der Verabreichung oder des Absetzens
- inkorrekte Dosis gegeben
- inkorrekte Dauer der Gabe
- Fehler bei der Produktverabreichung
- produktbezogene Kommunikationsprobleme
- Problem mit dem Auslassen einer Dosis oder versehentliches Auslassen einer Dosis
- Fehler bei der Verordnung [7]
Maßnahmen zur Fehlervermeidung
Gebrauchsinformation in deutscher Sprache aushändigen
Hausärzte und ApothekerInnen müssen darauf achten, Paxlovid mit der aktuellen Gebrauchsinformation in deutscher Sprache auszuhändigen. Der Patient ist darauf hinzuweisen, dass es sich um die Gebrauchsinformation (Packungsbeilage, Beipackzettel) handelt und nicht um ein sonstiges Informationsblatt. Bestenfalls sollte bereits vor Ort die Dosierung erläutert und nochmals vom Patienten wiederholt werden.
Informationsmaßnahmen für Pflegekräfte
In Kliniken und anderen medizinischen Einrichtungen, in denen Arzneimittel individuell für den jeweiligen Patienten zusammengestellt werden, müssen die Pflegekräfte für die Problematik durch geeignete Informationsmaßnahmen sensibilisiert werden. Dazu gehören schriftliche Kurzinformationen, Schulungen des Personals und ggf. Rücksprache mit der versorgenden Apotheke.
Auf richtige Dosierungsangabe achten
Ärzte und Ärztinnen müssen auf die richtige Dosierungsangabe achten. Im stationären Bereich sollten krankenhausspezifische Strategien für die Eintragung in die Patientenkurve überlegt werden. Die AkdÄ gibt folgende Vorschläge:
Paxlovid über 5 Tage
3–0–3 (je 2 rosa Tabletten + 1 weiße Tablette) oder:
Paxlovid über 5 Tage
150 mg Nirmatrelvir (rosa Tabletten): 2–0–2 und
100 mg Ritonavir (weiße Tabletten): 1–0–1
Für Patienten mit mäßig eingeschränkter Nierenfunktion (eGFR ≥30 bis <60 ml/min) sollte die Dosis angepasst werden, um eine Überexposition zu vermeiden. Dokumentationsbeispiele wären:
Paxlovid über 5 Tage
2–0–2 (je 1 rosa + 1 weiße Tablette) oder:
Paxlovid über 5 Tage
150 mg Nirmatrelvir (rosa Tabletten): 1–0–1 und
100 mg Ritonavir (weiße Tabletten): 1–0–1
Auch im bundeseinheitlichen Medikationsplan muss die richtige Dosierungsangabe eingetragen werden, ggf. unter Angabe von Freitext.
Beratung
Ärzte, Ärztinnen und ApothekerInnen sollten bei der Abgabe von PaxlovidTM an Patienten explizit auf die Modalitäten der Einnahme im Rahmen der Beratung eingehen.
Anpassung der Produktinformation
Grundsätzlich wären längerfristig regulatorische Anpassungen der Produktinformation wünschenswert, unter anderem mit namentlicher Nennung von Nirmatrelvir, einer Änderung des Packungsdesigns und der Packungsbeilage (in deutscher Sprache, bebilderte Gebrauchsinformation in der Packung inkludiert) sowie die Erstellung von Schulungsmaterial (etwa bebilderte Einnahmeanweisung für Patienten bzw. Pflegekräfte).
In den USA wurde die Produktinformation bereits angepasst, nachdem auch dort zahlreiche Medikationsfehler gemeldet worden waren, die insbesondere auf Verwirrungen der Patienten bezüglich der Einnahmemodalitäten und der Beschriftung der Packung zurückzuführen waren [7]. Seit September 2022 enthält die US-amerikanische Gebrauchsinformation beispielsweise bebilderte Einnahmeinstruktionen [8]